膝痹通络方通过调节MAPK-MEK信号通路延缓对白细胞介素1β诱导的关节软骨细胞退变
宋奕, 丁道芳, 朱寅, 王星华
(1.苏州市中西医结合医院,江苏苏州 215000;2.上海中医药大学附属曙光医院石氏伤科医学中心,上海 201203;3.上海市中医药研究院骨伤科研究所,上海 201203)
骨性关节炎(osteoarthritis,OA)好发于使用频繁,且负重大、活动多的关节,如膝、髋、脊柱、踝等,其中又以膝关节骨性关节炎(knee osteoarthritis,KOA)最为常见。根据最新的流行病学调查数据显示,我国目前症状性KOA 的患病率为8.1%,这一比例意味着我国目前大约有1.1 亿KOA 患者,而65 岁以上KOA 患病率甚至已达到50%[1]。KOA 的主要病理改变是软骨的退行性变。正常情况下软骨细胞外基质的合成和降解是一个动态平衡的过程,而在KOA 状态,这一平衡被打破,最终导致软骨细胞的退变和凋亡,细胞外基质的松散。有学者研究发现,关节腔的炎症是导致这一平衡被打破的主要原因之一,且KOA 发病过程中的炎症反应及软骨退变都有丝裂原活化蛋白激酶(MAPK)- MAPK 激酶(MEK)信号通路参与。对于KOA 的治疗,目前除了健康教育和功能锻炼外,仍以药物治疗为主。膝痹通络方是苏州市中西医结合医院治疗KOA 的经验方,临床取得较好疗效,能显著改善膝关节疼痛及活动度。炎症因子白细胞介素1β(IL-1β)是KOA 炎症反应中的关键因子,本研究通过以其诱导软骨细胞退变模拟KOA 软骨退变,观察膝痹通络方含药血清对退变软骨细胞的影响,并从MAPK-MEK 信号通路探讨其作用机制,现将研究结果报道如下。
1 材料与方法
1.1动物新生24 h 雌性SD 大鼠10 只,清洁级雌性3 月龄SD 大鼠20 只,体质量(200±20)g,购自上海实验动物资源中心,动物质量合格证号:SCXK(沪2008-0016)。
1. 2药物、试剂与仪器膝痹通络方组成中药(杜仲10 g,牛膝10 g,黄芪20 g,当归10 g,川芎10 g,白芍10 g,独活10 g,鸡血藤30 g,秦艽6 g,木瓜10 g)由苏州市中西医结合医院提供,为江阴江天药业免煎颗粒剂;胎牛血清、H-DMEM培养基、胰蛋白酶(法国Biowest 公司);IL-1β(美国RD 公司);4’,6-二脒基-2-苯基吲哚(DAPI)染料(美国Sigma 公司);PCR 试剂盒(美国Selleck 公司);性别决定区Y框蛋白(SOX9)抗体、基质金属蛋白酶13(MMP13)抗体、磷酸化原癌基因丝苏氨酸蛋白激酶(P-Raf1)抗体、Raf1 抗体、磷酸化丝裂原活化蛋白激酶激酶(p-MEK1)抗体、MEK1抗体、GAPDH 抗体、异硫氰酸荧光素(FITC)抗体(美国EarthOx 公司)。离心机(德国Sigma 公司);多功能酶标仪(美国BioTek 公司);CO2恒温培养箱(美国Thermo Scientific 公司);IX41 显微镜(日本Olympus公司)。
1.3软骨细胞培养方法及免疫荧光鉴定采用上海中医药大学附属曙光医院石氏伤科医学中心已成熟的软骨细胞培养方法[2]。将10只新生24 h雌性SD 大鼠脱颈椎处死,取双侧肱骨头处软骨,清除残留组织后剪成1 mm × 1 mm × 1 mm 大小骨块,在37 ℃细胞培养箱内用1 g/L 的Ⅱ型胶原酶消化1 h,收集消化后的细胞悬浮液,并重复3~4 次,悬浮液离心后收集细胞,细胞培养液重悬并接种细胞,隔日换液。取P1代细胞进行实验。
细胞鉴定:以40 g/L多聚甲醛固定细胞10 min后磷酸盐缓冲液(PBS)冲洗2 次,磷酸盐Tween20缓冲液(PBST)通透20~30 min,体积分数5%牛血清白蛋白(BSA)室温封闭浸泡1 h,加入Ⅱ型胶原抗体(稀释度为1∶200),4 ℃孵育过夜。再用PBS清洗3 次,加入FITC 标记的抗小鼠二抗(稀释度1∶200),室温避光孵育1 h,PBST 清洗3次后加入DAPI 染液(10 μg/L),5 min 后荧光倒置显微镜下观察细胞并拍照。
1.4膝痹通络方含药血清制备膝痹通络方中药颗粒剂混合后用开水冲泡,充分搅拌溶解、冷却,根据人-大鼠体表面积比值折算出大鼠口服剂量为10.86 g·kg-1·d-1,以5.43、10.86、21.72 g·kg-1·d-1的口服剂量分别设为低、中、高浓度组。将20 只清洁级雌性3 月龄SD 大鼠随机分成4 组,其中正常组8只,高、中、低浓度中药组各4只,每200 g体质量大鼠每日灌胃2 mL,高、中、低浓度中药组大鼠分别对应灌胃高、中、低浓度膝痹通络方,正常组每日灌胃等体积生理盐水。每日灌服1 次,连续3 d。末次灌药1 h后腹主动脉取血,取上层血清56 ℃灭活后过滤分装,于4 ℃保存备用。
1.5细胞分组培养收集生长状态良好的软骨细胞,调整细胞密度为5×105个/mL,以5 mL接种于直径6 cm 培养皿,将细胞随机分为5 组,即正常对照组、IL-1β 组、高浓度中药组、中浓度中药组和低浓度中药组。正常对照组:加入正常大鼠血清培养;IL-1β组:加入正常大鼠血清和20 ng/mL IL-1β培养;高、中、低浓度中药组:分别对应加入高、中、低浓度的膝痹通络方含药血清进行培养,并加入20 ng/mL IL-1β。培养24 h后,倒置显微镜(100 倍)下观察软骨细胞大小、密度与形态,同时提取细胞RNA 和蛋白进行定量聚合酶链反应(qPCR)和蛋白免疫印迹(Western Blot)法检测。
1.6 qPCR法检测软骨细胞MMP3、SOX9、A-CAN、ADAMTS4/5基因的表达细胞培养24 h 后,抽提软骨细胞总RNA并进行浓度测定,取2 μg RNA 逆转录,进行qPCR 检测。每个样品设3 个复孔,重复3次。以GAPDH作为内参基因,采用2-△△Ct法计算目的基因表达的相对变化,引物序列见表1。反应条件:95 ℃30 s,初步变性1 个循环;95 ℃5 s变性,60 ℃30 s 退火,重复40 个循环;72 ℃30 s延伸。

表1 PCR引物序列Table 1 PCR primer sequences
1.7 Western Blot法检测软骨细胞SOX9、MMP13、P-Raf1、Raf1、P-MEK1、MEK1蛋白表达细胞培养24 h 后进行细胞裂解提取蛋白,测定浓度,分装,于-20 ℃冰箱保存备用。蛋白电泳、转膜,温封闭液浸泡1 h,加入上述一抗孵育过夜,洗膜后,再加入二抗温孵育1 h,洗膜,化学发光法检测并X 线胶片曝光显影,应用ImageJ 软件进行灰度值分析。
1.8统计方法采用SPSS 19.0统计软件进行数据分析,所有数据以均数±标准差(x±s)表示,组间差异通过单因素方差分析并采用LSD-t法进行多重比较,以P<0.05为差异有统计学意义。
2 结果
2.1软骨细胞的免疫荧光染色鉴定倒置荧光显微镜下观察到细胞质经Ⅱ型胶原免疫荧光染色后发出鲜亮的红色荧光(见图1-a),为强阳性表现,证实为软骨细胞,细胞核未着色,表明Ⅱ型胶原蛋白在细胞核内无表达。几乎所有细胞经DAPI 染色后细胞核均发出蓝色荧光(见图1-b)。图1-c 为图1-a和图1-b的叠加,绝大多数细胞表达Ⅱ型胶原蛋白,证明提取的软骨细胞纯度高。
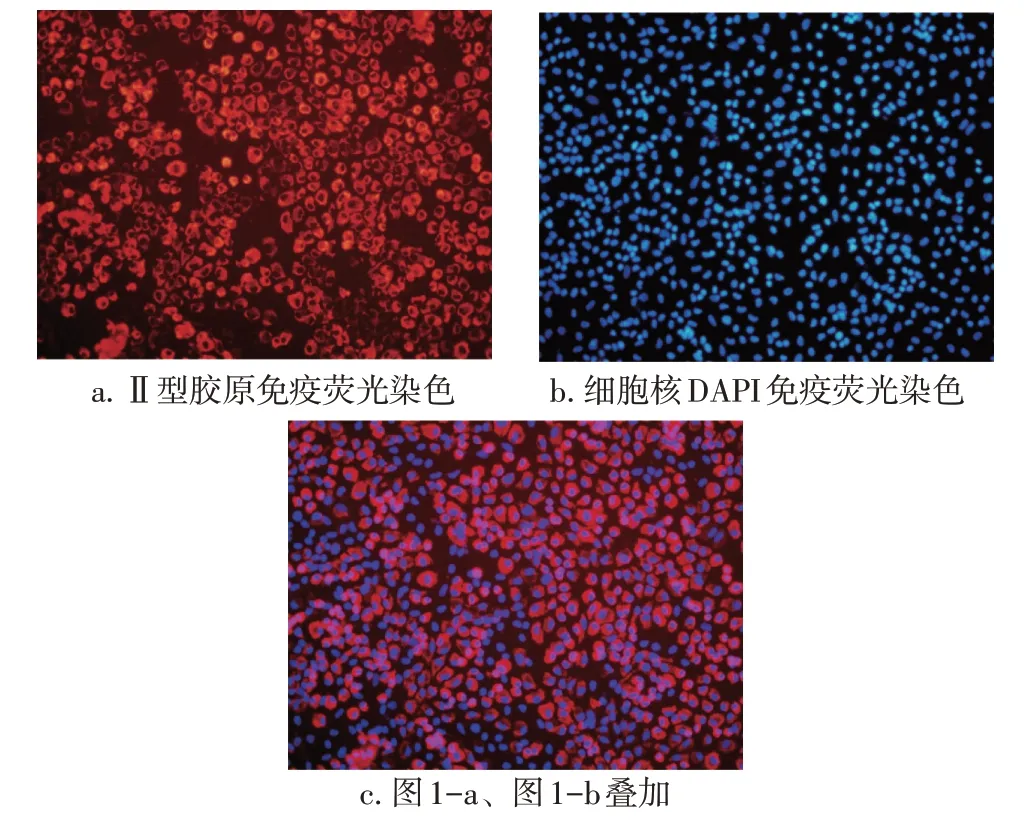
图1 软骨细胞Ⅱ型胶原的免疫荧光染色Figure 1 Immunofluorescence staining results for typeⅡcollagen in chondrocytes

图2 各组软骨细胞形态比较(×100)Figure 2 Comparison of the morphological features of chondrocytes in various groups(×100)
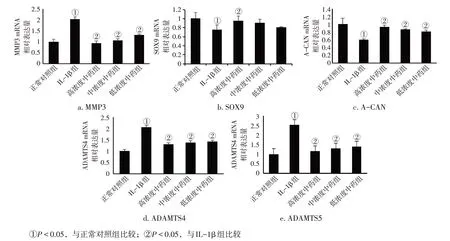
图3 各组软骨细胞MMP3、SOX9、A-CAN、ADAMTS4、ADAMTS5基因表达比较(±s)Figure 3 Comparison of the expression levels of MMP3,SOX9,A-CAN,ADAMTS4,ADAMTS5 genes in chondrocytes of various groups(±s)
2. 2各组软骨细胞形态比较倒置显微镜下可见:正常对照组软骨细胞呈三角形、多角形,形态饱满,融合后呈“铺路石”样;与正常对照组比较,IL-1β组及各浓度中药膝痹通络方组软骨细胞形态明显细长、单薄,呈长梭形改变,呈明显的退变形态,但各浓度中药组软骨细胞退变形态较IL-1β组减轻。见图2。
2. 3各组软骨细胞MMP3、SOX9、A-CAN、ADAMTS4、ADAMTS5基因表达比较图3 结果显示:与正常对照组比较,IL-1β 组软骨细胞MMP3、ADAMTS4、ADAMTS5 mRNA 表达水平明显升高(P<0.05),SOX9、A-CAN mRNA 表达水平降低(P<0.05);与IL-1β 组比较,各浓度中药组软骨细胞MMP3、ADAMTS4、ADAMTS5 mRNA表达水平明显降低,SOX9、A-CAN mRNA 表达水平升高,其中,高浓度中药组差异均有统计学意义(P<0.05)。
2.4各组软骨细胞MMP13、SOX9、P-Raf1、Raf1、P-MEK1、MEK1 蛋白表达比较图4 结果显示:与正常对照组比较,IL-1β 组软骨细胞MMP13 蛋白表达,Raf1、MEK1磷酸化水平明显升高,SOX9蛋白表达水平降低(均P<0.05)。与IL-1β 组比较,各浓度中药组MMP13蛋白表达、Raf1、MEK1磷酸化水平明显降低,SOX9 蛋白表达水平升高(均P<0.05)。
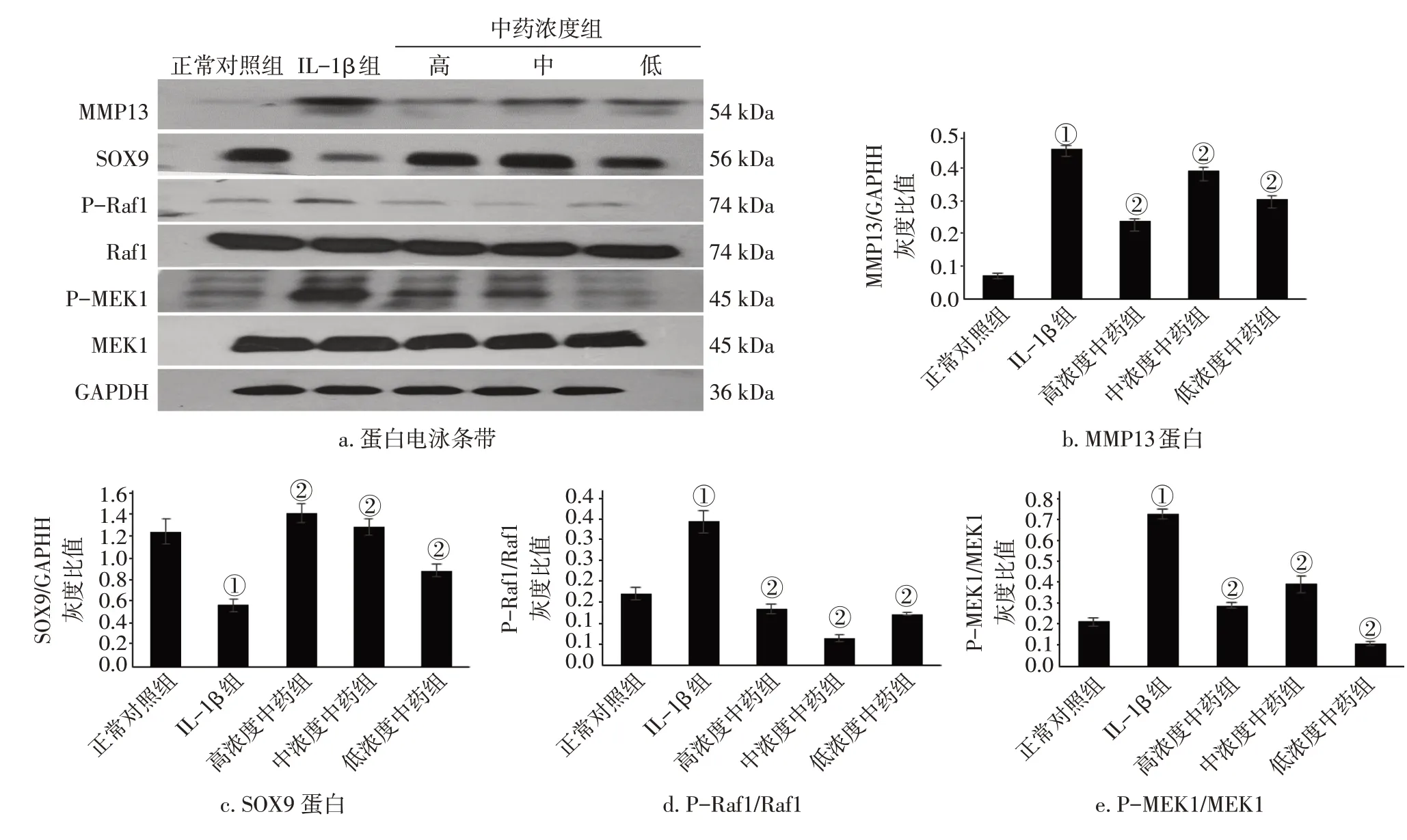
图4 各组软骨细胞MMP13、SOX9、P-Raf1、Raf1、P-MEK1、MEK1蛋白表达比较(±s)Figure 4 Comparison of the expression levels of MMP13,SOX9,P-RAF1,Raf1,P-Mek1,and MEK1 proteins in chondrocytes of various groups(±s)
3 讨论
3.1 KOA的中医学认识膝关节骨性关节炎(KOA)属于中医学“痹证”范畴,历代医家对于其论述及治法各有特色。其虽病位在筋骨,但本在于肾。老龄患者肝肾渐亏,髓枯血虚,筋骨失于濡养而不复坚固,损伤或复感风、寒、湿、热等外邪时疼痛发作,久病则筋脉挛缩,无力束骨,可引起关节不稳及屈伸不利症状。而血瘀则是机体衰退过程中潜在的病理因素,外伤劳损、气候变化都可致瘀血痹阻,阻碍筋骨关节的润养,加重关节的退化[3]。膝痹通络方是苏州市中西医结合医院骨科治疗KOA 的经验方,方中:杜仲、牛膝补肝肾、强筋骨;黄芪补气健脾;当归、川芎、白芍养血活血;独活、鸡血藤、秦艽、木瓜祛风除痹,舒筋通络。全方共奏补益肝肾、活血祛瘀之功。
3.2 KOA的现代医学认识现代医学认为,KOA患者因为年龄增长及膝关节力线的改变,膝关节长期处于疲劳状态,关节稳定性下降,软骨和半月板存在物理性磨损。而近些年来,关节滑膜的炎症所扮演的角色越来越得到重视,滑膜炎症的进展程度可以直接反映KOA 的严重程度,也是KOA 发生、发展的独立性危险因素[4-5]。有学者对只有症状而无影像学改变的KOA 患者进行关节镜随防,发现约50%的患者关节镜下有局限性滑膜炎症表现,且这些患者在1年之后,都出现了局部软骨破坏的表现[6]。在关节退变的早期即有炎症的参与,并伴随软骨细胞的退变、细胞外基质的破坏。当关节滑膜受到刺激,可诱发滑膜内血管增生扩张、滑膜细胞的活跃增生等一系列反应,并释放大量炎症因子,侵蚀关节内软骨,软骨在化学性侵蚀及物理性摩擦的恶性循环下,进行性磨损、变薄甚至缺如,致关节间隙变窄,软骨下骨质硬化。研究发现,IL-1 是关键性炎性因子之一,也是炎症发生的始动因素,可直接调节软骨细胞MMPs的生成,抑制蛋白多糖及Ⅱ型胶原等软骨基质的合成,促进软骨细胞的退变及凋亡,直接导致软骨的化学性损伤,加速骨关节炎的发生[7]。IL-1 又分IL-1α 和IL-1β 2 种亚型,其中IL-1β 是主要亚型,随着KOA 的病情发展,关节内IL-1β可呈持续性增高,基于此,本研究采用IL-1β作为软骨细胞退变的诱导因子,模拟KOA 患者体内软骨退变模型。
MMPs是一个庞大的蛋白酶超家族,其家族成员能降解几乎所有的细胞外基质,在膝关节,MMPs 可因IL-1 等炎症因子刺激后,由软骨细胞、滑膜细胞以及中性粒细胞产生,MMPs的过度表达,可加速软骨细胞外基质的降解,导致关节内软骨进行性破坏。在MMPs家族中,以MMP3和MMP13在KOA 的参与度最为突出。膝关节软骨细胞外基质中最为主要的成分是Ⅱ型胶原,其次为蛋白多糖,MMP13 是所有MMPs 家族中降解Ⅱ型胶原蛋白能力最强的,而MMP3 对于A-CAN 又有较高的裂解活性,随着细胞外基质的降解,软骨的生物学特点发生改变,抗应力能力也大大下降,加速退变,因此,MMP3 和MMP13 是反映KOA 软骨退变程度的重要标志物[8]。与MMPs 等经典蛋白酶相比,聚蛋白多糖酶家族(ADAMTSs)对KOA 的影响在近些年才逐渐受到重视,其中ADAMTS4 和ADAMTS5 是软骨细胞外A-CAN 的主要降解酶。研究发现,敲除ADAMTS4和ADAMTS5基因的小鼠在诱导KOA 过程中,与正常小鼠相比,仅出现了轻度膝关节退变,特别是敲除ADAMTS5 基因后,小鼠软骨缺损程度明显轻于敲除ADAMTS4 基因及正常的小鼠[9-10]。SOX9 对软骨细胞及细胞外基质的调节起着至关重要的作用,被称为软骨的“主调节因子”。SOX9 可同时调控Ⅱ型胶原及A-CAN 的表达促进软骨细胞外基质的生成与修复,又可抑制ADAMTS4 和ADAMTS5 等聚蛋白酶以及MMPs 在KOA 早期的表达,可以说是KOA软骨的保护器[11-12]。
3.3 MAPK-MEK信号通路在KOA中的作用IL-1等关节内炎症因子还能诱发软骨细胞中的一系列酶促反应,进一步加速软骨细胞的退变,其中MAPKs 信号通路是参与骨关节炎中软骨破坏最重要的通路之一[13]。MAPK-MEK 通路是MAPKs 家族中的经典通路,主要由Raf、MEK、ERK三级酶联功能单位构成,当其依次被磷酸化激活后,可诱发下游更为广泛的蛋白表达,在调节细胞生理应答过程中发挥重要作用。在膝关节中,上游的Ras活化可进一步激活Raf 蛋白,Raf 磷酸化后激活MEK1/MEK2,进而活化ERK1和ERK2,最后下游的转录因子进入软骨细胞核内参与细胞的增殖、分化、钙化等一系列生理病理过程,大大改变软骨细胞的内环境[14]。当IL-1、TNF-α等炎症因子与软骨细胞膜上的受体结合或机械应力刺激后,软骨细胞内的MAPKs 信号通路被激活,引起MMPs大量表达,导致软骨被快速破坏,此外,该信号通路还广泛参与软骨细胞的凋亡、肥大、钙化等病理过程[15]。针对MAPK-MEK 信号通路的一些治疗,在临床和实验中也被证实是有效的。Prasadam等[16]给KOA 大鼠关节腔注射透明质酸及UO126(MAPK-MEK 通路抑制剂),结果发现UO126 可明显抑制软骨细胞肥大相关蛋白(COL10 和RUNX2)及退变相关蛋白(ADAMTs5和MMP13)的表达,延缓软骨细胞的退化,治疗效果优于未治疗组及单用透明质酸组。国内一些学者研究发现,电针、手法松解等中医传统医学也可通过调节该通路,达到改善关节疼痛症状,延缓关节退化,以及减轻关节炎症的目的[17-18]。
3.4膝痹通络方治疗KOA的机制探讨膝痹通络方为我院经验方,临床疗效肯定。本研究从细胞分子生物学角度,对其治疗机制进行了探索。本研究在软骨细胞培养液中加入IL-1β,模拟软骨细胞退变,显微镜下直观可见细胞形态明显发生改变,与正常组相比呈扁平、狭长的退化形态。进一步以qPCR 和Western Blot 法检测相关基因及蛋白表达情况,发现MMPs、ADAMTs 等促软骨细胞退变的蛋白酶水平明显上升,而抑软骨细胞退变的转录因子SOX9 及A-CAN 表达水平明显下降,与既往研究[7]结果相符。而加入不同浓度膝痹通络方含药血清组的软骨细胞虽也呈现退化状态,但整体状态优于IL-1β组。表明膝痹通络方可一定程度抑制IL-1β 所致的软骨细胞MMPs、ADAMTs 的过表达,亦可缓解IL-1β对SOX9、A-CAN 的抑制作用。
基于MAPK-MEK信号通路在KOA发病过程中的重要作用,本研究进一步观察膝痹通络方含药血清对该信号通路的影响。MAPK-MEK 信号通路的活性主要取决于通路中相关磷酸化蛋白的水平,而非总蛋白含量。本研究中,软骨细胞经IL-1β诱导后Raf1、MEK 磷酸化水平显著增高,证实了IL-1β 可上调MAPK-MEK 信号通路的活性,而各浓度中药组软骨细胞Raf1 和MEK 磷酸化水平较IL-1β组明显下降,提示膝痹通络方含药血清可抑制IL-1β 所诱导的MAPK-MEK 信号通路的过度活跃。
综上所述,膝痹通络方含药血清可抑制IL-1β诱导的软骨细胞的退变,保护软骨细胞,其具体机制可能是抑制了IL-1β 所致的MAPK-MEK 信号通路的过度活跃。但本实验仅为体外实验,软骨细胞在体内和体外的生物学活性可能存在一定差异,因此需进一步通过动物体内实验验证本方的有效性和安全性,这也是本课题组下一步的研究计划。

