CD4+CXCR3+T细胞、IP-10及IFN-γ在原发免疫性血小板减少症中的表达及临床意义
赵雪芸,段晓静,贾瑞萍*
(1.包头市中心医院血液科,内蒙古 包头 014040;2.赤峰学院第二附属医院肿瘤科,内蒙古 赤峰 024000)
原发免疫性血小板减少症(P r i m a r y i m m u n e thrombocytopenia,ITP),是一种临床常见的获得性自身免疫性出血性疾病[1]。根据病程及严重程度可将ITP分为新诊断的ITP、持续性ITP、慢性ITP、重症ITP、难治性ITP[2]。成年ITP易发展为慢性、重症及难治性ITP,且存在易复发、经济负担重等疾病特点,严重降低了患者的生活质量。然而迄今为止,ITP的发病机制尚不完全明了。
趋化因子是多成员构成的细胞因子超家族,与其受体结合后,控制免疫细胞定向迁移,使后者到达炎性反应部位,行使清除抗原、促进创伤愈合、维持组织细胞平衡、消灭异常增殖细胞等功能[3]。趋化因子及其受体的异常表达和分布将导致免疫细胞的错误定位和功能障碍,这将严重影响机体的正常免疫平衡。辅助性T细胞(Helper T cell,Th)是机体内发挥重要功能的免疫细胞,根据分泌的细胞因子和功能可分化成不同亚群,如Th1、Th2、Th17等。每个亚群的分化过程中也伴随一些标志性趋化因子受体的表达变化,比如趋化因子受体3(Chemokine receptor 3,CXCR3)标志性表达于Th1细胞。干扰素诱导蛋白10(Interferon-inducible protein 10,IP-10)是CXCR3的配体,它可以由体内多种类型细胞分泌(如单核细胞、内皮细胞、成纤维细胞)。IP-10能够根据其浓度梯度吸引表面表达CXCR3的Th1细胞,二者结合后发挥作用并使后者发生迁移定位至炎症部位,参与炎性免疫反应。目前已有很多研究检测ITP中的Th1、Th2细胞比例,确认ITP是一种Th1优势性免疫疾病[4]。推测IP-10/CXCR3趋化轴可能在增强Th1细胞的募集和活化中发挥作用,进而参与ITP的免疫病理过程。我们分别检测新诊断的ITP糖皮质激素治疗前及治疗1周后外周血CXCR3表达与IP-10、IFN-γ水平,进一步探讨IP-10/CXCR3趋化轴在ITP发病中的作用。
1 材料与方法
1.1 病例资料
选取2018年03月~2019年01月就诊于包头市两所三级甲等医院(包头市中心医院、包头医学院第一附属医院)新诊断的成年ITP患者30例作为病例组,其中男性14例,女性16例,年龄22~82岁,平均52岁,血小板计数(2~38)×109/L;选择健康志愿者20例为对照组,其中男性8例,女性12例,年龄23~80岁,平均45.8岁,两组性别与年龄比较差异无统计学意义。诊断标准及疗效评价均依据侯明等编著的《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》。排除标准:排除其他继发性血小板减少症。
1.2 治疗方法及疗效分组
所有ITP患者均静脉滴注甲泼尼龙琥珀酸钠0.8 mg/kg.d治疗,PLT≥100×109/L后改为甲泼尼龙片口服。如治疗前血小板水平低于10×109/L,且伴有出血或有出血风险时,给予输注单采血小板及丙种球蛋白。入组ITP患者接受糖皮质激素治疗1周后的疗效分组:完全反应组:19例,治疗后PLT≥100×109/L且无出血;有效组:11例,治疗后PLT≥30×109/L或大于初诊时血小板计数的2倍且无出血。
1.3 主要试剂与仪器
鼠抗人C D 4 异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)抗体、鼠抗人CXCR 3 藻红蛋白(Phycoerythrin,PE)抗体购自美国Biolegend公司;磷酸盐缓冲液(Phosphate buffered saline,PBS)、红细胞裂解液(1X)、人IP-10 ELISA试剂盒(96T)、人IFN-γ ELISA试剂盒(96T)均购自杭州联科生物技术有限公司。FACS Canto TM Ⅱ型流式细胞仪购自美国Becton Dckinsoni公司;Multiskan MK3酶标仪购自美国Thermo公司。
1.4 标本采集及处理
抽取病例组(新诊断时和治疗1周后)与对照组晨起空腹外周静脉血3ml,放入EDTA抗凝管,充分混匀,吸取200 ul在4小时内完成CD4+CXCR3+T细胞流式细胞术检测;剩余全血3000转/分钟离心15 min,将上清液移入2ml的Eppendorf管中,置于超低温冰箱冰冻(-80℃)保存,用于IP-10及IFN-γ的定量检测。
1.5 流式细胞术检测样本CD4+CXCR3+T细胞表达率
在流式细胞管中加入混合均匀的50ul EDTA抗凝全血、5ul FITC-CD4抗体、5ul PE-CXCR3抗体,设空白对照管,在室温下避光孵育30分钟;向每个流式管加入300ul 1x红细胞裂解液以裂解红细胞,轻轻混合,在室温下避光15分钟;加入PBS缓冲液lml,轻轻混合,1800转/分钟离心7分钟,弃上清液;加入200ul PBS重悬细胞,上机检测。以前向角(Forward scatter,FSC)和侧向角(Side scatter,SSC)为双参数,圈定CD4+T淋巴细胞门,在CD4+T淋巴细胞门内以FITC及PE为双参数,圈定CD4+CXCR3+T细胞群,所得数据即为CD4+CXCR3+T细胞在CD4+T细胞中所占比例(%),记录各标本CD4+CXCR3+T细胞表达率。
1.6 酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)双抗体夹心法检测IP-10、IFN-γ
操作步骤严格按照联科生物技术有限公司人IFN-γ ELISA试剂盒(96T)及人IFN-γ ELISA试剂盒(96T)说明书进行。
1.7 统计学方法
本研究中所有数据统计使用SPSS23.0统计软件完成。计数资料用频数(百分比)表示,病例组与对照组比较采用x2检验;正态分布计量资料用均数±标准差(±s)表示,病例组与对照组均数比较采用两样本t检验,治疗前、后组均数比较采用配对样本t检验;对部分指标作两样本直线相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料分析
ITP组与健康对照组相比性别、年龄差异无统计学意义(P>0.05);血小板计数(Platelet,PLT)比较差异有统计学意义(P<0.05),见表1。
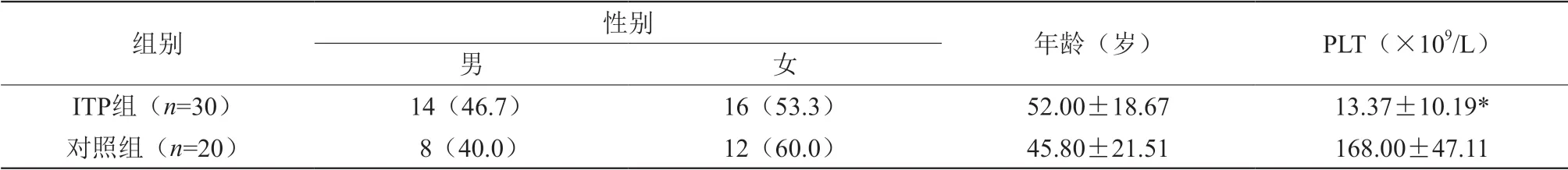
表1 ITP组与健康对照组临床资料分析
2.2 CD4+CXCR3+T细胞表达率及IP-10、IFN-γ表达水平
ITP组CD4+CXCR3+T细胞表达率、IP-10、IFN-γ表达水平均明显高于对照组,差异有统计学意义(P<0.05)。完全反应组治疗前CD4+CXCR3+T细胞表达率、IP-10、IFN-γ表达水平均明显高于治疗后及健康对照组(P<0.05),且治疗后与对照组比较差异无统计学意义(P>0.05)。有效组治疗前CD4+CXCR3+T细胞表达率、IP-10、IFN-γ表达水平均明显高于治疗后及健康对照组(P<0.05),治疗后IP-10、IFN-γ水平与健康对照组比较差异无统计学意义(P>0.05),见表2。

表2 病例组及对照组中 CD4+CXCR3+T、IP-10、IFN-γ的表达
2.3 ITP组CD4+CXCR3+T细胞表达率与IP-10、IFN-γ水平、PLT相关性分析
ITP组中CD4+CXCR3+T细胞表达率与IP-10、IFN-γ表达水平均呈正相关(r1=0.293,P1=0.002,r2=0.248,P2=0.005);IP-10与IFN-γ水平呈正相关(r=0.188,P=0.017)。CD4+CXCR3+T细胞表达率、IP-10、IFN-γ三者与PLT均没有明显相关性(P>0.05)。见图1。

图1 ITP组CD4+CXCR3+T细胞表达率、IP-10、IFN-γ表达水平相关性分析
3 讨 论
趋化轴由趋化因子、趋化因子受体及相关细胞因子构成,多途径参与T细胞分化、分子粘附、白细胞迁移、细胞因子分泌和细胞凋亡调节等过程。CXCR3作为活化的T淋巴细胞特别是Th1和CD8+T细胞表面的标志物,是体内Th1细胞分化所必需的。CXCR3在Th1细胞向炎症外周组织的运输中起重要作用,被报道为Th1细胞极化的多种自身免疫性疾病(如多发性硬化症、系统性红斑狼疮等)中的关键因子[5-6]。CXCR3存在三种特异性配体Mig、IP-10、I-TAC,均属于IFN-γ诱导型趋化因子[7]。Groom等[8]通过小鼠模型证明IP-10是CXCR3三种配体中对Th1细胞的发育以及迁移过程最重要的趋化因子。有研究证明,新诊断的ITP患者中IP-10水平升高,当接受糖皮质激素治疗或者脾切除病情缓解后,该值降至正常水平。Zhou等研究证明ITP患者脾脏中CXCR3的表达显著增加,认为在患者脾脏中也存在Th1极化现象,CXCR3及其配体异常表达可能参与了ITP患者的脾脏免疫紊乱。IFN-γ是一种主要由Th1细胞分泌的糖蛋白。它可以参与并正向调节Th1细胞介导的免疫应答过程,同时抑制Th2细胞的发育[11]。体外实验已证明使用IFN-γ诱导后多种类型细胞(如单核/巨噬细胞、内皮细胞、淋巴细胞、肝脏细胞等)可以表达IP-10,说明干扰素-γ是IP-10的生理诱导剂。
在本研究中,我们发现新诊断的ITP患者外周血中CX4+CXCR3+T细胞表达率、IP-10及 IFN-γ的表达水平均较健康对照组显著增高,接受糖皮质激素治疗1周后CX4+CXCR3+T细胞表达率、IP-10及 IFN-γ的表达水平较治疗前下降,且与健康对照无明显差异。因此在ITP患者外周血中,IP-10/CXCR3趋化轴相关因子均存在高表达,且IP-10、CXCR3、IFN-γ三者间呈正相关。以上结果印证了ITP中存在着Th1活化模式,IP-10/CXCR3趋化轴可能通过趋化机制在ITP免疫机制中发挥重要作用。此外,糖皮质激素可以纠正IP-10/CXCR3趋化轴异常表达,提示糖皮质激素可能是通过此种作用对ITP发挥治疗作用。
目前,在一系列实验及自身免疫性疾病中研究了IP-10/CXCR3趋化轴的靶向治疗。在类风湿关节炎、心脏移植的小鼠疾病模型检测到CXCR3表达升高,并且使用相应抗体可以减轻疾病表现。鉴于ITP患者外周血中IP-10/CXCR3趋化轴的表达变化及其在ITP发病机制中的作用,针对趋化轴的药物干预及中和抗体或相应的受体拮抗剂的使用也许能成为治疗Th1优势型自身免疫性疾病的新方向。

