甜叶菊废渣提取物的主要成分分析及其抗氧化作用
赵 磊,潘 飞,林文轩,徐美利,鲍 玺,陈艳麟,王成涛,*,连运河,*
(1.北京工商大学,北京市食品添加剂工程技术研究中心,食品营养与人类健康北京高精尖创新中心,北京 100048;
2.晨光生物科技集团股份有限公司,河北 邯郸 057250)
甜叶菊,属多年草本菊科类植物,20世纪70年代从日本引进回国,并大规模进行种植,已在我国大部分地区形成特色的经济作物[1]。甜叶菊干叶含有丰富的甜菊糖苷,具有高甜度、低热量等特点,其甜度约为蔗糖的300 倍,但热量仅为蔗糖的1/300,是一种天然的新型甜味替代剂[2]。当前,我国甜菊糖出口位于世界第一,是世界上最大的甜菊糖生产供应国[3],然而,在食品工业生产甜菊糖的过程中产生大量的甜叶菊废渣,这些废渣并没有得到合理的利用,对环境也造成了一定的污染。甜叶菊废渣含有大量的粗蛋白、粗膳食纤维、黄酮类化合物、酚酸类化合物及微量元素等[4-5],因此,甜叶菊废渣具有很大的利用价值。有研究证实,甜叶菊废渣能够改善猪肌内营养成分[6]。不仅如此,甜叶菊废渣中的黄酮类及酚酸类物质还具有抗氧化、降血脂、抑菌、抗衰老等功能[7-9],因此,甜叶菊废渣的功能活性及有效成分还有待深度研究,将为废渣在综合利用方面提供理论依据。
近年来研究表明甜叶菊提取物具有良好的抗氧化作用,通过体外实验证实甜叶菊醇和水提取物具有自由基清除能力和铁离子还原能力(ferric reducing/antioxidant power,FRAP)[10-11]。此外,甜叶菊废渣提取物具有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiozoline-6)-sulphonic acid,
ABTS)阳离子自由基清除能力,且抗氧化能力优于茶多酚[12],通过建立D-半乳糖诱导衰老小鼠模型实验发现,甜叶菊废渣提取物能够显著提高衰老小鼠血清、肝脏和脑内超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和总抗氧化能力的活性[13]。同时,以溶剂萃取法制备的甜叶菊废渣提取物生物制剂相比常规的抗氧化剂(丁基羟基茴香醚、二丁基羟基甲苯、特丁基对苯二酚等)及天然抗氧化剂(VC、VE等)表现出较强的优势[14],上述研究扩大了甜叶菊废渣在天然抗氧化剂开发与利用方面的前景。采用液相色谱-质谱联用技术[15]对甜叶菊废渣提取物进行成分鉴定,发现其8 种主要成分分别为绿原酸、隐绿原酸、咖啡酸、异绿原酸B、异绿原酸A、异绿原酸C、槲皮苷、槲皮素[13,16-17],这些成分的存在可能为甜叶菊废渣提取物的抗氧化作用做出贡献。然而,近年来的研究主要集中在甜叶菊废渣中多酚黄酮类化合物的提取纯化工艺研究及含量测定等方面[4,18-19],对甜叶菊废渣提取物中主要成分的抗氧化研究还不充分,尤其在对其主要成分抗氧化能力的强弱分析及各成分对废渣提取物总抗氧化能力的贡献度等方面,这些研究不仅能够为甜叶菊废渣提取物的成分和其抗氧化能力之间的关系提供参考价值,还有助于甜叶菊废渣的开发利用。
本实验以甜叶菊废渣提取物为研究对象,采用高效液相色谱-串联质谱(high performance liquid chromatographytandem mass spectrometry,HPLC-MS/MS)及HPLC法对提取物主要成分进行定性和定量分析,并使用标准品按照甜叶菊废渣提取物中各主要成分的原始含量制备模拟提取物,基于DPPH法、FRAP法及trolox等效抗氧化能力(trolox equivalent antioxidant capacity,TEAC)法3 种抗氧化方法对8 种主要成分进行抗氧化评价,并阐明这8 种主要成分对甜叶菊废渣提取物的抗氧化贡献度,进一步完善甜叶菊废渣提取物体外抗氧化性的研究。
1 材料与方法
1.1 材料与试剂
甜叶菊废渣提取物 河北晨光生物科技集团股份有限公司;DPPH、2,4,6-三吡啶基三嗪(tripyridyltriazine,TPTZ)、ABTS 美国Sigma公司;绿原酸、隐绿原酸、咖啡酸、异绿原酸B、异绿原酸A、异绿原酸C、槲皮苷、槲皮素 成都曼斯特生物科技有限公司;甲醇(HPLC级) 美国Mallinckrodt Baker制药公司;其他化学品均属国产分析纯。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;6530 HPLC-MS/MS仪、1290 HPLC系统 美国安捷伦科技公司。
1.3 方法
1.3.1 甜叶菊废渣提取物的制备
甜菊糖絮凝废渣→酸性丙酮水溶液萃取→浓缩→乙酸乙酯萃取→乙酸乙酯溶液浓缩→大孔吸附树脂纯化→干燥→甜叶菊废渣提取物
1.3.2 甜叶菊废渣提取物中主要成分的鉴定及定量分析
采用HPLC-MS/MS对甜叶菊废渣提取物中主要成分进行鉴定,并采用HPLC法对其进行定量分析,结果以每克甜叶菊废渣提取物中各主要成分物质的毫克数表示[13]。
HPLC条件:流动相A为体积分数0.1%甲酸-甲醇溶液;流动相B为体积分数0.1%甲酸溶液;流速0.1 mL/min;洗脱程序,0~10 min,10%~50% A,9 0%~5 0% B;1 0 ~1 2 m i n,5 0%~1 0% A,50%~90% B;12~15 min,10% A,90% B;检测波长:320 nm和360 nm;柱温30 ℃;进样量1 μL;样品质量浓度1 mg/mL。
质谱条件:m/z 100~1 500;干燥气体N2;温度300 ℃;流速3 L/min;喷雾器压力35 psig;毛细管电压3.5 kV;毛细管出口电压135 V;锥孔电压65 V。按照上述质谱条件,获得甜叶菊废渣提取物中主要色谱峰的一级质谱的分子离子及二级质谱的碎片离子。将二者的分子质量与文献报道的结果进行比较,推测出色谱峰的可能组成,并采用标准品进行验证。
采用标准品(咖啡酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮素和槲皮苷),按上述HPLC条件分别进行测定,以标准品的质量浓度(6.25~200 μg/mL)为横坐标,峰面积为纵坐标,绘制标准曲线,并测定甜叶菊废渣提取物(1 mg/mL)中各主要成分的含量,结果以mg/g提取物计。
1.3.3 抗氧化活性测定方法
1.3.3.1 DPPH法
在试管中加入0.1 m L 样品甲醇溶液,3.9 m L 0.025 mg/mL DPPH-甲醇溶液。将样品剧烈振荡并于暗处室温静置1 h,稳定后用分光光度计测定在517 nm波长处吸光度[20],采用甲醇代替样品测量结果作为空白对照,样品质量浓度梯度为6.25、12.5、25、50、100、200、400 μg/mL,根据DPPH自由基清除率公式进行计算,并将不同质量浓度的样品与DPPH自由基清除率的关系,制作回归方程。结果用EC50值表示,即DPPH自由基清除率达到50%所需样品的质量浓度(μg/mL)。

1.3.3.2 TEAC法
将7 mmol/L ABTS的K2S2O8溶液(2.45 mmol/L)在室温避光保存16 h,制得ABTS阳离子自由基储备液。经PBS(pH 7.4)稀释,使其在734 nm波长处的吸光度达到(0.70±0.02),得到ABTS阳离子自由基工作液。设置样品质量浓度梯度为6.25、12.5、25、50、100、200、400 μg/mL,并在试管中加入80 μL样品溶液或者蒸馏水,并与3.92 mL的ABTS阳离子自由基工作液混合,暗处反应6 min,测定734 nm波长处吸光度[20],根据ABTS阳离子自由基消除率公式进行计算,并将不同浓度的样品与ABTS阳离子自由基消除率的关系,制作回归方程。结果用EC50值表示,即ABTS阳离子自由基清除率达到50%所需要的样品质量浓度(μg/mL)。
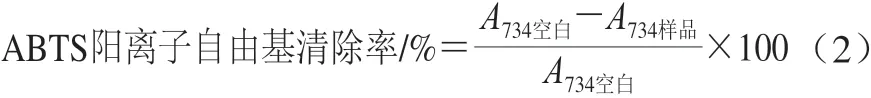
1.3.3.3 FRAP法
将25 mL 0.3 mol/L醋酸缓冲液(pH 3.6),2.5mL 10 mmol/L TPTZ溶液(溶解在40mmol/L HCl中)及2.5 mL 20 mmol/L FeCl3·6H2O混合配制FRAP试剂。在试管中加入3 mL新配制的FRAP试剂,37 ℃预热,设置样品质量浓度梯度为6.25、12.5、25、50、100、200、400 μg/mL,向新配制的FRAP试剂加入0.1 mL上述质量浓度样品溶液及0.3 mL蒸馏水。将样品摇匀,置37 ℃的水浴中30 min,然后测量595 nm波长处反应后的混合物的吸光度[20]。将不同浓度的FeSO4溶液代替样品,其余操作同上,建立质量浓度与吸光度的线性回归方程(y=0.659 6x-0.01,R2=0.999 6)。根据标准曲线计算样品的EC1值(EC1=C样品/CFe2+,即与1 mmol/L FeSO4溶液具有相同抗氧化活性的样品质量浓度(μg/mL))。
1.3.4 模拟提取物制备及抗氧化能力的测定
如1.3.2节所述测定出甜叶菊废渣提取物中主要成分,并根据这些主要成分在甜叶菊废渣提取物的实际含量使用标准品配制得到模拟提取物,并设置不同质量浓度(6.25、12.5、25、50、100、200、400 μg/mL),采用上述3 种抗氧化方法评价其抗氧化活性。
1.3.5 抗氧化性贡献率的计算方法
参照李洋等[21]报道的方法并作出少量修改研究甜叶菊废渣提取物中各主要成分对甜叶菊废渣提取物总抗氧化能力(total antioxidant capacity,TAC)的贡献率,计算公式为:

式中:EEC1(EC1当量)表示每克甜叶菊废渣提取物中每种主要成分的含量/每种主要成分的EC1;EEC50(EC50当量)表示每克甜叶菊废渣提取物中每种主要成分的含量/每种主要成分的EC50;TAC表示每克甜叶菊废渣提取物/甜叶菊废渣提取物的EC1或者EC50。
1.4 数据统计与分析
每个实验至少重复3 次,结果均使用±s表示。数据统计用SPSS 13.0统计软件进行处理。使用抗氧化活性综合(antioxidant potency composite,APC)指数法[22]进行主要成分标准物质单体抗氧化活性比较,按照下式计算APC指数及APC综合指数:

2 结果与分析
2.1 甜叶菊废渣提取物的主要成分鉴定及定量分析
对甜叶菊废渣提取物中的主要成分进行高效液相色谱-二极管阵列检测-电喷雾串联质谱(high performance liquid chromatography-diode array detection-electrospray ionisation tandem mass spectrometry,HPLC-DAD-ESI/MS)分析,在320 nm和360 nm波长处分别对羟基肉桂衍生物和黄酮类化合物进行HPLC-DAD检测,并与在360 nm波长处的标准品混合液的色谱图进行对比,甜叶菊废渣提取物分离得到8 种主要成分(图1),其对应的MS2质谱图如图2所示。通过与相应标准品的保留时间和裂解方式的比较[23],化合物1和化合物2(m/z 353)鉴定为绿原酸和隐绿原酸,它们的去质子化分子离子[M-H]-在m/z 191、179、173和135处产生4 个主要MS2质谱特征碎片断,分别代表[奎宁酸-H]-、[咖啡酰氧基-H]-、[奎宁酸-H-H2O]-、[咖啡酰氧基-H-COO]-。通过对保留时间、MS和MS2质谱图与相应标准品的比较[24],确定了m/z 179的化合物为咖啡酸(图2C)。由图1和图2D~F显示,根据洗脱顺序、裂解规律和相对丰度的差异[25],化合物4、5、6(m/z 515)被鉴定为异绿原酸B、异绿原酸A和异绿原酸C。化合物7(m/z 447)经鉴定为槲皮素-3-鼠李糖苷,其MS2质谱在m/z 301处有特征片段存在,表明鼠李糖片段(m/z 146)从槲皮苷中断裂(图2G)。化合物8的分子离子峰为m/z 301,推测其为槲皮素苷元,MS2质谱图中的m/z 179(X-)离子则是由于A环和B环断裂形成的[26]。根据上述HPLC-DAD-ESI/MS结果,从甜叶菊废渣提取物中鉴定出8 种主要化合物A~H,分别为绿原酸、隐绿原酸、咖啡酸、异绿原酸B、异绿原酸A、异绿原酸C、槲皮苷、槲皮素,其结构如图3所示。
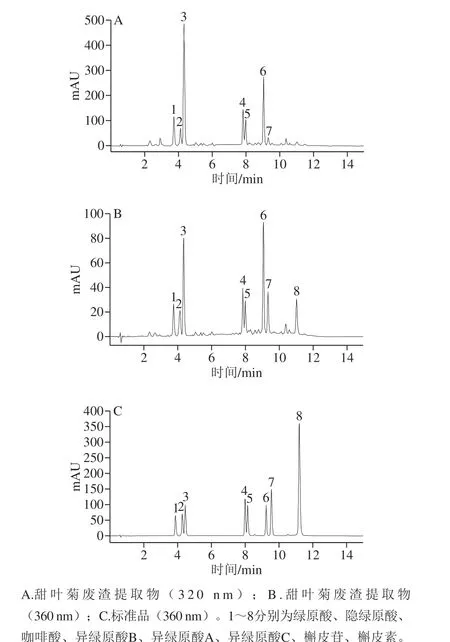
图1 甜叶菊废渣提取物和标准品的HPLC-DAD谱图Fig. 1 HPLC-DAD chromatograms of stevia residue extract and standard mixture
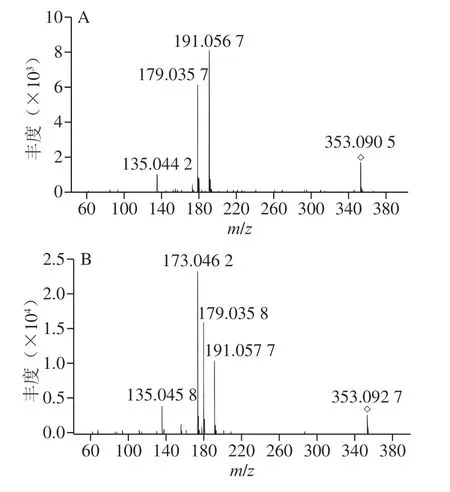

图2 甜叶菊废渣提取物各主要成分色谱峰的串联质谱图Fig. 2 Tandem mass spectra of the main components of stevia residue extract

图3 甜叶菊废渣提取物中8 种主要成分的化学结构Fig. 3 Chemical structures of the eight main compounds present in stevia residue extract
采用高效液相色谱法,以8 种标准品的质量浓度(6.25~200 μg/mL)为横坐标,峰面积为纵坐标,绘制HPLC标准曲线(咖啡酸:y=26.994x+8 5.2 0 4,R2=0.9 9 8 4;绿原酸:y=1 3.1 5 7 x+3 0.7 0 6,R2=0.9 9 9 7;隐绿原酸:y=1 1.5 1 8 x+72.826,R2=0.997 5;异绿原酸A:y=12.798x+6 1.2 3,R2=0.9 9 7 9;异绿原酸B:y=1 5.5 9 1 x+8.255 7,R2=0.999 8;异绿原酸C:y=10.199x+24.81,R2=0.999 9;槲皮素:y=17.715x+72.648,R2=0.996 7;槲皮苷:y=7.66x+38.421,R2=0.996 5),对甜叶菊废渣提取物中的8 种主要化合物进行定量分析,结果见表1。
由表1可知,甜叶菊废渣提取中富含酚酸类化合物,其中以异绿原酸C、咖啡酸和绿原酸的含量为最高,约占甜叶菊废渣提取物的12.67%、9.72%和4.65%,而槲皮苷和槲皮素含量相对较低,仅占1.88%和0.71%,这8 种主要成分含量约占甜叶菊废渣提取物的39.83%。然而,有些酚类化合物的含量非常低,很难被检测[18],因此仍可能存在一些还未识别的酚酸类化合物。此外,在甜叶菊废渣提取物中还可能含有其他成分。因此,为了更好地了解甜叶菊废渣提取物的构成,还需要对其他成分进一步深入研究。
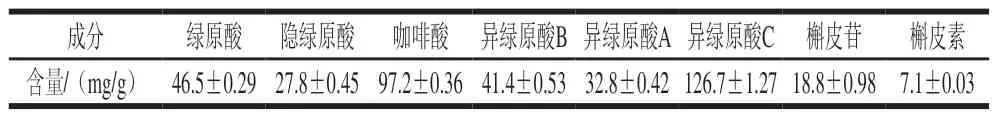
表1 甜叶菊废渣提取物主要成分的含量Table 1 Contents of the eight main compounds present in stevia residue extract
2.2 甜叶菊废渣提取物主要成分抗氧化能力比较
EC50值越低则该物质清除自由基的能力最强。如表2和图4所示,在DPPH自由基捕获法中,8 种主要成分清除DPPH自由基的能力由大到小依次排序为:咖啡酸>异绿原酸B>槲皮素>绿原酸>异绿原酸A >隐绿原酸>异绿原酸C >槲皮苷,其中咖啡酸对DPPH自由基清除作用最强,其EC50值为(54.25±3.32)μg/mL,其DPPH自由基清除能力是槲皮苷(EC50=(334.51±11.94)μg/mL)的6.5 倍。

表2 甜叶菊废渣提取物主要成分的抗氧化能力Table 2 Antioxidant activities of the main components of stevia residue extract
在ABTS阳离子自由基清除实验中,8 种主要成分清除ABTS阳离子自由基的能力由大到小依次排序为:绿原酸>槲皮素>异绿原酸B>咖啡酸>槲皮苷>异绿原酸A>异绿原酸C>隐绿原酸。其中绿原酸对ABTS阳离子自由基清除率作用最强,其EC50值为(40.02±1.97)μg/mL,其ABTS阳离子自由基的清除能力是隐绿原酸(EC50=(90.02±10.72)μg/mL)的2.25 倍。
在FRAP测定方法中,EC1常用来衡量与1 mmol/L FeSO4溶液具有相同抗氧化活性的样品浓度,EC1值越低,则Fe3+还原能力越强。8 种主要成分Fe3+还原能力由大到小的顺序依次是:咖啡酸>异绿原酸B>槲皮素>绿原酸>异绿原酸A>隐绿原酸>异绿原酸C>槲皮苷,其中咖啡酸的Fe3+还原能力最强,其EC1值为(27.90±0.63)μg/mL,是槲皮苷(EC1=(120.60±0.81)μg/mL)的4.3 倍。
由上述结果可知,甜叶菊废渣提取物中8 种主要成分在3 种抗氧化方法中的测定结果并不一致,主要因为各酚类的结构性质[27]及各种方法反应原理[20]不同,所以无法全面评价各单一成分的抗氧化活性。因此,采用APC指数法[22]对3 种方法测得结果进行综合评价,结果见图4和表3。
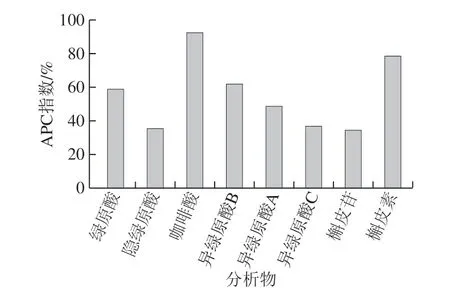
图4 甜叶菊废渣提取物中8 种主要成分抗氧化活性APC指数Fig. 4 APC index of the eight main components in stevia residue extract
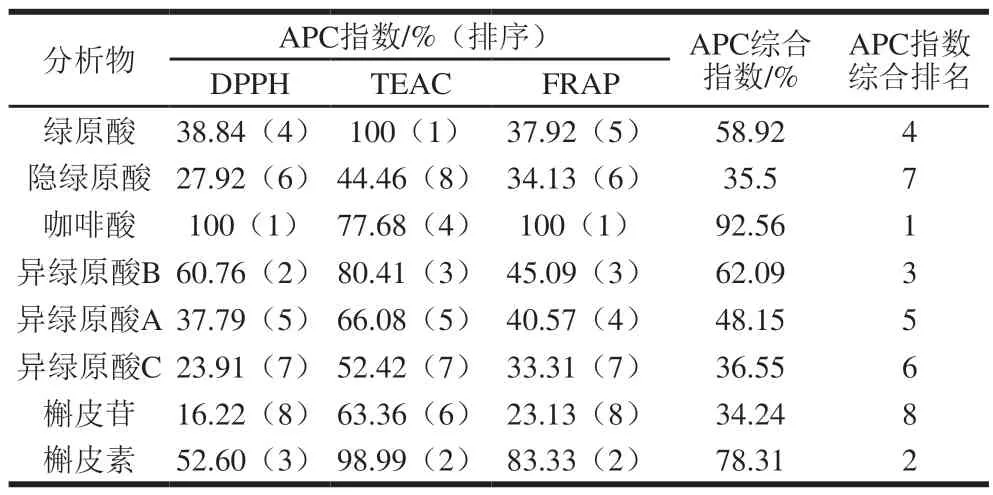
表3 甜叶菊废渣提取物8 种主要成分物质抗氧化活性及排序Table 3 APC index for individual and total antioxidant activities of the eight main components of stevia residue extract and their ranking
甜叶菊废渣提取物中8 种主要成分的APC指数由大到小的顺序是:咖啡酸(92.56%)>槲皮素(78.31%)>异绿原酸B(62.09%)>绿原酸(58.92%)>异绿原酸A(48.15%)>异绿原酸C(36.55%)>隐绿原酸(35.5%)>槲皮苷(34.24%)。其中咖啡酸APC指数最高(92.56%),抗氧化能力最强,相当于APC指数最低的槲皮苷(34.24%)的2.7 倍。张华等[27]对15 种柑橘果皮中主要酚类进行抗氧化比较,结果显示抗氧化由强到弱的顺序为:没食子酸>咖啡酸>绿原酸>阿魏酸>圣草酚>圣草次苷>芦丁>橙皮素>柚皮素>地奥司明>橙皮苷>川陈皮素>甜橙黄酮>柚皮苷>橘皮素。与本实验中采用APC指数法比较发现的咖啡酸抗氧化活性高于与绿原酸抗氧化活性的结果一致。现有研究表明,不同酚类化合物的抗氧化活性差异不仅与酚羟基的糖基化、甲氧化有关,还与酚羟基的数目、取代基位置、有无C2、C3位双键等相关[27]。在酚类结构方面咖啡酸的羧基与奎尼酸发生酯化反应形成绿原酸,槲皮素经糖基化后形成槲皮苷,这些反应引起结构的变化,进而导致抗氧化能力下降[28-29]。此外,酚羟基在连接位置、数量等结构上的差异也会导致在不同体系中的抗氧化能力有所不同,李佳银等[30]采用5 种抗氧化方法对甘薯茎叶中咖啡酰基奎宁酸类衍生物进行抗氧化比较,结果显示异绿原酸B和异绿原酸A抗氧化活性高于异绿原酸C,这与本实验的结果基本一致。
酚类抗氧过能力对质量浓度具有依赖性[30],鉴于8 种主要成分在甜叶菊废渣提取物中含量不同,因此,以200 μg/mL质量浓度的甜叶菊废渣提取物为例,采用3 种抗氧化方法(DPPH、TEAC、FRAP法)计算提取物中8 种主要成分对提取物抗氧化性贡献率如图5所示,咖啡酸对甜叶菊废渣提取物总抗氧化性能力贡献率最大,这一结果与上述论证基本一致。
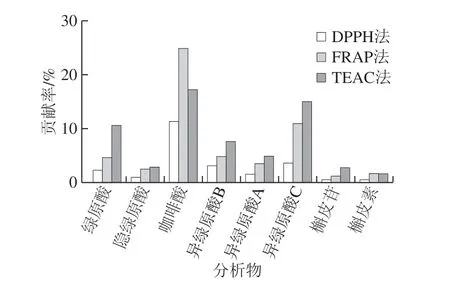
图5 主要成分对甜叶菊废渣提取物总抗氧化性贡献率Fig. 5 Contribution percentages of the main components to the total antioxidant activity of stevia residue extract
2.3 8 种主要成分对甜叶菊废渣提取物抗氧化活性的贡献
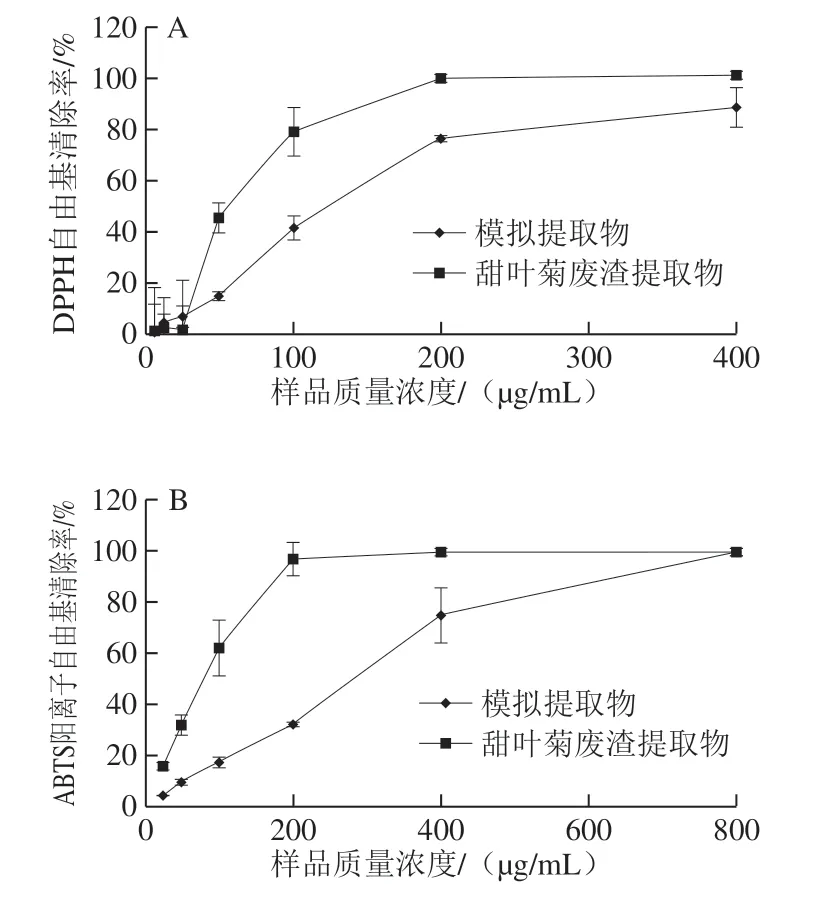

图6 甜叶菊废渣提取物与模拟样品体外抗氧法活性Fig. 6 Antioxidant activities of stevia residue extract and its simulant in vitro
按照甜叶菊废渣提取物中8 种主要成分实际含量制备获得模拟提取物,采用3 种抗氧化方法对模拟提取物的抗氧化能力进行评价,并与甜叶菊废渣提取物(实际提取物)比较分析。如图6所示,在所选质量浓度范围内(50~400 μg/mL),甜叶菊废渣提取物的自由基(DPPH、ABTS)清除能力和FRAP均大于模拟提取物。在质量浓度为200 μg/mL时,模拟提取物的DPPH自由基和ABTS阳离子自由基清除能力法分别为甜叶菊废渣提取物的76.57%和33.36%,模拟提取物的Fe3+还原能力约为甜叶菊废渣提取物的44.13%。3 种方法对模拟提取物抗氧化能力的评价结果基本一致,抗氧化能力的强弱为:甜叶菊废渣提取物(实际提取物)>模拟提取物。对这种差异性的解释为:甜叶菊废渣提取物(实际提取物)中成分较为复杂,除8 种主要成分外,还可能含有较低浓度的未鉴定出的酚酸类(香豆酰奎宁酸、三咖啡酰奎宁酸等)和黄酮类化合物[16],这些物质具有抗氧化活性,常与酚酸类物质之间产生相互作用使酚羟基发生变化,而酚羟基的数目对自由基消除、铁离子还原表现出较高的显著性,因此表现出协同作用[29]。
3 结 论
通过HPLC-MS/MS和HPLC法对甜叶菊废渣提取物的主要成分进行分析,得出8 种主要成分:绿原酸、隐绿原酸、咖啡酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮苷和槲皮素,其中异绿原酸C(126.7±1.27)mg/g含量最高、其次为咖啡酸(97.2±0.36)mg/g、绿原酸(46.5±0.29)mg/g。采用APC指数法对8 种主要成分的抗氧化活性进行评价,得出抗氧化能力最强为咖啡酸,且其对甜叶菊废渣提取物抗氧化活性贡献最大。通过对模拟提取物和甜叶菊废渣提取物的抗氧化性进行比较发现,在质量浓度为50~400 μg/mL时,甜叶菊废渣提取物的抗氧化能力均强于模拟提取物。这表明除8 种主要成分外,甜叶菊废渣提取物中还存在其他抗氧化活性物质,还有待于进一步探究。

