2-(4-吡啶基)-1H-苯并咪唑的合成及其与牛血清白蛋白的作用
芦 婷,史 丹,张 荣,陈晓红,张 前,焦元红
(湖北理工学院 化学与化工学院,湖北 黄石435003)
0 引言
人血清白蛋白是血浆中最丰富的一种载体蛋白,牛血清白蛋白(Bovine Serum Albumin,BSA)结构构造几乎与人血清白蛋白一样。因其价廉易得,科学工作者常常用牛血清白蛋白替代人血清白蛋白研究与药物小分子的相互作用,为药物的筛选积累了一定的理论数据[1]。在生理条件下,牛血清白蛋白含有 583 个氨基酸,分子量为66 000 左右,因存在特殊氨基酸如色氨酸(Trp)、酪氨酸(Tyr)而具有荧光。
苯并咪唑衍生物具有多种生物学和药理活性[2]。本文通过实验合成一种小分子苯并咪唑衍生物药物MAB,研究其与牛血清白蛋白的相互作用,并通过多种手段从分子水平上讨论其与蛋白之间的作用位点、作用机理和作用力,分析药物在生物体的运送、分布及作用机制,旨在为临床合理用药提供重要参考依据。
1 实验与方法
1.1 仪器及试剂
实验用仪器包括:Vario ELⅢ型元素分析仪(德国Ele-mentar公司);721S722SP723S紫外可见光光谱仪(上海棱光技术有限公司);RF-5301PC型分光荧光计(日本Shimadzu 公司);400型400 MHz核磁共振仪(Varian Mercury 公司,TMS为内标);Trace EMS 2000质谱仪(Thermo Finnigan)。
将BSA(上海远聚生物科技有限公司)溶解在0.1 mol/L Tris-HCl(pH=7.4)缓冲溶液中,制得浓度为1.0×10-5mol/L的BSA。将MAB溶于二甲基亚砜(DMSO)中,用Tris-HCl缓冲溶液稀释至1.0×10-4mol/L,储存在2~5 ℃冰箱中。实验用水为双蒸水。
1.2 化合物的合成及表征
MAB合成反应式[3]见式(1)。取5.4 g邻苯二胺和6.5 g 4-甲酸吡啶放入烧瓶中,加入20 mL磷酸和多聚磷酸的混合物,于170 ℃下回流2~4 h后冷却至室温。用浓氨水调节其pH=7,有沉淀析出,过滤,用乙醇重结晶,得到目标化合物MAB(分子式为C12H9N3)白色粉末,收率为60%。m.p.223~225 ℃;MS:m/z 195.2,calcd 194.88;1H NMR (300 MHz,DMSO-d6,δppm) δ:7.240~7.612 (m,4H,Ar-H),8.250(d,2H,J=7.4 Hz, Py-H),8.813(d,2H,J=7.4 Hz,Py-H),12.561(s,1H,-NH)。
C,H,N含量用元素分析仪测定,实验值(%)为:C:74.07;H:4.60;N:21.33。理论计算值(%)为:C:73.85;H:4.61;N:21.54。
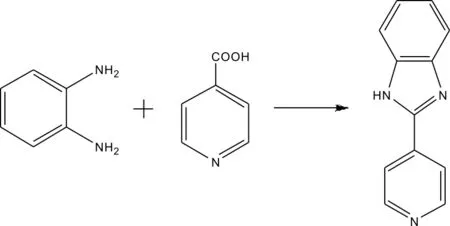
(1)
1.3 实验方法
1.3.1溶液配制
配制pH=7.4的Tris-HCl缓冲溶液和浓度为1×10-5mol/L的BSA溶液。称取0.033 1 g BSA,溶解在Tris-HCl缓冲溶液中,稀释定容至50 mL。配制浓度为1×10-2mol/L的MAB溶液。所有溶液均放置在4 ℃冰箱中24 h。
1.3.2荧光光谱
分别测定不同温度下MAB与BSA体系的荧光发射谱,选择激发波长为295 nm,测量波长范围为300~450 nm,测量温度分别为298 K,303 K,308 K。在比色皿中加入1×10-5mol/L的牛血清白蛋白(BSA),每次加入BSA的体积为1 μL。绘制研究体系的荧光光谱。
1.3.3同步荧光光谱
固定牛血清白蛋白(BSA)的浓度为1×10-5mol/L,逐渐增加MAB的浓度。分别设置Δλ=15 nm与Δλ=60 nm,测量波长范围分别为260~325 nm与240~320 nm,绘制牛血清白蛋白(BSA)同步荧光光谱,讨论MAB对酪氨酸(Tyr)和色氨酸(Trp)残基的影响。
1.3.4紫外可见吸收光谱
测定MAB加入前和加入后的牛血清白蛋白(BSA)的紫外可见吸收光谱,以及MAB的吸收光谱,通过紫外差谱得到相互作用机制。两者浓度均为1×10-5mol/L。
2 实验结果讨论
2.1 MAB与BSA的相互作用及机理
2.1.1荧光光谱分析
在λex=295 nm的条件下,将不同浓度的MAB滴定到固定浓度为1×10-5mol/L的BSA中,得到MAB对BSA的荧光猝灭如图1所示。由图1可以看出,BSA的荧光强度随着MAB浓度增加而有规律地下降,说明MAB在不改变节点环境的情况下能猝灭BSA的固有荧光强度。

图1 MAB对BSA的荧光猝灭
猝灭分静态和动态猝灭2种。静态猝灭是指形成荧光物质-猝灭剂复合物,使荧光团荧光猝灭; 动态猝灭是指在激发态期间猝灭剂与荧光物质发生碰撞使其返回基态而不发射光子。
根据Stern-Volmer方程讨论猝灭机理:

(2)
式(2)中,F0为不存在猝灭剂时的稳态荧光强度;F为存在猝灭剂时的稳态荧光强度;kq,KSV为荧光分子的猝灭速率常数;τ0为荧光分子平均寿命,不含猝灭剂的荧光分子的平均寿命[4]τ0= 10-8s;[Q]为猝灭剂的浓度。对于动态猝灭,各种猝灭剂与荧光分子最大碰撞猝灭常数为2.0×1010L/(mol·s),如果kq远大于此值,则可以得出荧光猝灭不是由动态猝灭导致的,可能是由于生成复合物而导致静态猝灭[5]。
为了进一步研究猝灭机理,我们进行了荧光变温滴定实验。因为温度变化对静态猝灭和动态猝灭的影响是不同的。随着温度升高,静态猝灭荧光猝灭常数是减小的,而动态猝灭则与之相反[6]。不同温度下MAB使BSA荧光猝灭的Stern-Volmer曲线如图2所示,不同温度下MAB与BSA作用的猝灭常数见表1。由图2和表1可以看出,kq的值大于2.0×1010L/(mol·s),随着温度升高,荧光猝灭常数是减小的,表明荧光猝灭主要是由生成复合物的静态猝灭机制控制[7]。
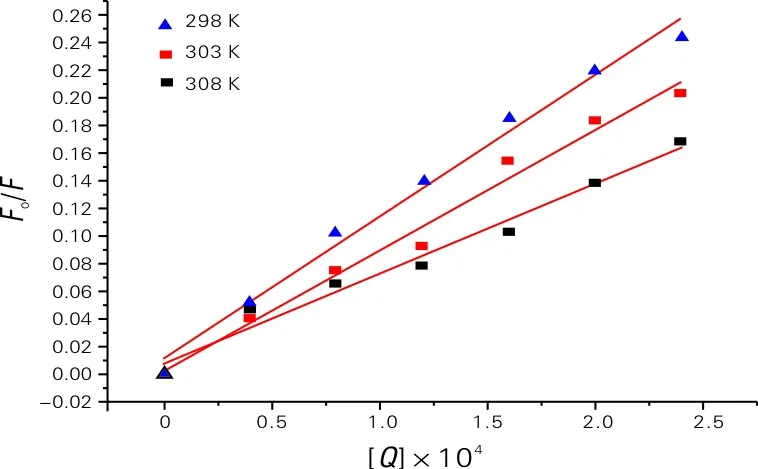
图2 不同温度下MAB使BSA荧光猝灭的Stern-Volmer曲线

表1 不同温度下MAB与BSA作用的猝灭常数
为了再次确认MAB对BSA的静态荧光猝灭机理,根据Lineweaver-Burk方程(改进的Stern-Volmer双倒数方程)再次分析荧光猝灭的数据。Lineweaver-Burk方程为:
(3)
式(3)中,F0和F分别为不存在和存在猝灭剂时的荧光强度;[Q]为猝灭剂的浓度;Ka为蛋白质和猝灭剂的结合常数;fa为初始荧光的分数[8]。
不同温度下MAB使BSA荧光淬灭的修正Stern-Volmer曲线如图3所示。由图3可以看出,F0/ΔF与1/[Q]呈线性关系,进一步验证了MAB对 BSA的荧光猝灭机制主要是静态猝灭[9]。

图3 不同温度下MAB使BSA荧光猝灭的修正Stern-Volmer曲线
2.1.2紫外吸收光谱分析
UV-vis吸收测量是一种非常简单的方法,适用于探索结构变化和复杂化合物的形成[10]。动态猝灭只影响淬灭分子的激发态,对淬灭物质的吸收光谱没有影响。为了进一步确认静态猝灭机理,测量得到了BSA,MAB和BSA-MAB体系的紫外可见吸收光谱(如图4所示)。由图4可以看出,BSA-MAB体系紫外差谱与空白的牛血清白蛋白(BSA)的紫外吸收谱不能重叠,在实验误差范围内。这再次验证了BSA与MAB猝灭机理为静态猝灭[11]。

图4 BSA,MAB和BSA-MAB体系的紫外可见吸收光谱
2.2 MAB和BSA间的相互作用力
小分子化合物与牛血清白蛋白发生结合时有4种非共价键力作用,即分子间氢键、范德华力、静电、分子疏水作用力,这些作用使化合物与BSA结合更稳定。化学结合反应过程中相关数据可以根据Van't Hoff方程计算:
(4)
式(4)中,K为对应温度下的结合速率常数;R为普适气体常数;ΔH为反应焓变,可以根据lnK对1/T的曲线图进行计算;ΔS为反应熵变;T为反应温度。
ΔG为吉布斯自由能,可以根据式(5)求出:
ΔG=ΔH-TΔS=-RTlnK
(5)
Leckband和Ross[12]对特殊化学结合反应过程中相关热力学参数值进行了研究,如果ΔH和ΔS的值均大于0,则说明化合物与BSA结合时产生的是疏水作用力;如果ΔH和ΔS的值均小于0,则表明化合物与BSA结合时产生的是范德华力和氢键作用力;而当ΔH的值是比较小的正值或负值,ΔS为正值时,说明化合物与BSA结合时是以静电相互作用的[13]。
MAB-BSA体系的Van't Hoff曲线如图5所示,MAB-BSA体系的热力学参数见表2。

图5 MAB-BSA体系的Van't Hoff曲线

表2 MAB-BSA体系的热力学参数
由图5和表2可以看出,ΔG均为负值,表明反应过程都是自发的。ΔH和ΔS均为正值,表示MAB-BSA复合物的形成是疏水作用[14]。
2.3 构象改变研究
同步荧光光谱可以提供发射荧光分子附近微环境的有用信息,最大发射波长位置的位移对应于荧光分子周围极性的变化。当激发和发射之间的波长差Δλ=15 nm时,同步荧光光谱产生关于酪氨酸残基的特征信息[15-16];当Δλ=60 nm时,同步荧光光谱产生色氨酸残基的特征信息。BSA和MAB之间相互作用的同步荧光光谱如图6所示。由图6可以看出,当Δλ=15 nm时,酪氨酸残基荧光光谱峰发生蓝移,表明药物对酪氨酸(Tyr)残基所处的环境有一定影响;当Δλ=60 nm时,色氨酸残基荧光光谱峰没发生偏移,表明药物对色氨酸(Trp)残基没有影响[17-18]。

(a) Δλ= 15 nm
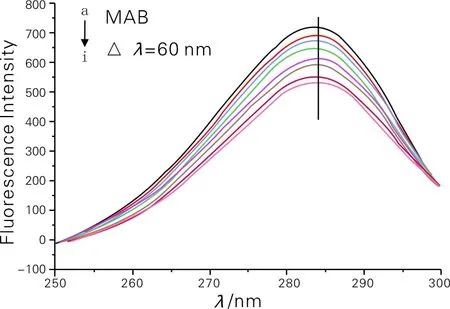
(b) Δλ= 60 nm
3 结论
在模拟生理条件下使用荧光光谱法研究了MAB与BSA的相互作用。实验结果表明BSA与MAB猝灭机制为静态猝灭,MAB可以与BSA分子结合形成复合物。热力学参数ΔH和ΔS表明MAB-BSA复合物主要通过疏水作用稳定。此外,同步荧光数据显示,BSA在与MAB结合后构象发生变化,MAB在酪氨酸残基处与BSA结合。

