哈密瓜贮期病害及防治技术
闵建华,陈世乾,陈 婷
(1.湖北理工学院 化学与化工学院,湖北 黄石 435003;2.湖北师范大学,湖北 黄石 435002)
哈密瓜因汁多肉厚、香甜可口、营养丰富,在夏秋季节深受广大消费者的喜爱,是消暑降温、解渴生津的家庭必备瓜果之一,被誉为“天下第一瓜”[1]。但因其体积较大、含糖量较高,在贮存期,特别是夏季多雨、闷热潮湿的环境中[2],极易染上霜霉病、叶斑病、蔓枯病等病害,造成经济损失[3]。目前,常用的食品贮藏保鲜方法主要有低温贮藏、气调保鲜、杀菌剂灭菌、保鲜膜包装等[2-3]。本研究将分离并鉴定引起哈密瓜病害的主要病原菌,并采用气调、杀菌剂灭菌等食品技术手段进行保鲜处理,以抑制病原菌的生长,阻止哈密瓜腐烂,达到延长贮藏期的目的。
1 材料与方法
1.1 试验材料
试验用哈密瓜市购,带梗,大小均匀一致,无损伤,约3.0 kg/个。
1.2 试剂与设备
1)试验用琼脂粉、噻苯咪唑(TBZ)、壳聚糖为优级纯,其他试剂均为分析纯。
2)试验用仪器包括:MJX-280H型智能霉菌培养箱;S.SW-CJ-IF型净化工作台;LDZX-40BI型立式自动电热压力蒸汽灭菌器;BY-TR型光学显微镜;XY-3A型臭氧发生器。
1.3 试验方法
1.3.1培养基的制备
将马铃薯洗净、切片、烘干,制成马铃薯粉。取100 g马铃薯粉,加入500 mL去离子水,煮沸40 min,加入10 g葡萄糖粉和20 g琼脂粉,补水至500 mL,用高压蒸汽灭菌锅进行灭菌,待用[4-5]。
1.3.2病原菌的分离、纯化和鉴定
取3个出现病变的哈密瓜,先用75%医用酒精对病变表面及周围进行擦洗消毒,然后用无菌水冲洗整个表皮数遍,用无菌手术刀切开哈密瓜病变区。在健康果肉与病变区接触处,用无菌镊子夹取病变组织,均匀涂布于培养基平板上,进行接种[5]。每个瓜取3个病变组织,呈三角形接种于同一培养基平板上,28 ℃培养5 d[6],观察菌落状态,选取具有代表性的菌落,重新接种于新的培养基平板上,以此类推,直至选出大小形状颜色一致的菌落[5,7]。取1滴乳酸苯酚棉蓝染液于载玻片上,用接种针挑取少许纯化后的菌丝置于染液中并分散开,在显微镜下观察孢子的形态特征[8],参照《真菌鉴定手册》进行鉴定。
1.3.3回接试验
取病原菌孢子,制成浓度为1×106个/mL的孢子悬浮液,备用。取新鲜哈密瓜,表面用75%医用酒精进行消毒,然后用无菌水冲洗数遍,晾干[9]。取20 μL孢子悬浮液于无菌橡胶盖内。将橡胶盖倒扣在哈密瓜果皮上并固定,在果皮表面均匀选取10个点进行相同操作[10-11]。将哈密瓜放于培养箱中,保持一定湿度和温度(室温),观察发病情况,并进行对照试验。
1.3.4病原菌抑制试验
1)将无菌壳聚糖溶液加入培养基中,制成壳聚糖浓度为1.0,2.0,3.0,4.0和5.0 mg/mL的培养基,同时进行对照试验[12]。
2)将接种有病原菌的平板置于臭氧环境中,臭氧浓度分别为300,400,500,600和700 μg/L,培养病原菌,同时进行对照试验[13-14]。
3)在密闭环境中,采用5%TBZ对接种有病原菌的平板进行熏蒸,5%TBZ的用量分别为4,5,6,7和8 g/m3,培养病原菌,同时进行对照试验[15-16]。
4)设计3因素3水平的正交试验。正交试验因素水平表见表1。

表1 正交试验因素水平表
根据表1中的因素和水平,在壳聚糖培养基平板上定量接种病原菌。将平板置于PE袋内,每天用TBZ熏蒸1次,每次持续90 min[15];然后用臭氧发生器向PE袋内充入一定浓度的臭氧,每隔6 h检查臭氧浓度,保持臭氧浓度恒定[14,17],如此处理5 d后,计算产生的孢子数量。同时进行对照试验,每组试验重复3次,取平均值[18]。
孢子繁殖抑制率η计算公式[12,19-20]为:
η=(N1-N2)/N1×100%
(1)
式(1)中,N1为对照组孢子数量;N2为处理组孢子数量。
2 结果与分析
2.1 病原菌鉴定
2.1.1哈密瓜发病状态
病原菌主要从机械损伤处或皮孔进入哈密瓜组织[21]。发病初期,表皮处主要出现不同程度的潮湿和不同颜色斑点。随着时间推移,斑点会慢慢向组织内部发展,使哈密瓜腐烂。在较高温度下,腐烂会加快[22]。进一步观察可发现,腐烂组织表面会出现白霉和白色、浅蓝色孢子。
2.1.2病原菌鉴定
将分离纯化后的病原菌在马铃薯培养基上培养。病原菌菌落和孢子如图1所示。由图1可知,病原菌菌落表面为黄绿色或浅褐色,背面为黄色或褐色,呈粒状形态、较厚。病原菌分生孢子梗呈帚状,含3层间枝,直径为3.5~4.5 μm。根据《真菌鉴定手册》,认定哈密瓜病原菌为青霉属鲜绿青霉[5]。

(a) 菌落特征
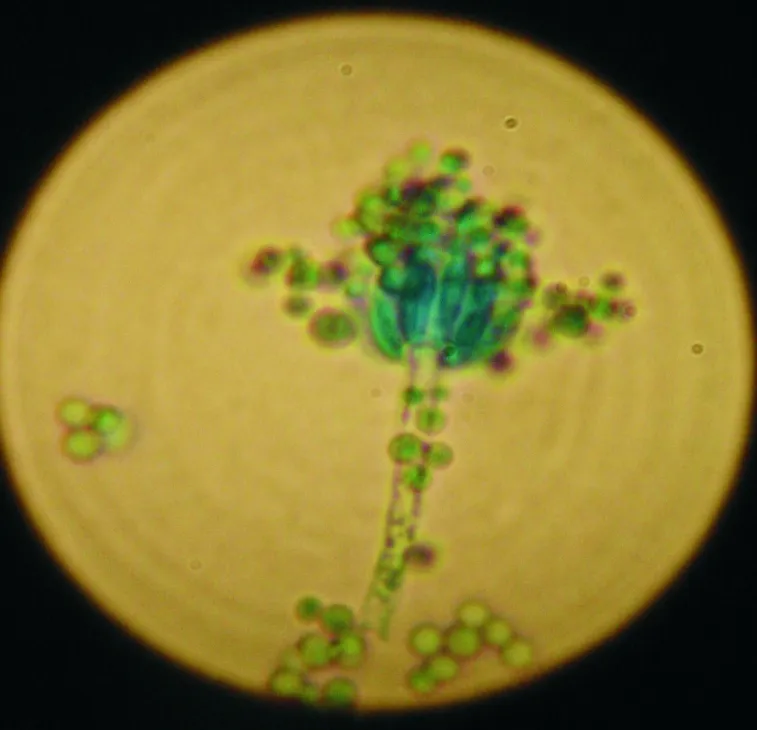
图1 病原菌菌落和孢子
2.1.3回接试验结果
取病原菌对哈密瓜进行接种,培养3 d后,哈密瓜发病率为35%,对照组无发病现象。取哈密瓜的发病组织进行培养,对出现的致病菌分离纯化,进行回接试验[11],发现哈密瓜发病区表现出相似的症状,证明鲜绿青霉为哈密瓜的贮期病变的主要致病菌。
2.2 病原菌抑制试验结果
2.2.1壳聚糖对孢子的抑制作用
壳聚糖浓度对孢子的抑制作用曲线如图2所示,将对照组的抑制率定义为0(下文同)。由图2可知,随着壳聚糖浓度升高,壳聚糖对哈密瓜病原菌的抑制率升高,当壳聚糖浓度达到3 mg/mL时,其对病原菌的抑制作用趋于平衡。因此,确定3 mg/mL为抑制哈密瓜病原菌孢子繁殖的理想壳聚糖浓度。

图2 壳聚糖浓度对孢子的抑制作用曲线
2.2.2臭氧对孢子的抑制作用
臭氧浓度对孢子的抑制作用曲线如图3所示。由图3可知,随着臭氧浓度增加,病原菌孢子的萌发延迟,说明臭氧具有抑制病原菌孢子繁殖的作用。进一步观察可知,在臭氧浓度为300~700 μg/L时,臭氧浓度越大,对孢子的抑制效果越好;当臭氧浓度达到600 μg/L时,其对病原菌的抑制作用趋于平衡。因此,确定600 μg/L为抑制病原菌孢子繁殖的理想臭氧浓度。

图3 臭氧浓度对孢子的抑制作用曲线
2.2.3 5%TBZ熏蒸对孢子的抑制作用
5%TBZ用量对孢子的抑制作用曲线如图4所示。由图4可知,随着5%TBZ用量增加,病原菌孢子的萌发延迟,说明TBZ具有抑制病原菌孢子繁殖的作用。进一步观察可知,5%TBZ用量为4~8 g /m3时,5%TBZ用量越大,对孢子的抑制效果越好;当5%TBZ用量达到6 g/m3时,其对病原菌的抑制作用趋于平衡。因此,确定6 g/m3为抑制病原菌孢子繁殖的理想5%TBZ用量。
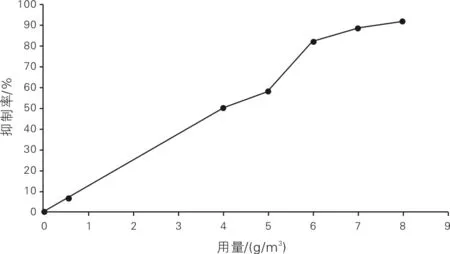
图4 5%TBZ用量对孢子的抑制作用曲线
2.2.4壳聚糖、臭氧、TBZ复合处理对孢子的抑制作用
正交试验结果及分析见表2。由表2可知,对孢子生长繁殖起抑制作用的主次顺序为:5%TBZ用量>壳聚糖浓度>臭氧浓度;最优处理条件为:壳聚糖浓度为3 mg/mL、O3浓度为600 μg/L、5%TBZ用量为6 g/m3。在此复合条件处理下,对孢子繁殖的抑制效果最好。
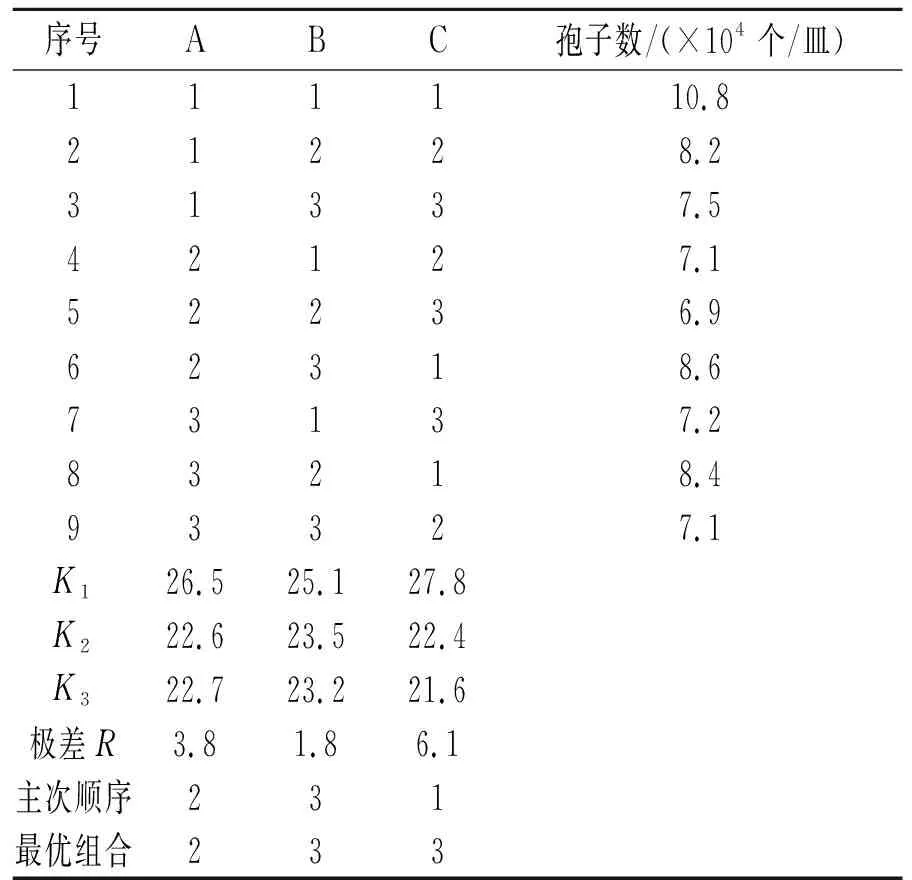
表2 正交试验结果及分析
2.2.5作用机理分析
TBZ是一种低毒性的杀菌剂,具有良好的杀菌效果,被广泛用于瓜果蔬菜的贮藏保鲜[23]。TBZ能够抑制子囊菌、担子菌等真菌的活性,对果品蔬菜真菌病害的防治具有很好的效果[24]。壳聚糖作为一种天然的高分子聚合物,具有来源广泛、制备简便、安全可靠的特点,被广泛应用于食品工业[25]。壳聚糖及其衍生物对食品防腐保鲜的作用机理主要表现在以下2个方面[26]:①小分子量的壳聚糖及其衍生物通过正负电荷相吸作用,改变微生物内外环境的渗透压,从而导致微生物死亡,或者直接进入微生物细胞内部,与其核酸或蛋白结合,从而影响微生物的生理功能,导致微生物的死亡;②高分子的壳聚糖及其衍生物附着在微生物表面,形成一种高分子膜,阻止养分或O2进入微生物内部,导致微生物死亡。臭氧具有强氧化性,性质活泼,可通过强氧化作用破坏微生物细胞膜,改变微生物细胞的通透性,导致微生物细胞死亡,达到杀菌的效果[27]。
3 结论
本文对引起哈密瓜贮期主要病害的病原菌进行了分离纯化,通过正交试验研究了壳聚糖涂抹、臭氧杀菌、5%TBZ熏蒸等方式对哈密瓜贮藏期孢子繁殖的抑制作用,得到抑制孢子繁殖的主次顺序为:5%TBZ用量>壳聚糖浓度>臭氧浓度;最优组合处理条件为:壳聚糖浓度为3 mg/mL、臭氧浓度为600 μg/L、5%TBZ用量为6 g/m3。

