不同基因型荞麦遗传转化体系初探
王欣芳 冯晋芳 侯思宇 冯晋华 杜伟 冯红梅 韩渊怀
摘要:本研究旨在利用遗传转化基础,打破荞麦杂交困难、种质创新难的瓶颈,提升荞麦研究水平。本试验以甜荞‘PI647061’和苦荞‘ZNQ152’为材料,设置正交实验对下胚轴进行组织培养,并通过农杆菌介导法侵染愈伤组织,用组织化学染色观察GUS基因的瞬时表达。试验结果表明:MS+2.0 mg/L 2,4-D+ 1.0 mg/L 6-BA可使下胚轴出愈率达90%以上。10种不同基因型荞麦下胚轴在MS+0.5 mg/L NAA + 1.0 mg/L 6-BA中分化率最高,再生率最高达52.6%。以携带遗传转化载体pRI201-AN-GUS的农杆菌LBA4404侵染愈伤组织,经选择培养后获得再生幼苗,进而在叶片中成功观察到GUS基因表达的蓝色斑点,转化阳性率为1.23%。本研究为探索关于荞麦优良基因的转化及建立有效的遗传再生体系提供了理论和实践基础。
关键词:荞麦;植物激素;愈伤组织;正交实验;遗传转化
中图分类号:S517文献标志码:A论文编号:cjas20200200027
Genetic Transformation System of Different Genotypes of Buckwheat: A Preliminary Study Wang Xinfang1, Feng Jinfang1, Hou Siyu1, Feng Jinhua1, Du Wei1, Feng Hongmei1, Han Yuanhuai1,
Liu Longlong2, Ma Mingchuan2, Wang Junzhen3, Sun Zhaoxia1, Li Hongying1(1Agricultural College of Shanxi Agricultural University, Taigu 030801, Shanxi, China;
2Institute of Germplasm Resources, Shanxi Academy of Agriculture Science, Taiyuan 030031, Shanxi, China; 3Liangshan Xichang Institute of Agricultural Science, Xichang 615000, Sichuan, China)
Abstract: The aim is to utilize the basis of genetic transformation to break the bottleneck of buckwheat hybridization and germplasm innovation, and improve the research level of buckwheat. In this experiment, common buckwheat‘PI647061’and tartary buckwheat‘ZNQ152’were used as materials, and the hypocotyls were cultured by orthogonal experiment. The callus was infected by agrobacterium-mediated transformation, and the temporary expression of GUS gene was observed by histochemical staining. The results showed that MS+ 2.0 mg/L 2,4-D + 1.0 mg/L 6-BA could make the calli ratio of hypocotyls reach more than 90%. In MS + 0.5 mg/L NAA + 1.0 mg/L 6-BA, hypocotyls of ten species of buckwheat had the highest differentiation rates, and the highest regeneration rate was 52.6%. The calli were infected by agrobacterium tumefaciens LBA4404, which carried the genetic transformation vector pRI201- AN- GUS. And the regenerated seedlings were obtained after selective culture, and then the blue spots of GUS gene expression were successfully observed in the leaves. The positive rate of transformation was 1.23%. This study provides a theoretical and practical basis for the exploration of the transformation of buckwheat excellent genes and the establishment of an effective genetic regeneration system.
Keywords: Buckwheat; Plant Hormones; Callus; Orthogonal Experiment; Genetic Transformation
0引言
蕎麦(Fagopyrum spp.)是起源于中国的传统作物[1],有苦荞(Fagopyrum tararicum Gaerth)和甜荞(Fagopyrum esculentum Moench)两个栽培种,以及被列为药用植物的金荞麦Fagopyrum dibotrys (D. Don) Hara)等十余个野生种[2]。荞麦是一种营养丰富的杂粮作物,其富含人体所需蛋白质、必需氨基酸、黄酮类物质(如芦丁)和手性肌醇等[3-4],也是无麸质健康食品,使其成为典型的“药食同源”作物[5]。荞麦以其对环境的强适应性,成为高寒贫瘠及西部山区种植的重要作物[6]。山西省地理条件复杂,气候条件差异较大,相比大规模的主粮种植,杂粮作物发展具有得天独厚的地域优势[7],因此大力发展荞麦种植,不仅能提升荞麦种质资源利用,也为荞麦产业的发展及人民脱贫致富提供契机。
有关荞麦育种的研究,目前多集中在如何提高其产量[8-11],营养品质[11-12]和加工特性[13]方面,但在分子生物学的研究尤其是转基因及分子育种研究上仍然难有突破,究其原因是荞麦离体再生及遗传转化研究有限。随着甜荞和苦荞基因组的陆续公布[14-15],大规模基因数据公布,这为荞麦基因功能的研究开拓了方向,同时也使得高效遗传转化体系的研究成为了荞麦研究最为迫切的需求。前期有关荞麦离体再生的研究主要有Hou等[16]以荞麦下胚轴为外植体,‘温莎甜荞’和‘九江苦荞’在MS+3.0 mg/L 2,4-D +0.5 mg/L 6-BA培养基上出愈率均在80%~90%;‘平荞2号’在MS+ 2.0 mg/L 2, 4-D+1.0-2.0 mg/L 6-BA的培养基上,愈伤组织诱导率高达100%[17];当2,4- D浓度为1.5 mg/L,6- BA为0.6 mg/L时‘西农9976’获得了较高的出愈率[18];‘邵通苦荞’和‘黑水苦荞’在MS+2.0 mg/L 2,4-D+1.5 mg/L 6-BA培养基上出愈率可高达86.62%[19];Shao等[20]发现,KT也是愈伤组织诱导有效的激素,如‘园子荞’和‘西昌苦荞’在MS+2.0 mg/L 2,4-D + 1.0 mg/L KT培养基上出愈率可达98.96%。对于外植体再生或分化研究,陈利红等[17]和吴崇明等[20]发现,愈伤组织在MS+ 0.1 mg/L IAA+ 2.0 mg/L 6-BA+1.0 mg/LKT的培养基上分化率为73.6%;在MS+0.1 mg/L IAA+2.0 mg/L 6-BA+1.0 mg/L KT+0 .5 mg/L TDZ培养基上分化率可达9.52%。在遗传转化研究中,陆小平[21]以荞麦幼苗阶段的茎尖组织作为受体材料,建立了发根农杆菌R1601介导的金荞麦高频遗传转化体系。Jovanka等[22]利用荞麦子叶与根癌农杆菌共培养,通过对DNA分析证实了根癌农杆菌的转化,得出在T1代180粒种子有3/4带有卡那霉素抗性,进一步为荞麦的遗传转化奠定了基础。潘灿飞等[23]利用农杆菌R1601感染了金荞麦的不同外植体(叶片、叶柄、愈伤组织),将R1601菌株中Ri质粒的T-DNA整合到金荞麦基因组中,并建立发根农杆菌R1601介导的金荞麦高频遗传转化体系。丰明等[24]通过农杆菌介导,将来源于干旱诱导下拟南芥的干旱调控基因DREB2A导入‘辽荞5号’中,以提高其耐旱性。陈利红等[25]将拟南芥液泡膜Na~+/H~+逆向转运蛋白基因AtNHX1通过农杆菌介导法转入到荞麦中,利用基因工程手段提高作物对盐胁迫耐受能力。上述研究均为荞麦遗传转化的实施提供了借鉴,但仍难以突破转化效率不稳定,受基因型影响较大的瓶颈。
本实验以10种荞麦为试验材料,充分利用现阶段所拥有的技术条件对荞麦的愈伤组织进行诱导、分化培养和生根培养,摸索最适激素配比,深入探究荞麦再生体系的影响因素。在此基础上,以期建立高效稳定的遗传转化体系,为荞麦种质资源创新研究奠定基础。
1材料与方法
1.1材料
本实验所用材料:苦荞‘ZNQ152’、‘ZNQ185’、‘ZNQ175’、‘ZNQ179’、‘ZNQ169’、‘甜荞PI647061’、‘PI890988’、‘PI647597’、‘晋荞1号’和‘温莎甜荞’由美国种质资源信息网络(GRIN),中国农作物种质资源平台(CGRIS)和山西农业大学(山西省农业科学院)农作物品种资源研究所提供;含有表达载体(pRI201-AN-GUS)的农杆菌LBA4404由山西农业大学农学院生物工程研究所提供;GUS染色试剂盒SL7160购于北京酷来博科技有限公司。本实验在山西农业大学实验大楼组织培养实验室,于2019年2月—2020年1月份进行。
1.2实验设计与方法
1.2.1下胚轴离体材料获取取健康饱满的荞麦种子放入0.1%的Tween 20溶液中浸泡20 min后依次用20%次氯酸钠溶液和0.1%氯化汞溶液振荡5 min,灭菌水冲洗5次以上(每次2~3 min)进行消毒,晾干后将种子接种于MS基本培养基上(图1A),(25±1)℃,暗培养4~ 6天。待无菌苗胚根、胚芽、下胚轴发育完全,下胚轴伸长至2.0 cm时(图1B),用手术刀切成0.5 cm左右的小段,接种到愈伤组织诱导培养基上。
1.2.2正交实验设计以MS为基本培养基,对下胚轴设置2,4-D和6-BA激素浓度配比诱导愈伤组织的正交实验方案,设置3因素3水平[26](表1),统计出愈率并用SPSS进行方差分析。将下胚轴接种于培养基上,每个培养皿中放入10个外植体,设置5次重复,暗培养7天后转至光下(3000Lux,周期为16 h的光照和8h的黑暗)培养15天,(25±1)℃,观察下胚轴愈伤组织的状态,统计下胚轴的出愈率并进行分析,筛选出最适愈伤组织诱导培养基。

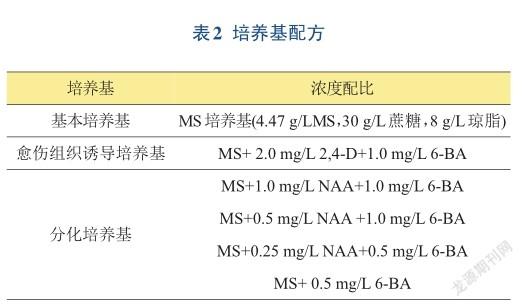
1.2.3不同基因型荞麦下胚轴愈伤组织诱导及分化试验将10个荞麦品种分别接种在1.2.2中最适愈伤组织诱导培养基上,统计出愈率。随后将愈伤组织切割成0.5cm×0.5cm,轉接到以不同浓度配比的NAA(1.0mg/L、0.5mg/L、0.25mg/L)和6-BA(0.5mg/L、1.0mg/L)的分化培养基上继续培养(表2),每2周继代1次,统计分化率。
1.2.4外植体侵染及GUS染色试验侵染步骤参考张宁等[27]将农杆菌菌株LBA4404的侵染液培养至OD600= 0.6~0.7时可用于侵染愈伤组织,不同的是LB液体培养基含有50 mg/L Kan+(卡那霉素),混浊后转至相同LB液体培养基中培养至OD600=0.8~1.1,重新悬浮菌体的MS液体培养基含有250μmol/LAS(乙酰丁香酮)。愈伤组织侵染40 min,期间要经常晃动平皿,之后转接至铺有灭菌滤纸的共培养培养基(滴入3~4 mL MS+ 250μmol/LAS)中暗培养3天;再转接至MS+1.0 mg/L 6-BA+0.5 mg/LNAA+200 mg/LKan+培养基中筛选20~ 25天;挑选绿色叶片,浸泡在GUS染色液(5mLGUS缓冲液+0.1mLGUS浓缩液)中,于(25±2)℃保温至过夜。染色完成后,将材料转入70%乙醇脱色3次,至阴性对照材料为白色,将材料放置在光学显微镜下观察并拍照。
1.3数据处理

数据统计分析采用Design-Expert.V8.0.6统计软件,用Duncan新复极差法分析。
2结果与分析
2.1荞麦愈伤组织诱导结果
将甜荞‘PI647061’和苦荞‘ZNQ152’下胚轴接种至9种愈伤组织培养基上,培养21天后,观察愈伤组织出愈情况,发现在2,4-D浓度为1.0 mg/L时,仅有少量愈伤组织出现,出愈率较低(30.7%~49.4%);当2,4-D浓度为1.5 mg/L时,出愈率提高到50.8%~69.1%,且愈伤组织颜色偏白,结构疏松;而当2,4-D达到2.0 mg/L时愈伤组织生长快,颜色嫩绿,外周可见球状突起,结构疏松(图1C-D)。正交试验结果表明,‘PI647061’和‘ZNQ152’下胚轴出愈率会随着2,4-D浓度的升高而提高;而6-BA对出愈率的影响是伴随着2,4-D浓度升高而变化。由此得到甜荞和苦荞愈伤组织诱导最佳培养基为MS+ 2.0 mg/L 2,4-D+1.0 mg/L 6-BA,出愈率分别可达94.5%和92.6%(表3)。
将正交试验获得的出愈率数据进行方差分析,获得以下结果分析(表4),回归模型达到极显著水平(P<0.01),失拟项P=0.4416>0.05,表明失拟项不显著,方程相关系数R2=0.9501,校正决定系数R2Adj= 0.9001,说明试验结果有90.01%与响应变量有关,模型与实际拟合度好,试验误差小,可解释大部分响应值的变化,因此,可用此模型对荞麦愈伤组织进行分析和预测。回归模型ANOVA分析中通过F值可知,各个因素对下胚轴诱导愈伤组织影响的主次顺序为:2,4-D(B)>6-BA(C)>品种/个(A)。其中,模型中一次项B和C对荞麦愈伤诱导有极显著影响(P<0.01),说明在不同激素浓度配比组合中,2,4-D和6-BA浓度变化对下胚轴愈伤组织的形成有极显著的影响,特别是2,4-D浓度的变化。

2.2不同基因型荞麦下胚轴愈伤组织诱导及分化试验结果
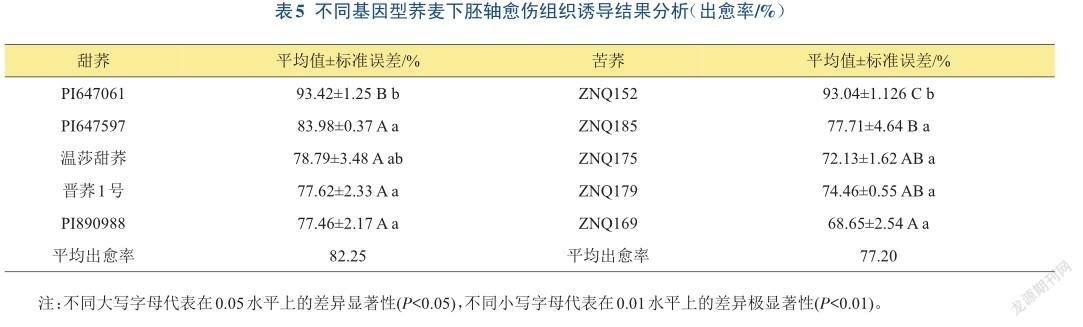
2.2.1不同基因型荞麦下胚轴愈伤组织诱导结果将苦荞‘ZNQ152’、‘ZNQ185’、‘ZNQ175’、‘ZNQ179’、‘ZNQ169’;甜荞‘PI647061’、‘PI890988’、‘PI647597’、‘晋荞1号’和‘温莎甜荞’十个荞麦品种分别在含有MS+ 2.0 mg/L 2,4-D+1.0 mg/L 6-BA的培养基上诱导愈伤组织。结果表明:愈伤组织的诱导率整体在70%~ 90%之间,其中,‘PI647061’出愈率为93.42%,相较于其他品种的甜荞出愈率达到了差异显著水平,‘ZNQ152’出愈率为93.04%,与其他品种的苦荞出愈率相比达到了差异极显著水平,愈伤组织在3周后呈哑铃型,膨大明显,颜色以黄绿色为主,且后续的分化效率较高。‘PI647061’和‘ZNQ152’与其他8个品种相比达到了差异显著水平。‘ZNQ169’出愈率为68.65%,诱导过程中愈伤组织生长较慢。说明不同基因型荞麦对激素的敏感性有明显不同。甜荞的平均出愈率82.25%高于苦荞的平均出愈率77.20%,说明甜荞的基因型相较于苦荞的基因型更有利于建立再生体系(表5)。
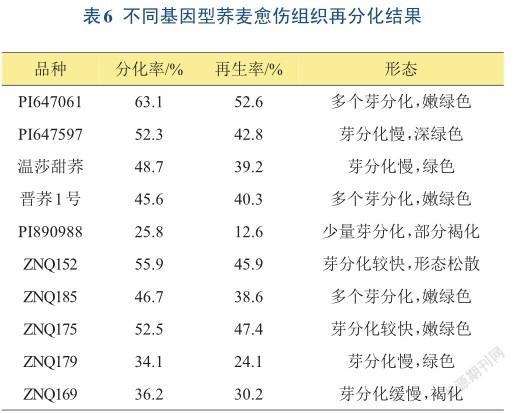
2.2.2不同基因型荞麦愈伤组织分化结果将愈伤组织转接到不同浓度配比的NAA(1.0 mg/L、0.5 mg/L和0.25 mg/L)和6-BA(0.5 mg/L和1.0 mg/L)分化培养基上继续培养,培养5周后(期间每2周进行继代培养),统计分化率。培养过程中发现15天后,愈伤组织的分化速度明显较快,在进入21天时,愈伤组织周围的芽开始分化(图1E-F)。在分化阶段,应及时更换培养基进行继代培养,否则芽分化速率会有所降低,时间过长愈伤出现褐化。在MS+1.0 mg/L NAA +1.0 mg/L 6-BA培养基中,分化过程中根毛的量在增加,这不利于后期芽的分化;在MS+0.25 mg/L NAA +0.5 mg/L 6-BA培养基中,愈伤组织的分化率有所升高;在MS+ 0.5 mg/L NAA +1.0 mg/L 6-BA的培养基中分化率最高(63.1%),愈傷在分化期间产生少量根毛,芽分化也较快。当NAA:6-BA=1时,根毛大量产生,芽分化受到抑制。而当NAA:6-BA=0.5时,愈伤组织分化能力较强,表明生长素(NAA)与细胞分裂素(6-BA)的不同比例能控制愈伤组织的分化程度。统计10种荞麦愈伤组织转接在分化培养基MS + 0.5 mg/L NAA + 1.0 mg/L 6-BA中的分化率(表6),‘PI647061’和‘ZNQ152’的分化率和再生率最高,这与前期愈伤组织长势好有关。接着将分化的不定芽放置在1/2MS+ 0.5 mg/L NAA的生根培养基中诱导生根。

2.3农杆菌侵染及GUS染色结果分析
试验着手于确定未侵染愈伤组织对不同Kan+浓度的抗性,设置浓度为50、150、200 mg/L,黄化率分别为48%、63.16%、80%,最终将选择培养基中的Kan+浓度设置为200 mg/L Kan+。关于侵染时间对侵染效果的影响,当侵染液OD600=0.6~0.7的情况下,设置时间为15、30、45、60 min,在侵染15 min和30 min情况下,愈伤组织在选择培养基中不再分化出叶片,后期愈伤组织褐化严重,侵染60 min时,污染情况严重,无法进行统计。在此基础上选取‘PI647061’和‘ZNQ152’下胚轴诱导的愈伤组织切成0.5 cm×0.5 cm的小块,放入培养基(MS+1.0 mg/L 6-BA +0.5 mg/L NAA)中预培养2天,将愈伤组织置于侵染液中浸泡45min左右,经过共培养3天和筛选培养25天后,下胚轴诱导的愈伤组织侵染后能观察到新叶片。选择绿色叶片进行GUS染色,脱色,至阴性对照为白色(图2),在显微镜下观察,发现在‘PI647061’叶片处和‘ZNQ152’叶柄处观察到蓝色GUS基因表达位点,并统计转化阳性率为1.23%(转基因幼苗数/用于侵染的愈伤组织数)。此处的转基因幼苗所用的侵染条件:侵染时间40 min,OD600=0.634。通过对愈伤组织数、分化数和黄化数的统计得到以下结果:分化率为43.21%(分化数/愈伤组织数),黄化率为68.57%(黄化数/分化数),这里的黄化率低于200 mg/L Kan+浓度下未侵染愈伤组织再生苗的黄化率(80%),说明侵染试验中存在转基因成功的幼苗。
3讨论与结论
近年来,人们在植物组织培养技术方面取得了显著进步,其成果也广泛应用于生产和生活中。外植体的选择是进行植物组织培养、构建遗传转化体系的基础,本试验选择了较为常用、取材容易的下胚轴,这与王成龙[28]实验中荞麦下胚轴再生能力最好的结论相符。

在再生植株诱导过程中,刘拥海等[29]通过探索苦荞愈伤组织的诱导,发现不同激素组合条件下愈伤组织的诱导效果有明显差异。吴崇明等[18]研究了苦荞离体再生体系,在保持2,4-D浓度为2.0 mg/L的情况下,逐渐增加6-BA的浓度,发现愈伤组织诱导率也随之增加。朴莲玉等[30]在诱导玉米愈伤组织中发现2,4-D的成熟胚愈伤组织诱导效果优于NAA;加了细胞分裂素6-BA的培养基诱导率虽然高,但褐化严重。Han等[31]和王爱国等[32]对荞麦愈伤组织诱导的研究中,发现诱导率的提升对2,4-D表现出了明显的依赖性。本文中正交实验结果表明,当6-BA的浓度为1.0 mg/L时,随着2,4-D浓度的增加,诱导率也在逐步升高,当培养基为MS + 2,4- D 2.0 mg/L + 6- BA 1.0 mg/L时,甜荞‘PI647061’最高出愈率为94.5%,苦荞‘ZNQ152’为92.6%。其结果符合陈佳[33]实验中甜荞胚轴在MS+ 2 mg/L 2,4-D+1 mg/L 6-BA的培养基中愈伤组织生长状态最好,最适合后期的分化再生。虽然本步骤严格按照正交实验进行探索,但并未验证2,4-D浓度为2.0 mg/L时为诱导愈伤组织最佳培养基,需要探究在继续增加2,4-D浓度的情况下,统计下胚轴出愈率进行验证。实验中‘PI647061’和‘ZNQ152’的出愈率与其他8个品种相比达到了差异显著水平,表明不同品种对激素的最适浓度要求不同。此结果类似于吴崇明等[34]通过对比鞑靼荞麦发现普通荞麦最佳的培养基配方并非是最适合的,普通荞麦与鞑靼荞麦虽同为荞麦属,但生理生化特点仍然存在较大差异,存在着种间的差异性。品种间的差异导致组织培养过程的复杂性,适合一种荞麦的培养基配方并不能用于全部品种,需要从种质资源中挑选适合此配方的品种,再做进一步的探究。本试验从愈伤组织诱导和分化过程中可知细胞分裂素添加量比生长素浓度高时,有利于愈伤分化。当生长素浓度比细胞分裂素过高时,有利于根的培养,与王茅雁[35]文章中只添加一定浓度的生长素可诱导荞麦不定芽生根相似。
在农杆菌侵染过程中,由于农杆菌对酚类化合物具有趋化性,因此在荞麦遗传转化中添加诱导性最好的酚类化合物AS,能在一定程度上提高转化率[36]。武小霞等[37]表明外植体的共培养基中添加AS是农杆菌介导大豆遗传转化能够成功的重要因素。本试验在重悬液和共培养液体中添加250μmol/LAS用于侵染,相比郑丽红等[38]人报道的侵染大豆用200μmol/L的浓度略高,这表明不同植物对AS的敏感程度不同,需要试验验证。除此之外,影响转化效率的因素还包括侵染菌株毒力、侵染时间、农杆菌菌液浓度等。赵盖超等[39]将‘晋荞一号’叶片诱导的愈伤组织浸没在携带pBI121质粒的EHA105农杆菌悬浮液中侵染30 min,最终获得阳性愈伤组织。王成龙等[28]以不同苦荞品种为试验材料,探讨不同浓度的A4侵染液对毛状根的诱导效果,发现当菌液浓度OD600=0.6时,毛状根诱导率最高;考虑到下胚轴幼嫩脆弱,本试验中选用了弱毒性的LBA4404作為宿主,菌液浓度与前两者相近,为了保证侵染效率,适当延长了侵染时间至40 min,取得了较高的侵染率。这提示我们在选择侵染条件时要综合考虑多方面因素,以取得最佳的试验效果。李占旗等[40]选择‘凤凰苦荞’下胚轴经农杆菌LBA404侵染后再接种至MS无激素固体培养基上进行共培养,具有较高的转化效率。而田菲菲等[41]探究固体培养基和液体培养基对百合遗传转化体系的影响,操作方法与本试验一致。研究结果表明液体共培养能显著提高百合愈伤组织的瞬时表达率,同时也说明了此方法的可行性和有效性。在再生幼苗叶片经GUS染色后,于佳淼等[42]使用70%乙醇进行脱色与本试验相同,同时也告诉我们在进行观察时需要在材料处滴加少量水分,用毛笔和镊子将植物铺平再进行拍照。
本研究以甜荞‘PI647061’和苦荞‘ZNQ152’下胚轴为外植体,设置正交实验分析出愈率发现下胚轴出愈率会随着2,4-D浓度的升高而提高,而6-BA对出愈率的影响是伴随着2,4-D浓度升高而变化,MS+ 2.0 mg/L 2,4-D+1.0 mg/L 6-BA可使出愈率最高达94.5%。分析10种不同基因型荞麦愈伤组织诱导后的分化,发现当NAA:6-BA=0.5时,愈伤组织分化能力较强,说明生长素(NAA)与细胞分裂素(6-BA)的比例控制着愈伤组织的分化程度。用携带遗传转化载体pRI201-AN-GUS的农杆菌LBA4404侵染愈伤组织,当侵染时间为40 min,OD600=0.634时侵染效果较好,转化阳性率为1.23%。
参考文献
[1]史建强,李艳琴,张宗文,等.荞麦及其野生种遗传多样性分析[J].植物遗传资源学报,2015,16(3):443-450.
[2]范昱,丁梦琦,张凯旋,等.荞麦种质资源概况[J].植物遗传资源学报,2019,20(4):813-828.
[3]尹礼国,钟耕,刘雄,等.荞麦营养特性、生理功能和药用价值研究进展[J].粮食与油脂,2002(5):32-34.
[4]刘瑞敏.苦荞降糖成分的提取与药效初步研究[D].成都:四川师范大学,2012.
[5]雷建鑫,刘云梅,严柚芬,等.药食同源作物荞麦的营养保健价值及栽培技术[J].农家参谋,2019(1):58.
[6]桑满杰,卫海燕,毛亚娟.基于随机森林的我国荞麦适宜种植区划及评价[J].山东农业科学,2015(7):46-52.
[7]梁宗栋.抓住育种源头发展小杂粮产业[J].种子科技,2004,22(3): 132-133.
[8]杜莹.甜荞不同花柱类型杂交后代遗传表现及自交不亲和性的SSR标记分析[D].杨凌:西北农林科技大学,2015.
[9]郭超.自花结实甜荞杂交后代花柱类型、结实性分离及其SSR标记[D].杨凌:西北农林科技大学,2016.
[10]郭菊卉.普通荞麦重组自交系群体SSR标记遗传作图与重要农艺性状的QTL定位[D].贵阳:贵州师范大学,2014.
[11]杨丽娟.荞麦种间杂种的细胞学观察及不同环境对新类型苦荞的产量与品质的影响研究[D].贵阳:贵州师范大学,2019.
[12]贾彩凤.药用植物金荞麦辐射诱变的早期选择及分子标记鉴定[D].北京:中国协和医科大学,2008.
[13]陈庆富.荞麦生产状况及新类型栽培荞麦育种研究的最新进展[J].贵州师范大学学报:自然科学,2018,36(3):1-7,131.
[14]Yasui Yasuo, Hirakawa Hideki, Ueno Mariko, et al. Assembly of the draft genome of buckwheat and its applications in identifying agronomically useful genes.[J]. DNAresearch,2016,23(3).
[15]Zhang L J, Li X X, Ma B, et al. The Tartary Buckwheat Genome Provides Insights into Rutin Biosynthesis and Abiotic Stress Tolerance[J]. Molecular plant,2017,10(9).
[16]Hou S, Sun Z, Linghu B, et al. Regeneration of buckwheat plantlets from hypocotyl and the influence of exogenous hormones on rutin content and rutin biosynthetic gene expression in vitro[J]. Plant Cell, Tissue and Organ Culture 2015,120(3):1159-1167.
[17]陈利红,徐子勤.荞麦组织培养及高频植株再生体系的建立[J].分子细胞生物学报,2006,39(5):445-452.
[18]王鹏姬,高金锋,苏旺,等.培养条件对荞麦愈伤组织生长及黄酮合成的影响[J].核农学报,2013,27(5):591-597.
[19]吴崇明,马欣荣,杨宏.鞑靼荞麦离体再生体系的建立[J].应用与环境生物学报,2009,15(6):786-789.
[20]Shao J R, Zhou M L, Wu Y M, et al. Plantlet regeneration of Tartary buckwheat (Fagopyrum tataricum Gaertn.) in Vitro Tissue Cultures[J]. Protein & Peptide Letters, 2016, 23(5): 68-77.
[21]陆小平,小岛峰雄.整体植株转化法在荞麦上的应用[J].作物学报, 2003(1):159-160,164.
[22]Milju- Djuki J, NeKovi M, Ninkovi S, et al. Agrobacteriummediated transformation and plant regeneration of buckwheat(Fagopyrum esculentum Moench.)[J]. Plant Cell, Tissue and Organ Culture, 1992, 29(2): 101-108.
[23]潘灿飞.Ri质粒介导金荞麦的遗传转化及毛状根中类黄酮合成的调节[D].重庆:西南大学,2008.
[24]丰明,陈庆富,葛维德,薛仁风.抗旱调控基因DREB2A转化辽荞5号的研究[J].东北农业科学,2019,44(4):29-36.
[25]陈利红. AtNHX1基因对荞麦的遗传转化及抗盐再生植株的获得[D].西安:西北大学,2007.
[26]盖钧镒.试验统计方法[M].中国农业出版社,2000.
[27]张宁,司怀军,李学才,等.根癌农杆菌介导的马铃薯高效遗传转化体系的研究[J].中国马铃薯,2004(3):132-135.
[28]王成龙.苦荞毛状根的诱导及高频再生体系的建立[D].雅安:四川农业大学,2015.
[29]刘拥海,俞乐,黄伟华,等.苦荞种子萌发条件和愈伤组织的诱导[J].湖南农业大学学报:自然科学版,2006(1):12-14.
[30]朴莲玉.玉米不同外植体愈伤组织诱导及分化的研究[D].延边:延边大学,2013.
[31]Han, Myoung- Hae, Kamal, et al. Regeneration of plantlet via somatic embryogenesis from hypocotyls of Tartary Buckwheat(Fagopyrum tataricum)[J]. Australian Journal of Crop Science,2011, 5(7).
[32]王爱国,张以忠,任翠娟,等.普通荞麦愈伤组织诱导及其分化的正交设计试验研究[J].种子,2006(1):7-10,13.
[33]陈佳.荞麦无菌苗培养条件优化及离体再生体系研究[D].杨凌:西北农林科技大学,2012.
[34]王茅雁,锡建中,张晶,等.荞麦愈伤组织的高频率诱导和植株再生研究[J].内蒙古农业大学学报:自然科学版,2000(2):41-44.
[35]刘香利,陈明利,赵惠贤.小麦农杆菌转化体系的优化及HMWGS1Bx14基因转化[J].中国农业大学学报,2011,16(6):25-31.
[36]邓艺,曾炳山,赵思东,等.乙酰丁香酮在农杆菌介导的遗传转化中的作用机制及应用[J].安徽农业科学,2010,38(5):2229-2232.
[37]武小霞,李静,王志坤,等.乙酰丁香酮浓度和共培养pH对大豆再生频率的影响[J].东北农业大学学报,2010,41(5):1-4.
[38]郑丽红.大豆胚尖再生体系的优化及EPSPS基因遗传转化的研究[D].天津:天津大学,2012.
[39]赵盖超,孙朝霞,令狐斌,等.甜荞高效离体再生与GUS基因瞬时表达分析[J].山西农业科学,2015,43(9):1098-1101.
[40]李占旗.苦荞离体再生体系的建立和遗传转化研究[D].西安:西北大学,2007.
[41]田菲菲,刘雅莉,杜灵娟,等.农杆菌介导的ACO-RNAi载体对百合胚性愈伤的转化[J].西北农林科技大学学报:自然科学版,2015,43(3):105-112.
[42]于佳淼.大豆組织特异型启动子表达特性分析[D].吉林:东北师范大学,2018.

