PRiME净化-UHPLC-MS/MS法测定鸡蛋中金刚烷胺类药物残留
李占彬,王正强,黄永桥,杨鸿波
贵州省分析测试研究院(贵阳 550014)
金刚烷胺类药物具有饱和三环癸烷的结构,主要有金刚烷胺(Amantadine)、金刚乙胺(Rimantadine)、美金刚(Memantine)等(图1),具有抗流感病毒、抗帕金森氏综合征等药理作用[1-4]。在家禽养殖过程中,金刚烷胺类药物被广泛用于鸡禽流感的预防和早期治疗。随着养殖规模的扩大及流感类疾病的频发,金刚烷胺类药物使用剂量正在日益增加,食用这种有金刚烷胺类药物残留的禽产品,会导致人体对病毒的耐药性增加[5-7]。农业部在2005年发布的农业部第560号公告中明确禁止金刚烷胺类抗病毒药物生产、销售及使用,但在实际养殖过程中,仍存在非法使用该类药物,这已成为我国畜禽产品安全的重要影响因素,因此亟需建立一种快速检测该类药物残留的检测方法。
目前已报道的金刚烷胺类药物检测的方法主要有高效液相色谱法[8-10]、高效液相色谱-串联质谱法[11-14]、气相色谱法[15-17],这些方法测定的基质各异。其中,汤晓艳等[5]建立的鸡蛋中金刚烷胺残留测定方法中,样品处理过程繁琐、耗时长、使用大量有试剂,且方法检出限较大,难以满足快速分析的需要;林涛等[19]和吴银良等[18]建立的鸡蛋中金刚烷胺类药物残留量的测定方法,样品前处理使用QuCHERS试剂进行净化,该方法虽然简单快速,但其去除干扰物质的能力较SPE柱略差,对结果的准确性有一定影响。
此次试验的样品前处理使用PRiME HLB进行净化,前处理简单,并且基质干扰较小、灵敏度较高,能得到较为满意的效果。通过优化UHPLC-MS/MS条件,并对鸡蛋样品进行测定,建立了同时测定3种金刚烷胺类药物的快速检验方法,并采用同位素内标法进行定量分析。该方法具有操作简单、快速、定性定量准确等优点,适用于鸡蛋中金刚烷胺类药物的测定,为金刚烷胺类药物的检测提供更多的技术选择。
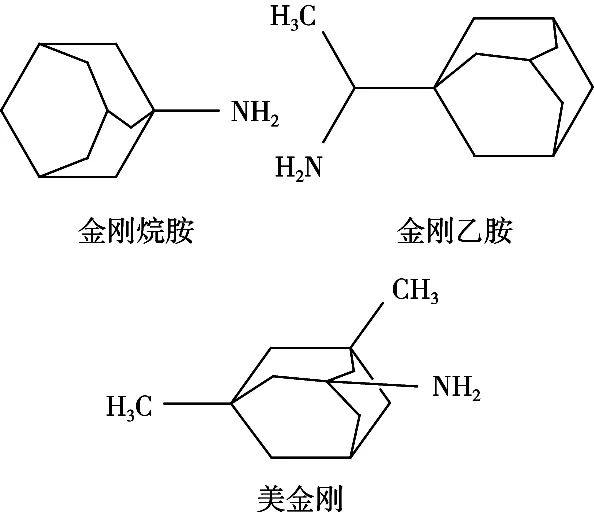
图1 3种物质的化学结构式
1 材料与方法
1.1 仪器和试剂
1.1.1 主要仪器与设备
Agilent 1290超高效液相色谱仪、Agilent 6470 QQQ三重串联四极杆质谱,配有ESI源(美国Agilent公司);Blixer3搅拌机(法国ROBOT COUPA公司);LT2002电子天平(常熟市天量仪器有限公司);UMV-2多管涡旋混合器(北京普立泰科仪器有限公司);离心机(湖南湘仪离心机仪器有限公司);Milli-Q超纯水机(美国Millipore公司);Supelco 12管固相萃取装置(美国Supelco公司);氮吹仪(上海安普实验科技股份有限公司);陶瓷均质子(迪马科技有限公司);Oasis PRiME HLB固相萃取小柱(美国Waters公司);0.22 μm PTFE滤膜(上海安普实验科技股份有限公司)。
1.1.2 主要材料与试剂
金刚烷胺、金刚乙胺、美金刚、金刚烷胺-D6、美金刚-D6(纯度>98%,德国Dr. Ehrenstorfer公司);甲醇、乙腈(色谱纯,德国Merck公司);乙腈(分析纯,天津市科密欧化学试剂有限公司);甲酸(色谱纯,上海安普实验科技股份有限公司);乙酸铵(分析纯、西亚试剂)。
1.2 标准溶液配制
分别精密称取10 mg(精确至0.000 1 g)金刚烷胺、金刚乙胺、美金刚、金刚烷胺-D6、美金刚-D6标准品于100.0 mL棕色容量瓶中,用乙腈溶解并定容刻度,混匀,配制成质量浓度为100 mg/L标准储备液,于-18 ℃避光保存。分别从金刚烷胺、金刚乙胺、美金刚标准储备液中移取100.0 μL标准储备液于10 mL棕色容量瓶中,用乙腈定容,配制成1 mg/L的混合标准中间液;移取100.0 μL混合标准中间液于10 mL棕色容量瓶中,用乙腈定容,配制成10 μg/L的混合标准工作液;备用。分别从金刚烷胺-D6、美金刚-D6标准储备液中移取100.0 μL标准储备液于10 mL棕色容量瓶中,用乙腈定容,配制成1 mg/L的混合内标中间液;移取500.0 μL混合标准中间液于10 mL棕色容量瓶中,用乙腈定容,配制成50 μg/L的混合内标工作液;备用。
1.3 色谱条件
色谱柱:Agilent ZORBAX Eclipse Plus-C18反向色谱柱(50 mm×2.1 mm,1.8 μm);流动相A:0.1%甲酸水溶液;流动相B:乙腈;流速:0.3 mL/min;柱温:40 ℃;进样体积:2.0 μL;梯度洗脱程序见表1。
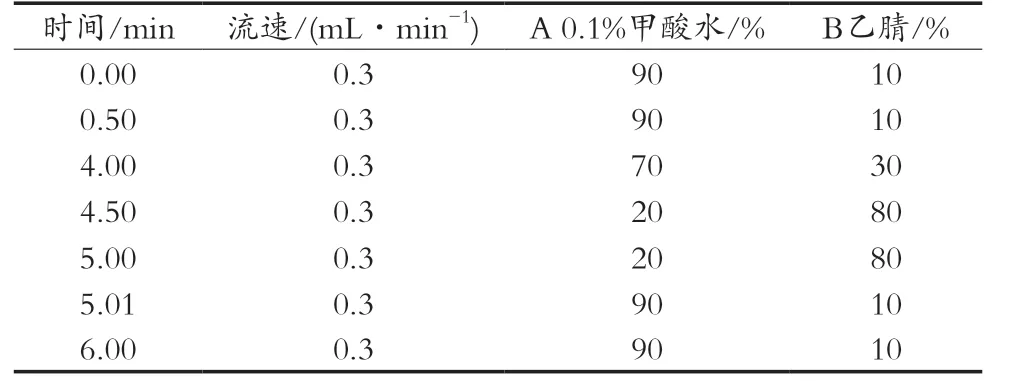
表1 洗脱梯度
1.4 质谱条件
离子源,电喷雾离子源(ESI),正离子扫描;多反应监测(MRM);毛细管电压,4.5 kV;雾化器压力,40 psi;干燥气流速,10 L/min;干燥气温度,300 ℃;鞘气流速,10 L/min;鞘气温度,300 ℃。其他质谱条件见表2。
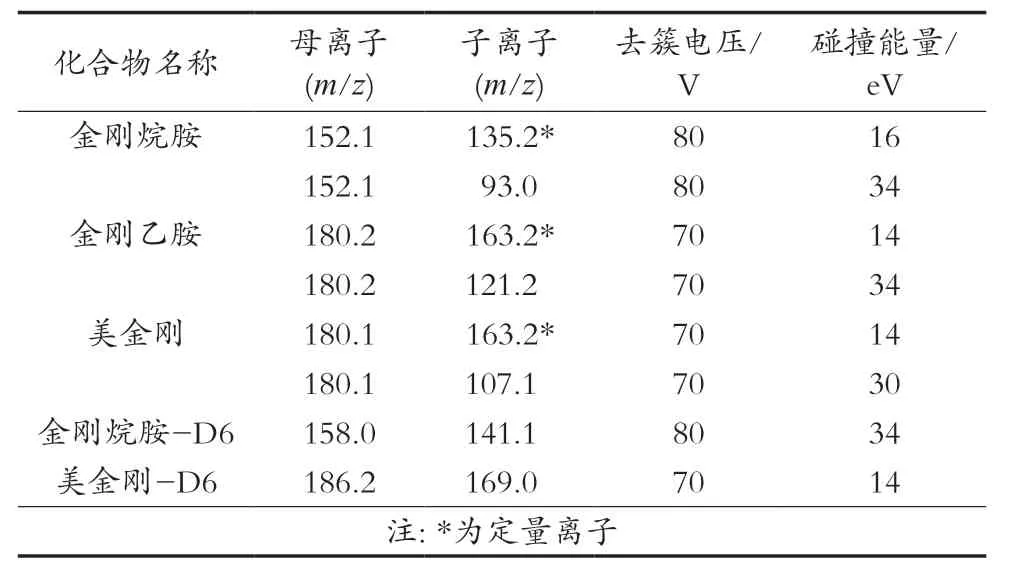
表2 质谱条件
1.5 样品前处理
称取5.00 g混匀后的样品于50 mL具塞离心管中,加入0.10 mL混合内标工作液,准确加入20 mL 0.2%甲酸乙腈,加盖后涡旋振荡10 min,以4 500 r/min常温离心10 min,吸取约3 mL上清液过PRiME HLB固相萃取柱(无需对小柱进行活化、淋洗等步骤),以1滴/s的速度过柱,弃去前几滴流出液,收集剩余续滤液,准确量取2.0 mL滤液于另一个15 mL离心管中,在45 ℃在氮吹至近干,用1 mL初始流动相溶解残渣,涡旋混匀,过0.22 μm PTFE滤膜,供UHPLC-MS/MS测定。
2 结果与分析
2.1 质谱条件的优化
根据金刚烷胺类药物化学结构的特点,其容易得到H+而形成[M+H]+准分子离子,故试验选择正离子模式监测,在正离子模式下一级全扫描质谱,得到相应的分子离子峰([M+H]+);通过优化锥孔电压,对母离子进行二级质谱分析,得到子离子特征碎片质谱图;选择特征碎片中离子中响应值高、基线噪声低的2对离子对作为定性、定量离子对,优化子离子对碰撞能量,使其丰度最大;进一步优化毛细管电压、雾化器压力、干燥和鞘气的温度及压力等质谱参数,经优化后得到表2的质谱参数。
2.2 色谱条件的选择
试验采用反相C18色谱柱对金刚烷胺类药物进行分离。分别考察了乙腈-水、乙腈-0.1%甲酸水、乙腈-0.1%甲酸水含2 mmol/L乙酸铵溶液、甲醇-0.1%甲酸水、甲醇-0.1%甲酸水含2 mmol/L乙酸铵溶液等不同洗脱体系对目标物分离能力。结果表明,使用乙腈-0.1%甲酸水作为流动相时,目标物有良好的色谱分离效果,色谱峰峰型更好,且有较好的响应值。金刚乙胺和美金刚属同分异构体,同时它们的碎片离子完全相同,等度洗脱很难将其进行分离,故采用梯度洗脱的方式进行分离,通过优化流动相流速、组成和比例、柱温等色谱条件,结果见图2,经优化后得到表1的色谱条件。
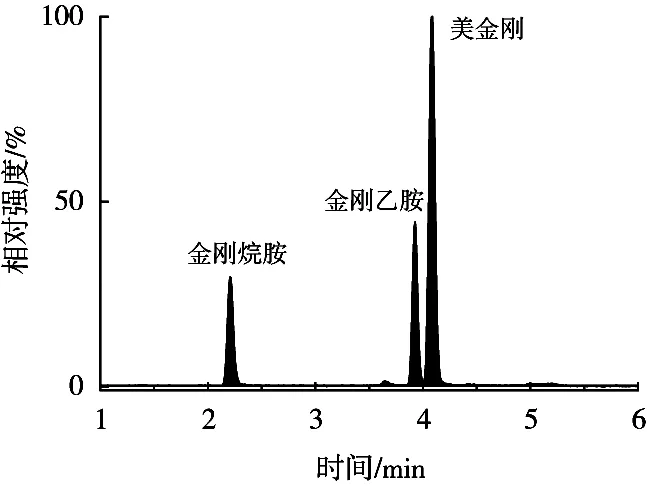
图2 金刚烷胺、金刚乙胺和美金刚标准溶液的TIC色谱图
2.3 样品前处理的优化
2.3.1 提取溶剂的选择
鸡蛋样品中富含蛋白质和脂肪等物质,因此在样品前处理时需要考虑沉淀蛋白和去除脂肪。乙腈具有沉淀蛋白的效果,常作为提取剂。试验分别考察了乙腈、80%乙腈、0.2%甲酸乙腈和80%乙腈(含0.2%甲酸)的提取效率。由图3可知,选取0.1%甲酸乙腈和80%乙腈(含0.2%甲酸)作为提取剂时,金刚烷胺、金刚乙胺、美金刚的回收率大于90%,略高于乙腈、80%乙腈水的回收率,考虑到沉淀蛋白的效果和氮吹浓缩的时间,选用80%乙腈(含0.2%甲酸)作为提取溶剂。
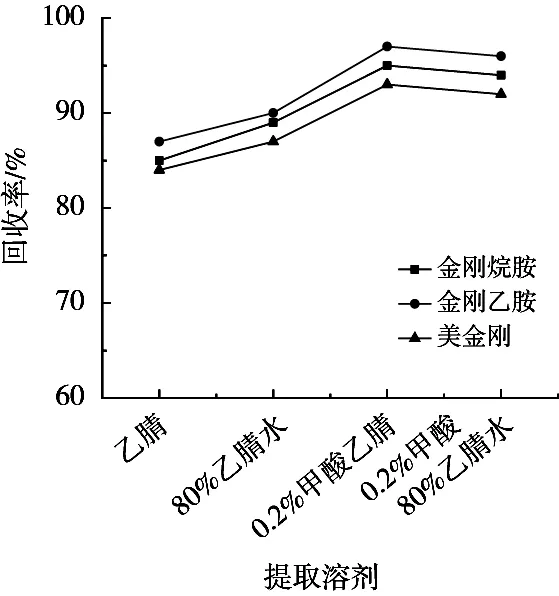
图3 不同提取溶剂的回收率
2.3.2 净化柱的选择
试验采用PRiME HLB固相萃取小柱进行样品的净化。考察了混合型阳离子交换柱MCX及PRiME HLB固相萃取柱的保留效果,结果发现,采用MCX固相萃取柱能减少样品中杂质,且目标物损失较少,回收率在90%左右,但是使用MCX小柱净化操作步骤繁琐,耗时较长,且过程中使用大量有机试剂,对人体健康影响较大。采用PRiME HLB,酸化乙腈的提取液直接过柱,固相萃取小柱无需活化,目标物化合物通过小柱,样品中磷脂、脂肪等杂质被吸附于萃取柱,这样既能使干扰物有效去除,又确保待测组分损失较小,同时在净化过程中省去了溶剂转换的过程,简化了操作步骤,且目标物的回收率在90%左右,与MCX固相萃取柱回收率相当,故采用PRiME HLB固相萃取小柱进行净化。
2.4 样品的基质效应
使用ESI源质谱仪分析食品中兽药残留时,基质效应是时常遇到的现象,仪器的灵敏度和重现性易受基质效应的影响,同位素内标法因其性质与目标物相似,受基质影响程度相同,是液质联用分析中常采用的降低基质效应、提高定量准确性的一种方法[20]。试验选用金刚烷胺-D6和美金刚-D6作为内标物进行校正,金刚烷胺-D6作为金刚烷胺同位素内标物,美金刚-D6作为美金刚和金刚乙胺同位素内标物。由于样品溶液有已知浓度的同位素内标物,故减少了样品基质效应的影响,确保了方法的灵敏度、重现性和定量分析准确性。
2.5 标准曲线与最低检出限
在试验所确定的色谱和质谱条件下,分别配制3种药物质量浓度为0.025,0.05,0.10,0.20,0.50,1.25,2.50和5.00 μg/L的系列混合标准溶液(内标物质量浓度为0.50 μg/L)。以待测物标准溶液质量浓度为横坐标,以标准品定量离子对与内标物离子对峰面积的比值为纵坐标,分别绘制3种金刚烷胺类药物标准溶液工作曲线。结果表明,金刚烷胺类药物在0.025~5.00 μg/L的质量浓度范围内呈良好的线性关系,相关系数(R2)在0.999 2以上,适用于定量分析。通过向阴性样品中添加目标物来考察方法的检出限(LOD,S/N=3)和定量限(LOQ,S/N=10),结果见表3。说明该方法具有较好的灵敏度。
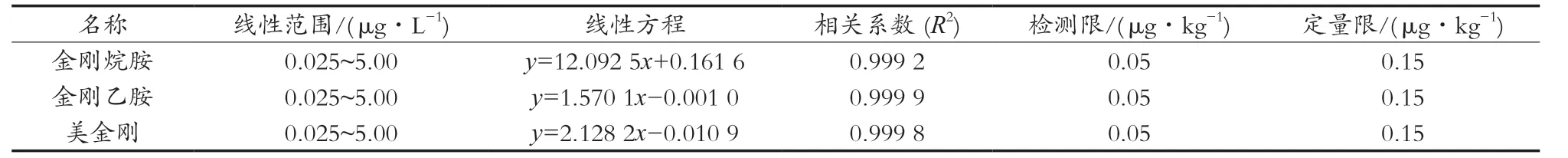
表3 线性范围、线性方程、相关系数(R2)、检出限和定量限
2.6 精密度及加标回收试验
采用在空白样品中添加标准溶液的方法进行加标回收试验,选取鸡蛋阴性样品,分别添加0.05,0.1和0.5 μg/kg 3个不同浓度,每个添加水平做6个平行,按照1.5小节方法进行提取净化,3个加标浓度连续做3 d,以考察方法的准确度和精密度,准确度以相对偏差表示,精密度以变异系数(C.V.)表示,计算加标回收率、日内变异系数和日间变异系数。标准溶液、空白样品和加标样品的MRM色谱图见图4~图6,结果如表4所示。目标分析物的准确度均小于15%,日内平均回收率为分别为:金刚烷胺,92.6%~102.0%;金刚乙胺,103.4%~109.5%;美金刚,91.6%~96.6%。日内变异系数分别为:金刚烷胺,4.7%~9.8%;金刚乙胺,2.8%~3.0%;美金刚,1.7%~5.2%。日间平均回收率分别为:金刚烷胺,89.9%~99.1%;金刚乙胺,97.9%~105.5%;美金刚,97.4%~98.8%。日间变异系数分别为:金刚烷胺,2.7%~3.0%;金刚乙胺,3.4%~5.1%;美金刚,3.1%~6.8%。说明该方法具有良好的重复性与稳定性,能够满足鸡蛋样品中金刚烷胺类药物残留分析检测的要求。

表4 加标回收率和精密度
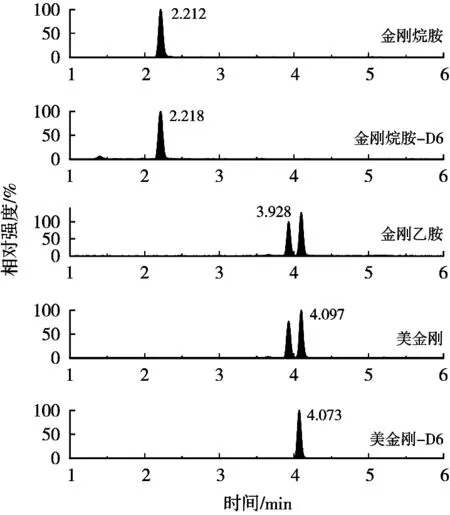
图4 金刚烷胺类药物标准溶液(0.25 μg/L)MRM色谱图
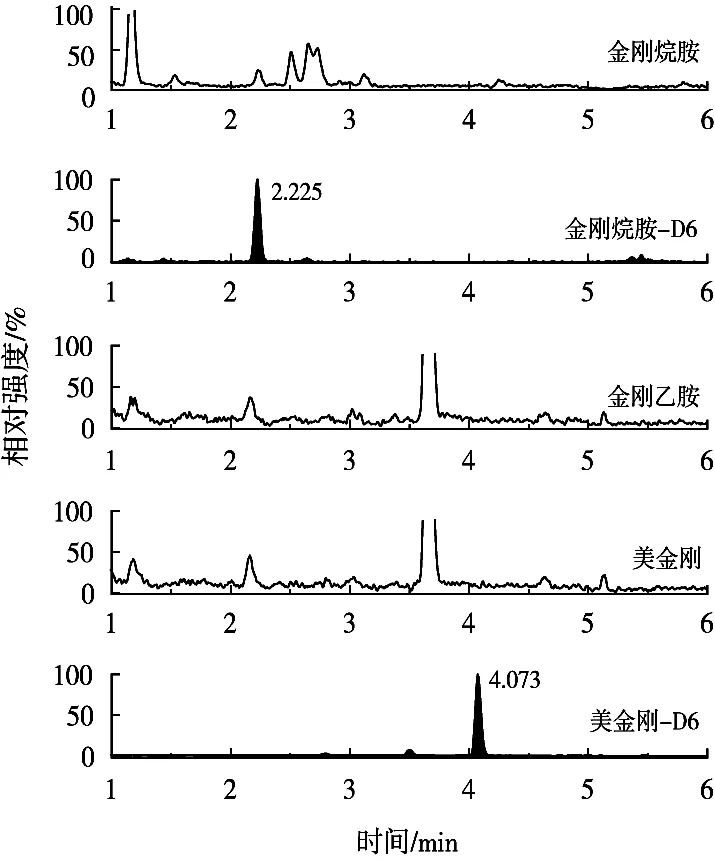
图5 鸡蛋空白样品MRM色谱图
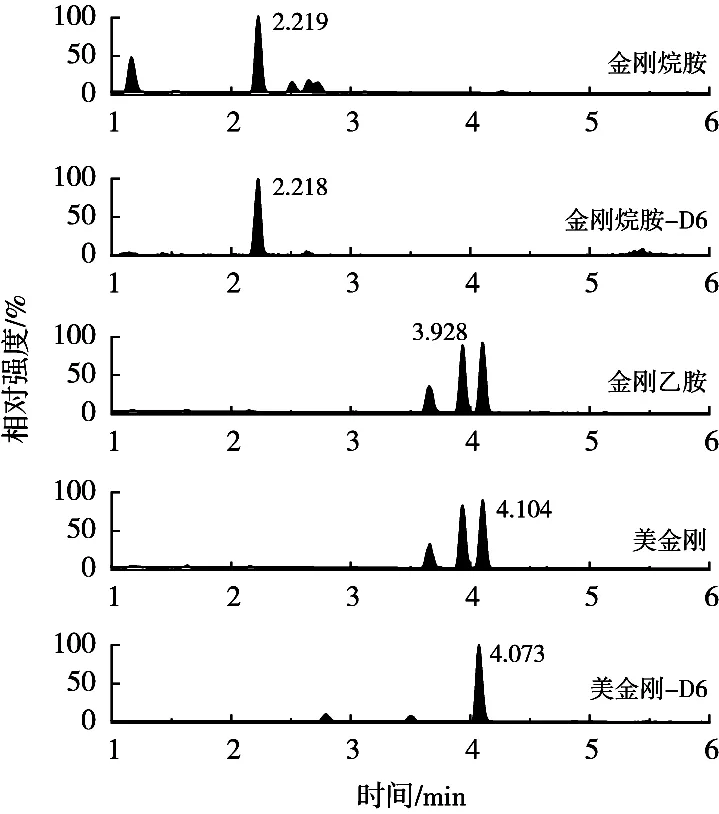
图6 鸡蛋空白样品加标(0.5 μg/kg)MRM色谱图
2.7 方法的应用
选取100批次市售的鸡蛋样品,按此次试验建立的方法进行测定。其中,3个样品检测出金刚烷胺,含量分别为0.925,1.69和28.8 μg/kg,其他两种药物均未检出。
3 讨论与结论
此次试验建立了同时测定鸡蛋中金刚烷胺、金刚乙胺和美金刚残留量的同位素稀释超高效液相色谱-串联质谱法的快速检测方法。以0.1%甲酸乙腈水溶液作为提取剂,用PRiME HLB固相萃取柱净化。结果表明,金刚烷胺类药物在6 min内完成分析,相关系数在0.999 2以上,检出限为0.5 μg/kg,在0.5,1和2 μg/kg 3个添加水平下的准确度均小于15%,3种药物平均回收率在89.9%~109.5%之间,日内(n=6)变异系数在1.7%~9.8%之间,日间(n=3)变异系数在2.7%~6.8%之间。该方法操作简单、回收率高、重现性好,具有良好的准确度和精密度,能够准确定性和定量分析金刚烷胺、金刚乙胺和美金刚,为鸡蛋中金刚烷胺、金刚乙胺和美金刚残留量的检测提供技术支撑,为监管部门及食品安全提供更多的理论依据。

