大动脉炎患者外周血单个核细胞RT-qPCR内参基因的选择
田苡箫,李 菁
(中国医学科学院 北京协和医学院 北京协和医院 风湿免疫科 风湿免疫病学教育部重点实验室国家皮肤与免疫疾病临床医学研究中心, 北京 100032)
反转录实时荧光定量聚合酶链式反应(reverse quantitative real-time polymerase chain reaction,RT-qPCR)是目前分析基因表达水平的黄金标准,却经常表现出重复性欠佳的问题,选取合适的内参基因有助于改善这一情况[1]。大动脉炎(Takayasu arteritis,TAK)是以主动脉及其一级分支受累为主,表现为非特异性慢性肉芽肿性血管炎的系统性疾病。糖皮质激素、免疫抑制剂是治疗TAK的常用药物,这二者均可能导致TAK患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中管家基因表达水平的改变。在用相对定量qPCR分析TAK患者与健康对照(healthy control,HC)人群的基因表达差异时,合适的内参基因有利于得到更稳定、更准确、组间差异更小的结果[1]。
1 材料与方法
1.1 材料
1.1.1 试剂:人淋巴细胞分离液(深圳市达科为生物工程有限公司);Trizol Reagent(Ambion公司);TaKaRa RR047A、引物(苏州金唯智生物科技有限公司,纯化方式为PAGE-Plus);Easy dilution(TaKaRa 9160)、iTaqTMUniversal SYBR® Green Supermix(Bio-Rad公司)。
1.1.2 外周血样本:2019年4月至2019年6月于北京协和医院风湿免疫科门诊纳入TAK患者18例,均符合美国风湿病协会1990年的诊断标准[2],采用1994年NIH标准评估疾病活动性[3],纳入健康对照9人。样本的采集和使用经过北京协和医院伦理委员会的批准(S-478),受试者均签署知情同意书。
1.2 方法
1.2.1 PBMC的分离、RNA的提取和反转录:用无热原的采血针和真空乙二胺四乙酸(EDTA)抗凝管(Becton Dickinson公司)采集肘部静脉血,常温放置,8 h内用密度梯度离心法分离PBMC。用Trizol法从PBMC中提取总RNA,紫外分光光度法检测RNA的浓度和纯度,取A260/A280在1.8~2.1、琼脂糖凝胶电泳可见28 S和18 S条带清晰无弥散、28 S条带亮度约为18 S条带亮度2倍的样本,除去基因组DNA(gDNA)之后进行反转录。
1.2.2 内参基因的选择和引物的检测:9个候选基因的相关信息见“2.3 引物的扩增效率、线性范围和特异性”。以Cq值为纵坐标、以初始模板量的log值为横坐标绘制标准曲线,计算回归系数和扩增效率[扩增效率=(10-1/斜率-1)×100%],确定线性范围。
1.2.3 内参基因的稳定性分析:用geNorm、NormFinder、BestKeeper 3种程序分别对各组[混合组(mixed group,TAK患者+健康对照)、健康对照组(healthy control,HC)、TAK组]候选内参基因的稳定性进行排序,对内参基因进行筛选。
1.2.4 分析结果的检验:以geNorm筛选出的mixed group的基因组合为内参,计算各组(HC组、TAK组、活动性TAK组、非活动性TAK组)PBMC中候选内参基因mRNA的相对含量,并比较组间差异。
以T-bet、GATA3和RORC为目的基因,分别以稳定性不同的基因为内参,分析目的基因mRNA的组间差异,并与文献报道作比较。
1.3 统计学分析

2 结果
2.1 TAK患者的实验室参数和临床特征
TAK患者的实验室参数和临床特征见表 1。健康对照组(HC)纳入9人(1名男性,8名女性)。
2.2 RNA样本的纯度与完整性
RNA样本的A260/A280均在1.8~2.1,A230不低于1.7,琼脂糖凝胶电泳可见电泳可见28 S、18 S条带清晰无弥散,28 S条带亮度约为18 S条带亮度的2倍。
2.3 引物的扩增效率、线性范围和特异性
引物的序列、扩增效率、线性范围、标准曲线等信息见表2。融解曲线均为单峰。
2.4 基因表达的稳定性分析
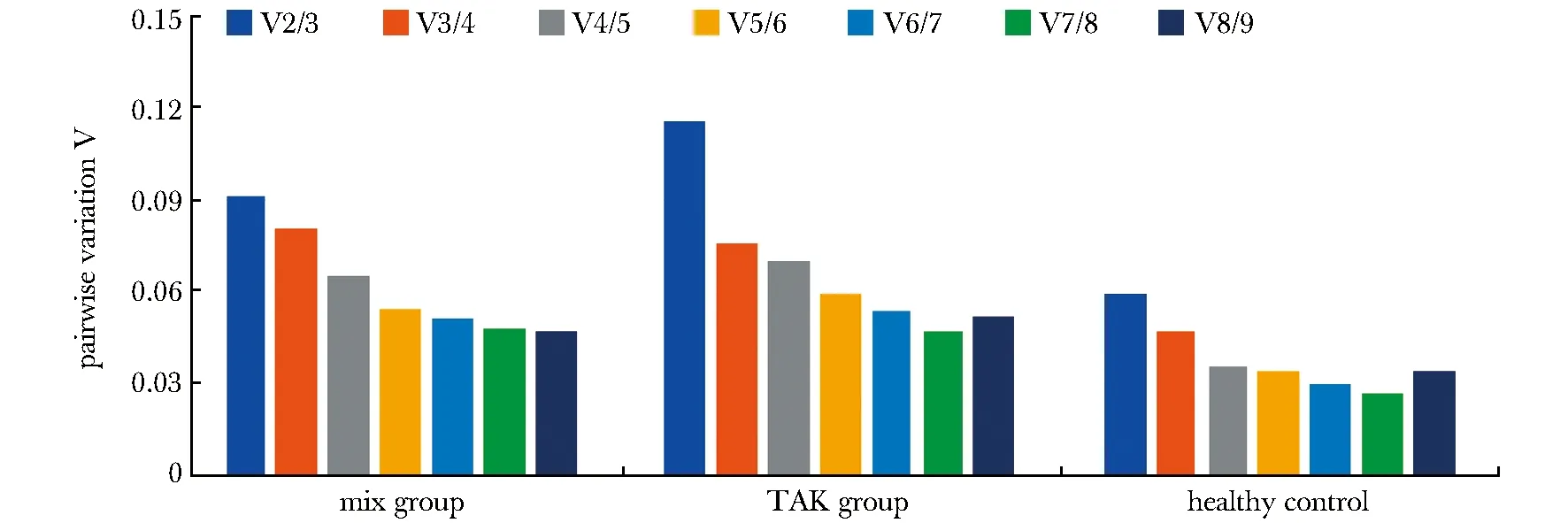
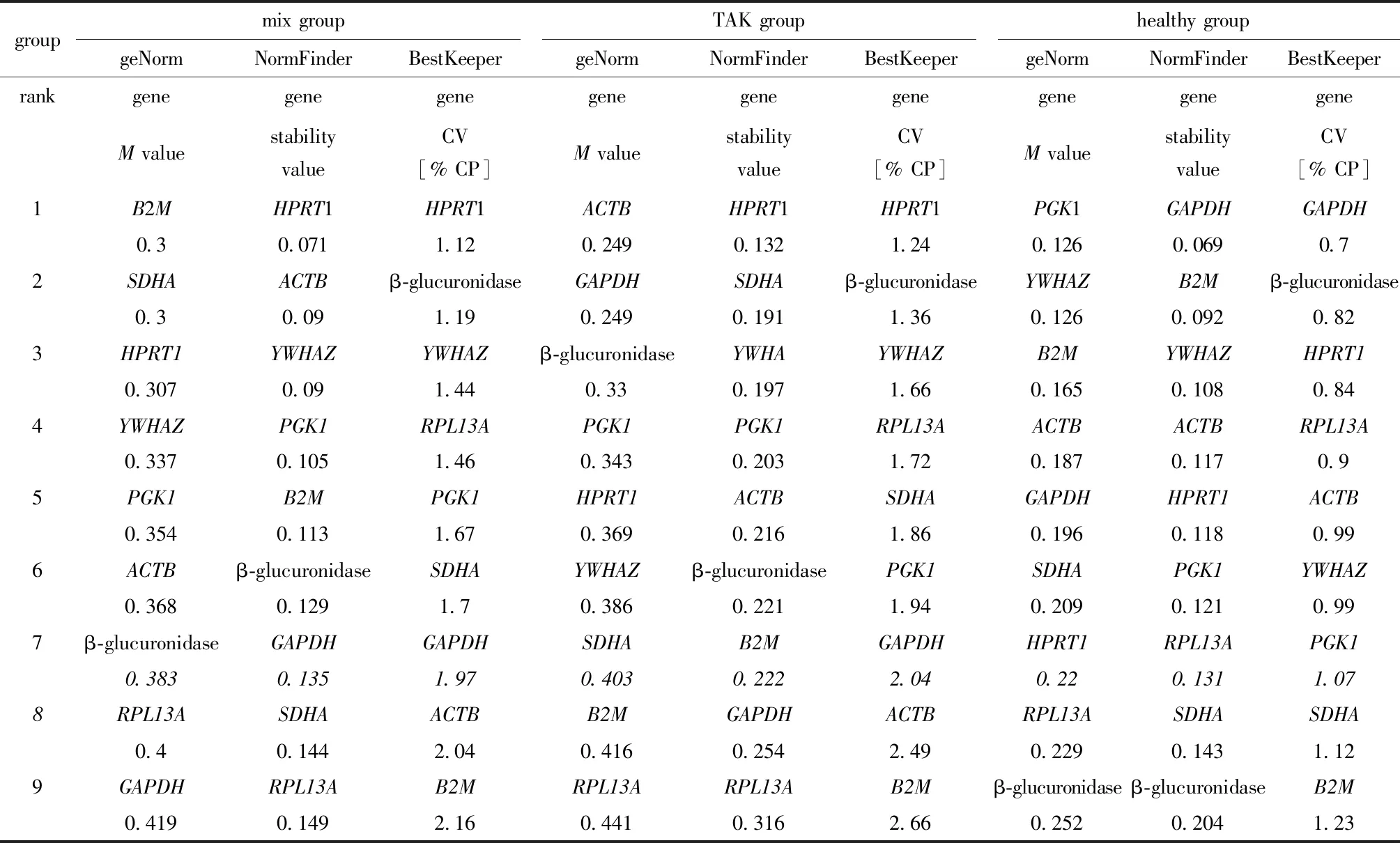
用geNorm[4]、NormFinder[5]、BestKeeper[6]这3种计算方法对9个基因的表达稳定性的分析结果如所示。用geNorm分析时,混合组PBMC的各候选内参基因的M值均小于1.5,稳定性为GAPDH(0.419) 表1 入组TAK患者的实验室参数和临床特征Table 1 Laboratory parameters and clinical features of patients with M(Q1,Q3)] 表2 RT-qPCR引物相关信息Table 2 Details of the primers used for RT-qPCR Pairwise variation (Vn/n+1) analysis was used to determine the optimal number of reference genes required for RT-qPCR normalization in different panels图1 geNorm 计算的成对变异 Vn/n+1值Fig 1 Pairwise variation (Vn/n+1) calculated by geNorm 表3 按照geNorm、NormFinder或BestKeeper的计算结果对候选基因稳定性排序Table 3 Reference genes were ranked in order of their stability calculated by geNorm, NormFinder or BestKeeper A.histogram of the expression levels of 9 candidate reference genes in 4 panels, normalized to the geometric mean of Cq value of B2M and SDHA; B.intra-group variation and inter-group variation of candidate reference genes calculated by NormFinder; C.the relative expression levels of 3 target genes (T-bet, GATA3 and RORC) in 4 panels, respectively normalized to the geometric mean of Cq value of B2M and SDHA, HPRT1 and GAPDH;TAK.takayasu arteritis, n=18;control.healthy control, n=9;active TAK, n=10; nonactive TAK, n=8;*P<0.05,**P<0.01,***P<0.001 compared with control; #P<0.05, ##P<0.01 compared with nonactive TAK图2 内参基因的表达稳定性对相对定量的影响Fig 2 Effect of stability of reference gene expression on relative quantification 分别以B2M-SDHA组合(geNorm所筛选)、HPRT1(NormFinder和BestKeeper所筛选)以及GAPDH(3种方法均显示稳定性略低的基因)为内参,比较TAK组、对照组、活动组、非活动组的PBMC中T-bet、GATA3和RORC的mRNA含量(图 2C)。 当采用相对定量qPCR进行基因表达差异分析时,选择合适的内参基因有助于得出更稳定、更准确、组内变异更小的结果。本研究中,以B2M-SDHA组合和HPRT1作为内参基因时,各组间差异的趋势几乎一致,但是以B2M-SDHA组合作为内参基因时,统计学有显著差异且组内差异更小;以GAPDH作为内参基因时,分析结果与前二者差异较大,这可能是因为TAK组PBMC中GAPDH较HC组显著上调。多项研究显示,不同亚型的T细胞对糖皮质激素的反应不同。糖皮质激素促进Th1细胞的凋亡、并抑制Th0细胞向Th1细胞分化,但是Th2和Th17细胞对糖皮质激素诱导的细胞凋亡具有抗性[7],这可能与Bcl-2[8]、P-糖蛋白[9]等因子的作用有关。综上所述,以B2M-SDHA组合作为内参基因测得的结果与文献报道更为一致。 有些候选内参基因的mRNA水平存在显著的组间统计学差异,这可能与疾病状态或药物治疗有关。例如,GAPDH是糖酵解中发挥重要作用的酶,它催化3-磷酸甘油醛氧化脱氢和磷酸化,生成1, 3-二磷酸甘油酸,因此,当细胞的糖代谢受到明显影响时,GAPDH的表达水平可能会发生变化;同时,它还具有多种功能,如DNA修复[10]、膜融合和膜转运、转铁蛋白受体、催化微管聚合[11],提示GAPDH可能受较多因素影响。此外,β-肌动蛋白基因(β-actin,即ACTB)编码细胞骨架蛋白,因此其表达水平与淋巴细胞增殖的活跃程度有关,这可能是TAK患者PBMC中ACTB较健康对照组上调的原因之一。此外,SDHA、RPL13A、B2M在活动组与非活动组之间存在较小的统计学差异,提示这三种基因编码的蛋白质可能与疾病活动性或药物治疗关联较小。 本项研究显示,自身免疫病患者或接受免疫抑制药物治疗时,原本在健康人群中稳定表达的基因可能会上调或下调,从而干扰相对定量的结果。因此,在自身免疫病研究中选择内参基因时,需要进行筛选;同时选用初治和经治患者为研究对象有助于确定可靠的内参基因。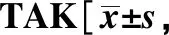


3 讨论

