糖类对冬虫夏草菌Ophiocordyceps sinensis芽生孢子产量及毒力的影响
梁 焱,吴 华,韩日畴,曹 莉*
(1. 仲恺农业工程学院,广州 510225; 2. 广东省科学院动物研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
冬虫夏草是冬虫夏草菌侵染寄主昆虫-蝙蝠蛾科Hepialidae幼虫,在合适环境下形成的幼虫尸体与真菌子座的复合形态结构(Sungetal.,2007;Loetal.,2013)。由于良好的药理药效作用,冬虫夏草被称为“中药三大宝”(人参、鹿茸和冬虫夏草)之一(Loetal.,2013;Gaoetal.,2014;Liuetal.,2015;丘雪红等,2016;Zhangetal.,2017;Chenetal.,2018;韩日畴等,2019)。冬虫夏草主要产于海拔3 000 m以上的青藏高原(Yietal.,2011),生长周期长,生存条件恶劣,因此,野生资源极为有限(陈仕江等,2001)。随着“亚健康”人群的扩大,冬虫夏草日益受到人们的青睐;而过度采挖和气候变暖导致野生冬虫夏草处于濒危(Zhangetal.,2012;Lietal.,2016;Hoppingetal.,2018)。唯一选择是进行冬虫夏草人工培育(Xiaetal.,2016;丘雪红等,2016;韩日畴等,2019)。
冬虫夏草菌是一种嗜低温真菌(Dongetal.,2011;Dongetal.,2012),其寄主蝙蝠蛾昆虫野外完成其生活史需要3~4年,实验室培育也需要1~2年(徐海峰,2007;Taoetal.,2016;Lietal.,2020)。经过数十年的努力,冬虫夏草的人工栽培取得重大突破,包括冬虫夏草菌子实体的人工培育(Caoetal.,2015)、蝙蝠蛾昆虫低海拔规模化人工饲养(曹莉和韩日畴,2014;Taoetal.,2016;Lietal.,2019)以及利用冬虫夏草菌感染蝙蝠蛾幼虫获得媲美野生的冬虫夏草(张姝等,2013;Zhaoetal.,2014;Xiaoetal.,2018;韩日畴等,2019;Lietal.,2020)。目前,冬虫夏草菌的芽生孢子和子囊孢子均用于感染蝙蝠蛾幼虫获得冬虫夏草,芽生孢子用于注射感染(曹莉等,2019;Liuetal.,2020),子囊孢子用于体表感染(杨大荣等,1986;韩晓然,2020)。在实践中,两种感染方法各有优缺点。注射感染时,需要获得大量对蝙蝠蛾幼虫具有高侵染力的芽生孢子(Liuetal.,2020)。
为了获得高质量的冬虫夏草芽生孢子,本研究中比较了不同糖类培养基对冬虫夏草菌芽生孢子产量以及芽生孢子对蝠蛾幼虫存活率、携菌率和僵虫率的影响,为在低海拔地区人工栽培冬虫夏草提供重要参考。
1 材料与方法
1.1 冬虫夏草菌培养
冬虫夏草菌菌株KD(分离自四川康定)和QH(分离自青海玉树),经分子鉴定后(Caoetal.,2015)保存于广东省科学院动物研究所(原广东省生物资源应用研究所)。培养基成分如下:糖20 g,马铃薯200 g煮汁,蛋白胨10 g,大蜡螟鲜幼虫5 g(以人工培养基饲养),磷酸二氢钾3 g,七水合硫酸镁1.5 g,维生素B10.02 g,以水定容至1 000 mL。配制好的培养基分装至250 mL的三角瓶中,150 mL/瓶,并于121℃高压灭菌30 min,冷却后使用。本实验使用的糖类包括葡萄糖、果糖、阿拉伯糖、麦芽糖、蔗糖和海藻糖,均为分析纯,购自广州市普博仪器有限公司。
于超净工作台中,将9~13℃下固体G5培养基(葡萄糖20 g,马铃薯200 g煮汁,蛋白胨10 g,大蜡螟鲜幼虫5 g(以人工培养基饲养),磷酸二氢钾3 g,七水合硫酸镁1.5 g,维生素B10.02 g,琼脂16 g,以水定容至1 000 mL。)培养60 d的冬虫夏草菌块(约1 cm3)接种于上述液体培养基中,置于110 rpm、9~13℃摇床上培养50 d,收集芽生孢子作为接种源。培养的菌液以三层无菌擦镜纸过滤,收集滤液离心(8 000 rpm,10℃,15 min),弃上清液,重悬于无菌磷酸盐缓冲液(PBS,pH7.0)中。将收集的芽生孢子液稀释至1.5×106个/mL,每瓶150 mL培养基中分别接入1 mL 1.5×106个/mL芽生孢子液,置于110 rpm、9~13℃摇床黑暗条件下培养。每隔10 d,分别从培养瓶中取样0.3 mL,摇匀后取10 μL添加到等体积的荧光28染色剂(Sigma公司,上海)中对冬虫夏草菌菌丝及芽生孢子进行染色,在荧光显微镜(Nikon,日本)下对芽生孢子进行观察与计数。每个处理设置3个重复,持续观察至60 d。
1.2 蝙蝠蛾幼虫的饲养
实验所用的小金蝠蛾6龄幼虫 YL和GG品系于广东省科学院动物研究所实验室饲养,饲养方法按照(Taoetal.,2015),6龄幼虫用于注射感染。
1.3 蝠蛾幼虫的侵染
以无菌PBS缓冲溶液稀释收集得到的芽生孢子浓度为106个/mL。注射感染蝙蝠蛾幼虫的方法按照(曹莉等,2019;Liuetal.,2020)。利用微量注射器(针头直径0.06 mm)分别对小金蝠蛾6龄幼虫YL和GG品系进行注射感染,每头幼虫注射4 μL芽生孢子(芽生孢子数量为106个/mL)。注射后的蝙蝠蛾幼虫分别置于10℃、14℃或18℃中培养。每个处理设60头幼虫,3个重复(共180头)。于30 d观察和记录幼虫存活率、于60 d观察和记录幼虫存活率和幼虫僵虫率。
分别取注射后30 d的幼虫血淋巴经荧光28染色剂染色后,于显微镜下观察血淋巴中是否出现芽生孢子,并计算幼虫携菌率。
1.4 统计与分析
数据以平均值±标准误(X±SE)表示。使用SPSS软件(IBM Statistics SPSS 25.0)分析。符合正态分布(Normality Plots with Tests)和方差齐性(Test of Homogeneity of Variances)的数据进行单因素方差分析(One Way ANOVA);若方差存在显著差异,则采用Tukey法进行多重比较。对于不符合上述条件的数据则进行非参数检验(Kruskal-Wallis test followed by the Mann-Whitney U test检验)。显著水平设置为P=0.05。
2 结果与分析
2.1 糖类对冬虫夏草菌芽生孢子产量的影响
加入不同糖类的培养基中,冬虫夏草菌(KD、QH菌株)在不同培养时间的芽生孢子产量不同(图1、图2)。含麦芽糖培养基中芽生孢子产量显著高于其它糖类,果糖的产量最低;最佳产量处于培养时间30~40 d;其生长曲线大致分为3个阶段:0~15 d的缓慢生长阶段,15~35 d的指数生长阶段,35~60 d的缓慢下降生长阶段。

图1 冬虫夏草菌(KD菌株)9~13℃下于不同含糖培养基中芽生孢子生长曲线Fig.1 Growth curve of blastospores of Ophiocordyceps sinensis (KD) in the media containing different sugars at 9~13℃

图2 冬虫夏草菌(QH菌株)9~13℃下于不同含糖培养基中芽生孢子生长曲线Fig.2 Growth curve of blastospores of Ophiocordyceps sinensis (QH) in the media containing different sugars at 9~13℃
含糖不同的培养基中芽生孢子在30 d时的产量差异显著(F11,24=414.719,P=0.000)(图3)。KD菌株在不同培养基中的芽生孢子产量均显著高于QH菌株;不论是在KD或QH菌株中,含麦芽糖培养基中芽生孢子产量均显著高于其它糖类;对于KD菌株,含阿拉伯糖和葡萄糖的培养基中芽生孢子产量无显著差异,但显著高于含果糖、蔗糖和海藻糖培养基中的孢子产量;含海藻糖培养基中收获的芽生孢子数量显著高于含果糖和蔗糖培养基的,蔗糖和果糖间差异不显著。对于QH菌株,含阿拉伯糖培养基中芽生孢子产量显著高于含葡萄糖、果糖、蔗糖、海藻糖培养基的;含葡萄糖、果糖、蔗糖或海藻糖培养基中芽生孢子数量差异不显著。因此,麦芽糖是支持冬虫夏草菌芽生孢子生长的最优糖源;KD菌株芽生孢子在不同培养基中的产量均高于QH菌株。

图3 两种冬虫夏草菌株(KD和QH)9~13℃下于不同糖类培养基中30 d的芽生孢子产量Fig.3 Yields of Ophiocordyceps sinensis blastospores(KD and QH)in the media containing different sugars at 30 d at 9~13℃注:柱子上面不同字母表示处理间芽生孢子产量在5%水平差异显著,下同。 Note:Columns with different letters indicate significant differences at 5% level among the yields of blastospores. The same as below.
2.2 不同糖培养基培养30 d的冬虫夏草菌芽生孢子对注射后的小金蝠蛾幼虫存活率、携菌率及僵虫率的影响
含不同糖培养基培养30 d的芽生孢子(KD、QH菌株)以106个/mL浓度注射小金蝠蛾幼虫的两个品系,被注射幼虫置于10℃下饲养30 d的存活率、携菌率,60 d的僵虫率见图4~6(KD、QH菌株的含果糖培养基及QH菌株的含葡萄糖、蔗糖培养基培养30 d达不到注射浓度)。含不同糖培养基培养30 d的芽生孢子(KD菌株)注射后幼虫的存活率(图4-A)不存在显著差异(F9,20=0.966,P=0.495),而QH菌株(图4-B)的存活率存在显著差异(F5,12=4.089,P=0.021),海藻糖的YL品系幼虫存活率显著低于阿拉伯糖、麦芽糖(YL和GG品系)及海藻糖GG品系的。其携菌率均存在显著差异(KD菌株,图5-A:H=19.483,P=0.021; QH菌株,图5-B:H=11.940,P=0.036),KD菌株含麦芽糖培养基(YL及GG品系幼虫)和含海藻糖培养基的YL品系幼虫携菌率达到100%,而QH菌株仅有含麦芽糖培养基的GG品系幼虫携菌率达到100%。其僵虫率均存在显著差异(KD菌株,图6-A:F9,20=7.711,P=0.000; QH菌株,图6-B:F5,12=4.160,P=0.020)。
2.3 不同糖培养基培养45 d的冬虫夏草菌芽生孢子对注射后的小金蝠蛾幼虫存活率、携菌率及僵虫率的影响
含不同糖培养基培养45 d的芽生孢子(KD、QH菌株)以106个/mL浓度注射两个品系的小金蝠蛾幼虫,被注射幼虫置于10℃下饲养30 d的存活率、携菌率,60 d的僵虫率见图7~图9。含不同糖培养基培养30 d的芽生孢子(KD、QH菌株)注射后幼虫的存活率(图7-A、图7-B)均不存在显著差异(KD菌株:H=15.328,P=0.168;QH菌株:F11,24=1.695,P=0.135)。其携菌率(图8-A、图8-B)也不存在显著差异(KD菌株:H=14.842,P=0.190; QH菌株:H=18.868,P=0.063)。KD菌株的僵虫率(图9-A)也不存在显著差异(H=12.751,P=0.310),而QH菌株(图9-B)的僵虫率存在显著差异(H=21.870,P=0.025)。

图4 不同糖培养基培养30 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)存活率的影响Fig.4 Survival rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 30 days

图5 不同糖培养基培养30 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)携菌率的影响Fig.5 Fungal retention rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 30 days
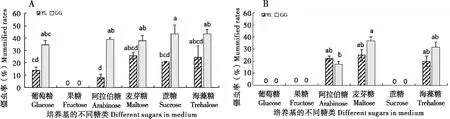
图6 不同糖培养基培养30 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)僵虫率的影响Fig.6 Mummified rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 30 days

图7 不同糖培养基培养45 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)存活率的影响Fig.7 Survival rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 45 days

图8 不同糖培养基培养45 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)携菌率的影响Fig.8 Fungal retention rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 45 days

图9 不同糖培养基培养45 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)僵虫率的影响Fig.9 Mummified rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 45 days
2.4 不同糖培养基培养60 d的冬虫夏草菌芽生孢子对注射后的小金蝠蛾幼虫存活率、携菌率及僵虫率的影响
含不同糖培养基培养60 d的芽生孢子(KD、QH菌株)以106个/mL浓度注射两个品系的小金蝠蛾幼虫,被注射幼虫置于10℃下饲养30 d的存活率、携菌率,60 d的僵虫率见图10~图12(QH菌株的含阿拉伯糖培养基培养60 d所剩芽生孢子不够注射使用量)。含不同糖培养基培养60 d的芽生孢子(KD、QH菌株)注射后幼虫的存活率(图10-A、图10-B)均不存在显著差异(KD菌株:F11,24=2.091,P=0.063;QH菌株:H=15.403,P=0.080)。KD菌株的携菌率(图11-A)存在显著差异(KD菌株:H=23.589,P=0.015),其中YL品系幼虫中麦芽糖、蔗糖和海藻糖的携菌率达到100%,GG品系幼虫中果糖、阿拉伯糖和麦芽糖的携菌率达到100%。而QH菌株含不同糖培养基的携菌率(图11-B)差异不显著(H=13.677,P=0.134)。其僵虫率均存在显著差异(KD菌株,图12-A:H=25.545,P=0.008;QH菌株,图12-B:H=23.587,P=0.005)。

图10 不同糖培养基培养60 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)存活率的影响Fig.10 Survival rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 60 days

图11 不同糖培养基培养60 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)携菌率的影响Fig.11 Fungal retention rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 60 days

图12 不同糖培养基培养60 d的冬虫夏草菌KD(A)、QH(B)芽生孢子对注射后的小金蝠蛾幼虫(YL、GG品系)僵虫率的影响Fig.12 Mummified rates of the Thitarodes xiaojinensis (YL and GG) larvae challenged with Ophiocordyceps sinensis (KD and QH) blastospores from the media containing different sugars after 60 days
2.5 含麦芽糖培养基培养的冬虫夏草菌对蝙蝠蛾幼虫存活率的影响
含麦芽糖培养基培养不同时间的芽生孢子(KD和QH菌株)以106个/mL浓度注射小金蝠蛾幼虫的两个品系,被注射幼虫置于10℃、14℃和18℃下饲养30 d的存活率见表1。在同一温度下,无论是注射培养30 d、45 d、60 d的KD还是QH菌株,两个蝙蝠蛾品系的幼虫于30 d的存活率均无显著差异(表1),即30 d:(10℃,F3,8=0.966,P=0.454;14℃,F3,8=1.109,P=0.401;18℃,F3,8=1.594,P=0.266)、45 d:(10℃,F3,8=0.664,P=0.597;14℃,F3,8=2.446,P=0.139;18℃,F3,8=1.411,P=0.309)、60 d:(10℃,F3,8=0.401,P=0.756;14℃,F3,8=3.612,P=0.065;18℃,F3,8=1.618,P=0.260)。在其它条件相同下,不同温度间的蝙蝠蛾幼虫于30 d后的存活率部分存在显著差异(表2)。10℃下的蝙蝠蛾幼虫存活率优于14℃、18℃的;不同芽生孢子培养时间对注射后的蝙蝠蛾幼虫在10℃、14℃、18℃下于30 d的存活率存在差异(10℃:F2,33=9.820,P=0.000;14℃:F2,33=12.793,P=0.000;18℃:F2,33=26.403,P=0.000),30 d的芽生孢子培养时间对注射后的蝙蝠蛾幼虫存活率显著优于60 d的。因此,不同冬虫夏草菌株未显著影响在相同饲养温度下的两种小金蝠蛾品系的存活率;但不同饲养温度或不同芽生孢子的收获时间显著影响两种小金蝠蛾幼虫的存活率。

表1 含麦芽糖培养基培养30 d、45 d、60 d的冬虫夏草菌(KD和QH菌株)注射小金蝠蛾幼虫(YL和GG品系)在不同温度下的存活率
2.6 含麦芽糖培养基培养的冬虫夏草菌对蝙蝠蛾幼虫僵虫率的影响
结果分析表明含麦芽糖的冬虫夏草菌(KD、QH)注射蝙蝠蛾幼虫(YL和GG)在10℃的僵虫率显著高于14℃、18℃(表3),14℃和18℃下所有幼虫的僵虫率为0。不同时间收获的冬虫夏草菌(KD菌株)芽生孢子注射的小金蝠蛾幼虫的僵虫率间存在显著差异(F5,12=6.340,P=0.004)(图13);培养30 d的冬虫夏草菌(KD)芽生孢子注射的小金蝠蛾幼虫YL品系的僵虫率与培养60 d的芽生孢子无显著差异,但培养30 d的芽生孢子注射的小金蝠蛾幼虫GG品系的僵虫率显著高于培养60 d芽生孢子的;而培养30 d和45 d的芽生孢子注射的两种小金蝠蛾幼虫品系的僵虫率之间未见显著差异(图13)。

表2 含麦芽糖培养基培养30 d、45 d、60 d的冬虫夏草菌(KD和QH菌株)注射小金蝠蛾幼虫(YL和GG品系)在不同温度下的存活率方差分析结果
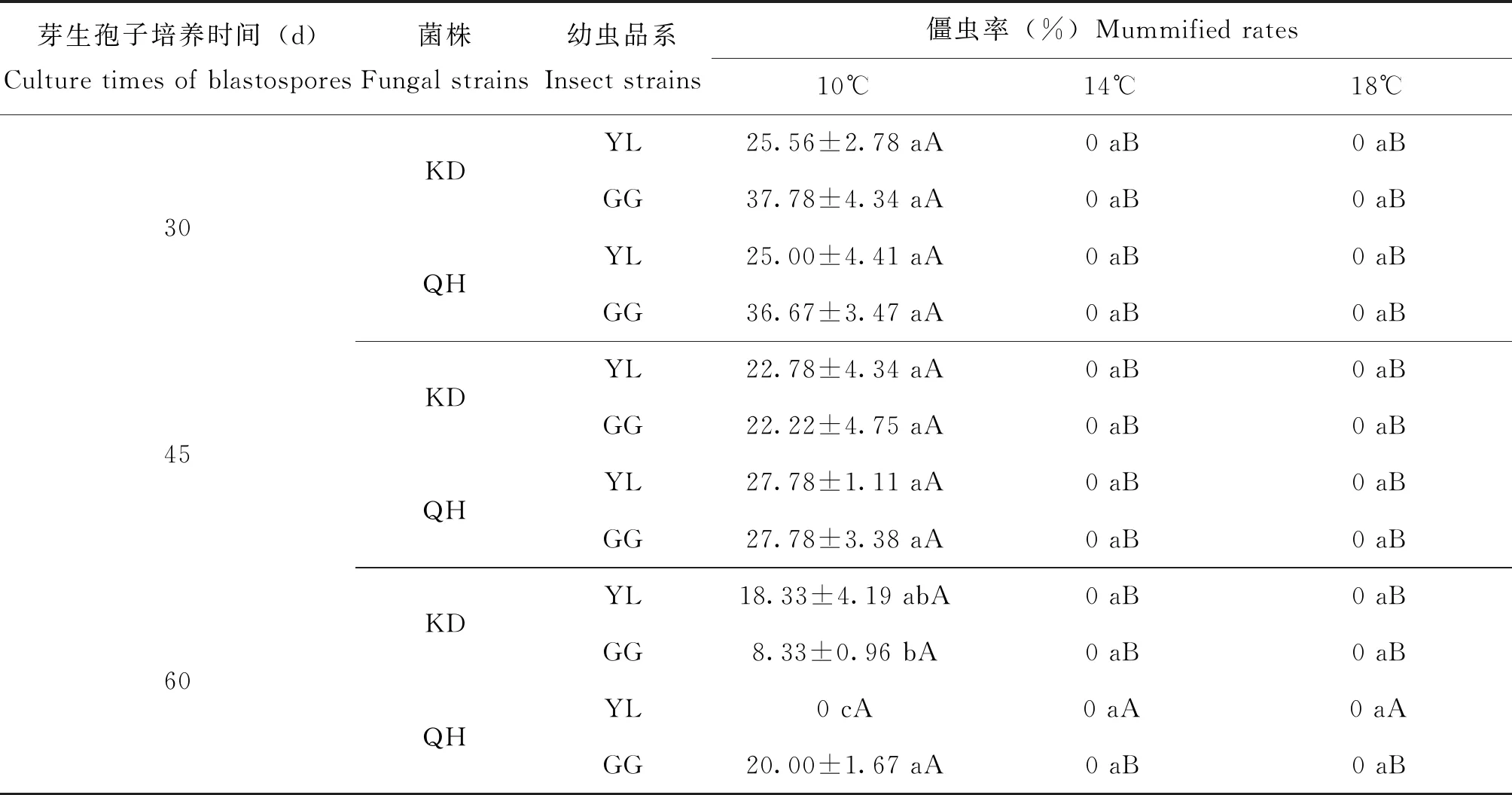
表3 小金蝠蛾幼虫(YL和GG品系)被注射麦芽糖培养基培养30 d、45 d、60 d的冬虫夏草菌(KD和QH菌株)芽生孢子后于10℃、14℃、18℃下60 d的僵虫率

图13 小金蝠蛾幼虫(YL和GG品系)被注射麦芽糖培养基培养30 d、45 d、60 d的冬虫夏草菌(KD菌株)芽生孢子后于10℃下60 d的僵虫率Fig.13 Mummified rates of the Thitarodes xiaojinensis (YL and GG) larvae at 60 days at 10℃ after challenged with 30 d、45 d and 60 d old Ophiocordyceps sinensis (KD) blastospores cultured with the medium containing maltose
3 结论与讨论
冬虫夏草菌是寄生于蝙蝠蛾科昆虫幼虫上的一种药用真菌(刘丽娟等,2004;董彩虹等,2016)。冬虫夏草菌入侵其寄主蝠蛾幼虫的相关机制尚未明了(Mengetal.,2015;Raoetal.,2019)。体表、针刺、涂抹、喂食、浸泡、喷雾等方法常用于感染蝙蝠蛾幼虫(杨大荣等,1986;王忠等,2001;廖志勇,2005;涂永勤等,2010a),但是仍存在携菌率低、死亡率高及僵虫率低等问题(韩日畴等,2019)。Liu等(2020)采用微注射芽生孢子感染蝙蝠蛾幼虫的方法,极大地提高了幼虫携菌率。
不同真菌所需的最佳糖源不同,如蛹虫草Cordycepsmilitaris的最佳糖源为蔗糖(杨心如等,2019;杨婷婷,2019);双孢蘑菇Agaricusbisporus的最佳糖源为麦芽糖(张倢,2016);刘永霞(2004)认为冬虫夏草菌菌丝生长的最佳糖源为葡萄糖;王爽等(2013)研究表明葡萄糖或麦芽糖对球孢白僵菌Beauveriabassiana的生长和产孢明显优于其它糖源。赵秀芳(2005)认为白灵菇Pleurotusnebrodensis菌丝生长的最适糖源是麦芽糖和蔗糖,而牛宇等(2019)表明白灵菇菌丝生长的最佳糖源为葡萄糖、麦芽糖,以甘露醇和可溶性淀粉为糖源时发酵液中获得的菌丝干重最大。本次研究结果显示含不同糖类的培养基对冬虫夏草菌芽生孢子产量存在显著差异,其中麦芽糖为最优糖源;然而,芽生孢子生长对糖类的最优选择并不等于子实体生长的糖选择,含葡萄糖的大米小麦培养基中冬虫夏草子实体的生长速率和干重明显优于含麦芽糖培养基的(陶海平等,2020)。
王忠等(2001)表明蝙蝠蛾幼虫的饲养温度应该控制在6~12℃,而王宏生(2002)则认为蝙蝠蛾幼虫的最佳饲养温度为10~15℃。被冬虫夏草菌感染后的蝙蝠蛾幼虫,在不同的温度、湿度和不同的光照条件下,其子实体形成也存在差异(李少松,2009;涂永勤等,2010b)。曹莉等(2019)研究表明,4℃左右低温可以刺激被冬虫夏草菌感染后的蝙蝠蛾幼虫子实体形成。本实验发现10℃较14℃、18℃适合小金蝠蛾幼虫的生存,而高温大大降低小金蝠蛾幼虫的僵虫率,甚至导致其死亡率升高。需要指出,本研究主要是测定不同参数培养的冬虫夏草芽生孢子对小金蝠蛾存活率和僵虫率的影响,所获结果显示注射不同冬虫夏草菌株未显著影响在相同饲养温度下的两种小金蝠蛾品系的存活率和僵虫率,不同饲养温度或不同芽生孢子的收获时间显著影响两种小金蝠蛾幼虫的存活率和僵虫率,但是获得的蝙蝠蛾幼虫存活率和僵虫率并非最优。
本实验中注射分离自四川和青海的冬虫夏草菌株均未显著影响在相同饲养温度下的小金蝠蛾两个品系的存活率,说明菌株和寄主昆虫之间未必存在明显的专化性,但需要在今后的研究中进一步验证。不同芽生孢子的收获时间显著影响小金蝠蛾两个品系幼虫的存活率和僵虫率,具体原因仍有待研究。目前未见有不同时间收获的冬虫夏草菌芽生孢子注射蝙蝠蛾幼虫的报道。不同糖代谢过程形成的芽生孢子显著影响其与寄主昆虫相关作用的机理值得进一步研究。本实验的幼虫存活率比较低,可能与注射的幼虫龄期有关。结果发现,培养30~45 d的冬虫夏草菌收集的芽生孢子为注射感染小金蝠蛾幼虫的最佳芽生孢子,而培养60 d的冬虫夏草菌芽生孢子似乎老化,有可能降低僵虫率。
本研究结果为培养优质冬虫夏草芽生孢子,提高被侵染蝙蝠蛾幼虫存活率、携菌率和僵虫率提供了参考。

