GATA4基因甲基化及GATA4对非小细胞肺癌生长的影响及其作用机制
夏宇曾敏贾斌孙峰刘雪梅王海月
作者单位:830054 乌鲁木齐 1新疆医科大学第一附属医院呼吸与呼吸危重症中心二病区;830011 乌鲁木齐 2新疆医科大学附属肿瘤医院胸腹放疗科
肺癌发病率和死亡率在全球癌症中分别居第2位和第 1位[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的75%以上,多数NSCLC患者确诊时已属晚期,预后较差[2]。有研究显示DNA甲基化与肺癌发生风险相关[3]。GATA4是锌指转录因子家族成员之一,其活性受翻译后修饰调控,包括磷酸化、乙酰化、甲基化和类泛素化修饰[4]。在卵巢癌中,GATA4常因启动子异常甲基化而被沉默[5]。也有研究显示GATA4在NSCLC细胞中呈甲基化状态,CD40配体通过促进GATA4去甲基化,上调GATA4表达,介导NSCLC细胞DNA损伤反应并促进细胞衰老[6]。但是目前GATA4在NSCLC中的作用及其机制尚不明确。本研究探讨GATA4在NSCLC组织中的甲基化状态及其对NSCLC细胞生长的影响和可能的调控机制,以期明确GATA4在NSCLC中的作用,为阐明NSCLC发病机制及开发新的临床治疗靶点提供依据。
1 材料和方法
1.1 组织标本
收集2017年7月—2018年6月于新疆医科大学第一附属医院接受肺癌根治术的78例NSCLC患者癌组织及其癌旁组织。年龄34~77岁,平均年龄(57.7±12.9)岁,其中男性56例;肺腺癌 46例,肺鳞状细胞癌32例。纳入标准:⑴经组织病理学诊断为NSCLC;⑵顺利行肺癌根治术;⑶术前未接受放疗、化疗、生物疗法等抗癌治疗。排除标准:⑴合并其他恶性肿瘤者;⑵合并严重心、肝、肾等重要脏器功能损伤或其他严重基础疾病者。本研究经新疆医科大学第一附属医院伦理委员会审批通过,患者知情同意并签署知情同意书。
1.2 主要材料
人肺癌细胞株 A549、HCC827、NCI-H1299 和人正常肺上皮细胞BEAS-2B购自中国科学院典型培养物保藏委员会细胞库,用含10%FBS的RPMI 1640培养基,于37℃、5%CO2培养箱中培养。血液、细胞、组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;DNA重亚硫酸盐转化试剂盒购自英国沃特曼;GATA4、p-ERK、ERK和p38抗体购自英国Abcam公司;p-p38抗体购自美国Cell Signaling Technology公司;GAPDH抗体购自武汉三鹰生物技术有限公司;GATA4干扰(sh-GATA4-1和sh-GATA4-2)及其阴性对照(sh-NC)、GATA4过表达载体(pLV-GATA4)及其空载体对照的慢病毒液(pLV-NC)购自武汉金开瑞生物工程有限公司;CCK-8检测试剂盒购自美国MedChem Express公司;Annexin V-FITC/PI荧光双染细胞凋亡检测试剂盒购自武汉普诺赛生命科技有限公司。
1.3 MSP检测组织和细胞GATA4基因甲基化状态
按照DNA提取试剂盒说明书提取各组细胞和组织中的总DNA,并测定DNA浓度及纯度。参照DNA重亚硫酸盐转化试剂盒说明书的操作步骤进行DNA重亚硫酸盐转化及DNA纯化。根据GATA4基因序列信息,利用Methyl Primer Express v1.0软件设计GATA4基因的甲基化引物和去甲基化引物然后进行PCR反应。甲基化上游引物为5′-GTATAGTTTCGTAGTTTGCGTTTAGC-3′,下游引物为 5′-AACTCGCGACTCGAATCCCCG-3′;去甲基化上游引物为 5′-TTTGTATAGTTTTGTAGTTTGTGTTTAGT-3′,下游引物为 5′-CCCAACTCACAACTCAAATCCCCA-3′。PCR扩增条件:95℃3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共 40个循环;72 ℃10 min。反应结束后,PCR产物用2%琼脂糖凝胶进行电泳检测。PCR产物大小为140 bp。
1.4 qMSP检测组织中GATA4基因甲基化程度
参考文献[7],应用qMSP检测组织中GATA4基因甲基化程度。按照步骤1.3进行组织DNA提取、DNA重亚硫酸盐转化及DNA纯化。制备非甲基化DNA作为阴性对照,完全甲基化DNA为阳性对照,两者以不同比例混合,分别配制成0、10%、25%、50%、75%、90%和100%DNA甲基化标准样本,进行RT-PCR扩增,绘制标准曲线。将已处理的组织DNA作为模板进行RT-PCR实验,计算GATA4基因甲基化程度(%)。GATA4上游引物为5′-ATAAAGCTGACCCTGGGCAC-3′,下游引物为 5′-GGGTGAATTCAGCTGCTCCT-3′。
1.5 RT-PCR检测GATA4 mRNA表达
用Trizol试剂提取各组细胞和组织中的总RNA,并逆转录为cDNA。按照SYBR®RPremix Ex TaqTMⅡ试剂盒说明书的操作步骤进行RT-PCR实验。反应条件:95 ℃、30 s;95 ℃、5 s,60 ℃、34 s,40 个循环。以GAPDH为内参,采用 2-ΔΔCt法计算 mRNA表达。GATA4上游引物为5′-ATAAAGCTGACCCTGGGCAC-3′,下游引物为 5′-GGGTGAATTCAGCTGCTCCT-3′;GAPDH 上游引物为 5′-TGGGTGTGAACCATGAGAAG-3′,下游引物为5′-GTGTCGCTGTTGAAGTCAGA-3′。
1.6 Western blot检测 GATA4、p-ERK、ERK、p-p38和p38蛋白表达
用RIPA裂解液裂解细胞或组织,取上清液,并根据BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离,用湿转法将蛋白转至PVDF膜上,10%脱脂奶粉室温封闭 3 h 后,分别加入 GATA4 抗体(1∶5 000)、p-ERK 抗体(1∶1 000)、ERK 抗体(1∶1 000)、p-p38 抗体(1∶1 000)、p38 抗体(1∶2 000)和 GAPDH 抗体(1∶5 000),4℃孵育过夜;次日加入HRP标记的二抗(1∶5 000),室温孵育1 h。加入ECL发光液,显色、暗室曝光。用Image J软件测定蛋白条带的灰度值,以GAPDH为内参进行目的蛋白相对定量。
1.7 慢病毒感染细胞
将对数期生长的A549细胞接种于6孔板中,接种密度为4×105/mL,于37℃、5%CO2培养箱中培养24 h后,更换培养基为含6 μg/mL polybrene的2 mL新鲜培养基,将MOI=70的GATA4干扰sh-GATA4-1和sh-GATA4-2慢病毒液(sh-GATA4组)、干扰载体阴性对照慢病毒液(sh-NC组)、GATA4过表达载体慢病毒液(pLV-GATA4组)及其空载体对照慢病毒液(pLV-NC组)加至细胞中,同时设置空白对照组(Blank组),转染48 h后,进行后续实验。
1.8 CCK-8实验检测细胞活力
将各组转染后的细胞以5×103/孔接种于96孔板,每组设置3个复孔,分别于细胞培养0 h、24 h、48 h和72 h时,向每孔加入10 μL CCK-8溶液,于37℃条件下孵育3 h后,采用酶标仪测定波长450 nm处的光密度(OD)值。以OD值为纵坐标,时间为横坐标,绘制细胞生长曲线。
1.9 细胞克隆形成实验检测细胞增殖情况
用0.25%胰酶消化对数期生长的A549细胞,并制成单细胞悬液。取5 mL含200个A549细胞悬液接种于60 mm培养皿中,于37℃、5%CO2培养箱中培养2周,用PBS清洗,4%多聚甲醛固定,0.1%结晶紫染液染色1 h,流水缓慢洗去染液,空气干燥。
1.10 流式细胞术检测细胞凋亡
将转染后的各组A549细胞以2.5×106/mL密度接种于6孔培养板,培养24 h后加入300 μL的1×Binding Buffer重悬细胞。加入 5 μL的 Annexin V-FITC染液,混匀,室温避光孵育15 min。随后加入5 μL 的 PI染液,补加 200 μL 的 1×Binding Buffer,上流式细胞仪进行检测。
1.11 统计学方法
采用SPSS 21.0软件进行数据分析。计量数据以均数±标准差(±s)表示,GATA4在 NSCLC 组织和癌旁组织中的甲基化水平差异以及GATA4基因甲基化状态与患者临床病理特征的关系采用χ2检验;GATA4基因甲基化程度与GATA4 mRNA表达,GATA4、p-ERK、p-p38和Bcl-2蛋白表达的相关性采用Spearman相关分析;NSCLC组织和癌旁组织间比较采用配对样本t检验,多组间比较采用单因素方差分析,若组间差异有统计学意义,则采用LSD-t检验进行多重比较。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 GATA4在NSCLC组织和细胞中的表达及甲基化情况
NSCLC组织中GATA4基因甲基化率为74.4%,高于癌旁组织的 16.7%(χ2=22.941,P <0.001);GATA4 mRNA和蛋白表达低于癌旁组织(P<0.001)。GATA4基因甲基化程度与GATA4 mRNA和蛋白表达呈负相关(r=-0.736,-0.643,均 P<0.001),见图 1。GATA4 基因在A549和HCC827细胞中呈完全甲基化状态,在NCI-H1299细胞中呈未完全甲基化,而在BEAS-2B细胞中呈去甲基化。A549、HCC827和NCI-H1299细胞中GATA4 mRNA和蛋白表达低于BEAS-2B细胞(均P<0.01),其中在A549细胞中表达最低,因此选取A549细胞进行后续实验。见图2。
2.2 NSCLC组织中GATA4基因甲基化状态与患者临床病理特征的关系
NSCLC组织中GATA4基因甲基化状态与TNM分期和肿瘤大小有关(均P<0.05),但与年龄、性别和病理学类型无关(均P>0.05),见表1。
2.3 GATA4基因甲基化对NSCLC组织中p-ERK、p-p38、Bax和Bcl-2表达的影响
Western blot检测结果显示,NSCLC组织中p-ERK、p-p38、Bcl-2蛋白表达均高于癌旁组织(均P<0.001),Bax蛋白表达低于癌旁组织(P<0.001)。GATA4基因甲基化程度与p-ERK、p-p38和Bcl-2蛋白表达呈正相关(P=0.008;P=0.011;P=0.007),与 Bax蛋白表达呈负相关(P=0.005)。见图3。
2.4 sh-GATA4对A549细胞的干扰作用
RT-PCR和Western blot实验结果显示,sh-GATA4-1和sh-GATA4-2组细胞中GATA4 mRNA和蛋白表达低于 sh-NC 组(P<0.001;P=0.008),其中 sh-GATA4-1组表达最低,因此选取sh-GATA4-1进行后续实验(记为sh-GATA4组)。见图4。
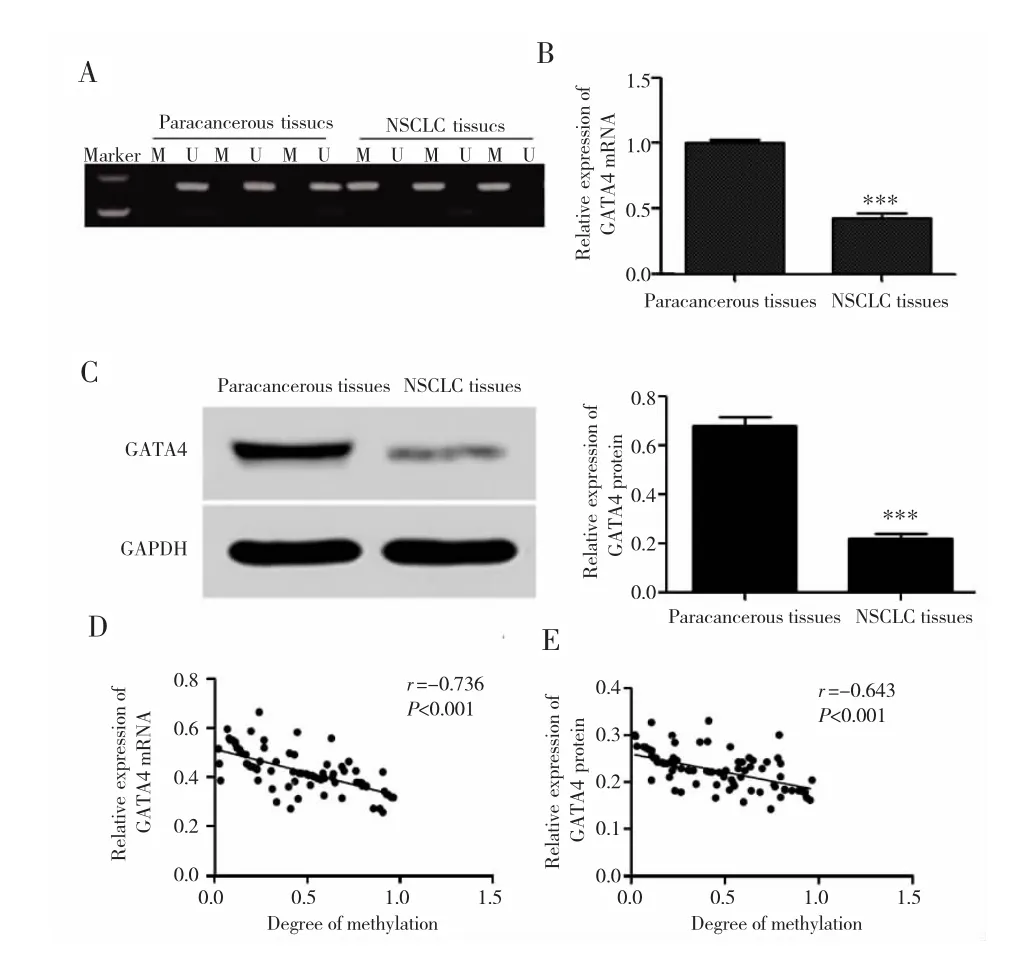
图1 GATA4在NSCLC组织和癌旁组织中的表达Fig.1 Expression of GATA4 in NSCLC tissues and paracancerous tissues
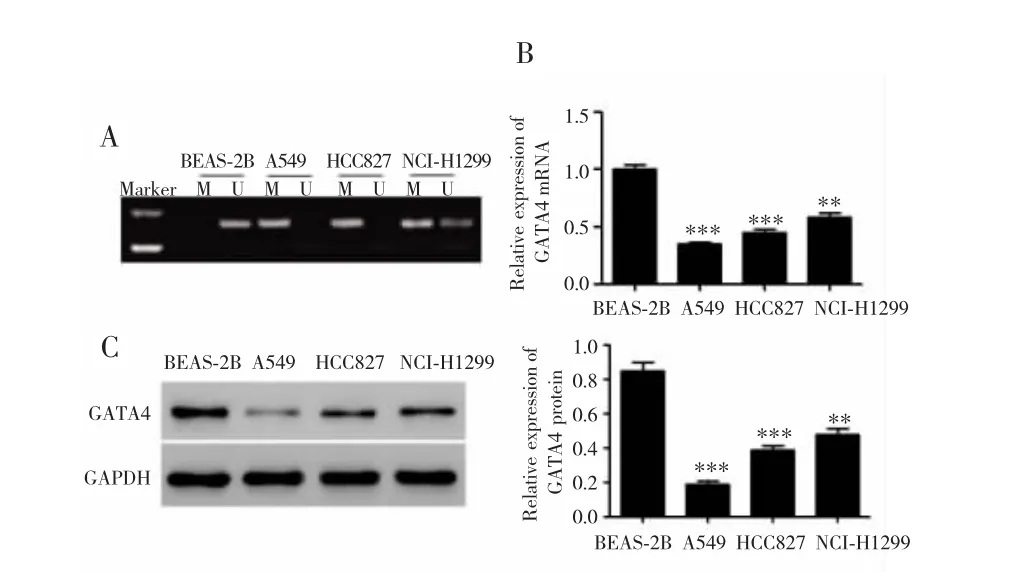
图2 GATA4在肺癌细胞和正常肺上皮细胞中的表达Fig.2 Expression of GATA4 in lung cancer cells and normal lung epithelial cells
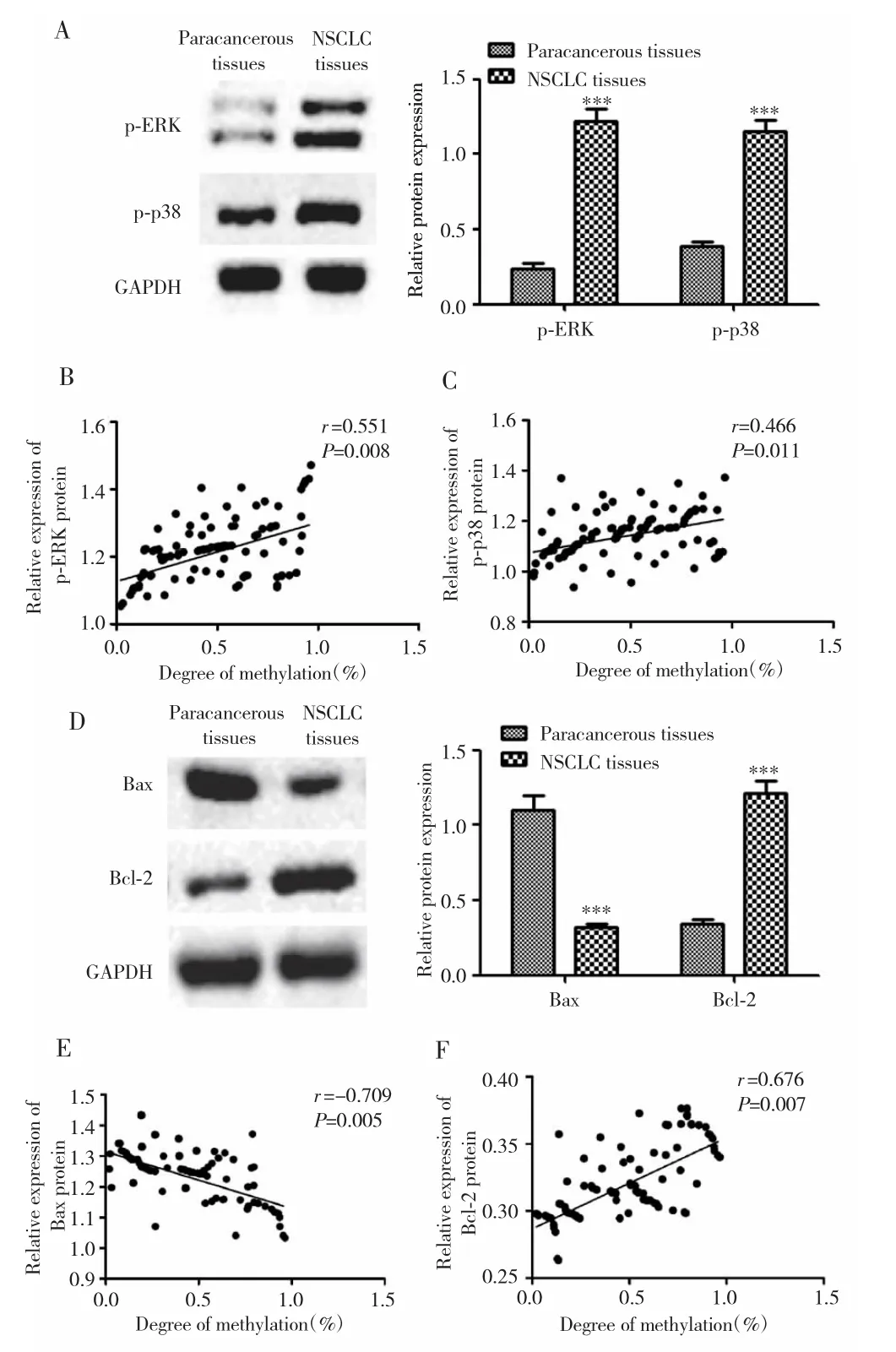
图3 GATA4基因甲基化对肺癌组织中p-ERK、p-p38、Bax和Bcl-2表达的影响Fig.3 The effect of GATA4 gene methylation on the expression of p-ERK,p-p38,Bax and Bcl-2 in lung cancer tissues
2.5 GATA4过表达抑制NSCLC细胞增殖
pLV-GATA4组细胞中GATA4 mRNA和蛋白表达高于 pLV-NC 组(均 P<0.001),24 h、48 h、72 h细胞活力和细胞克隆数均低于pLV-NC组(均P<0.05);sh-GATA4组细胞中GATA4 mRNA和蛋白表达低于sh-NC 组(均 P<0.001),24 h、48 h、72 h细胞活力和细胞克隆数高于sh-NC组(均P<0.05),见图5。
2.6 GATA4过表达促进NSCLC细胞凋亡
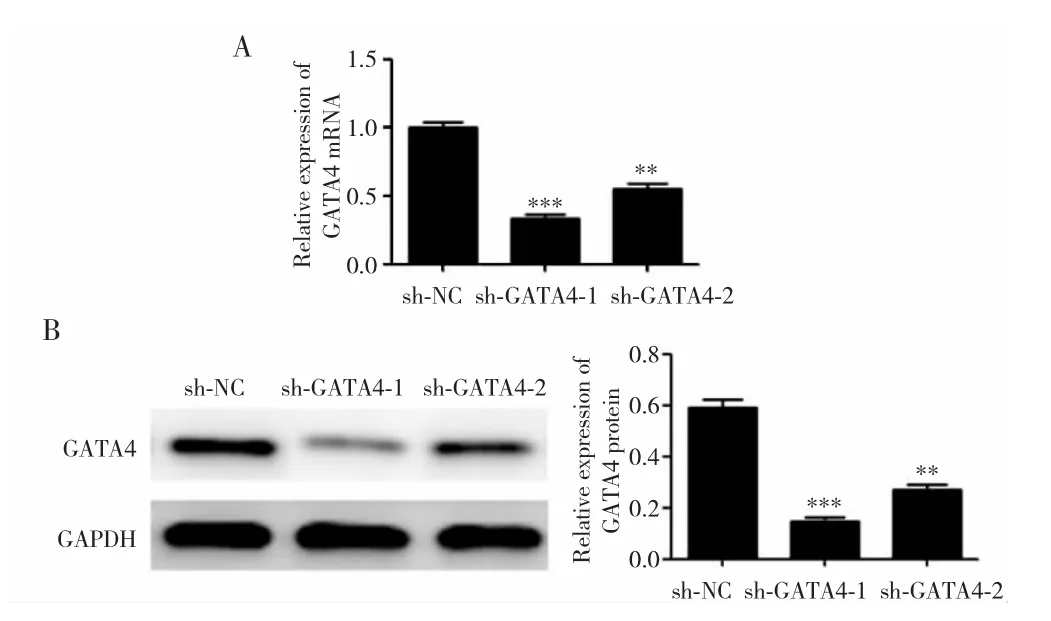
图4 sh-GATA4对A549细胞的干扰作用Fig.4 Interference of sh-GATA4 on A549 cells

表1 NSCLC组织中GATA4基因甲基化状态与患者临床病理特征的关系(n)Tab.1 Relationship between the methylation status of GATA4 gene in NSCLC tissues and the clinicopathological characteristics of patients(n)
流式细胞术检测结果显示,pLV-GATA4组细胞凋亡率高于pLV-NC组(P<0.001),sh-GATA4组细胞凋亡率低于sh-NC组(P=0.007),见图6。
2.7 GATA4过表达抑制MAPK通路活化
Western blot实验结果显示,pLV-GATA4组细胞p-ERK/ERK和p-p38/p38蛋白表达低于pLV-NC组(P=0.005;P<0.001),sh-GATA4 组 p-ERK/ERK 和 p-p38/p38蛋白表达高于sh-NC组(P<0.001;P=0.007)。见图7。
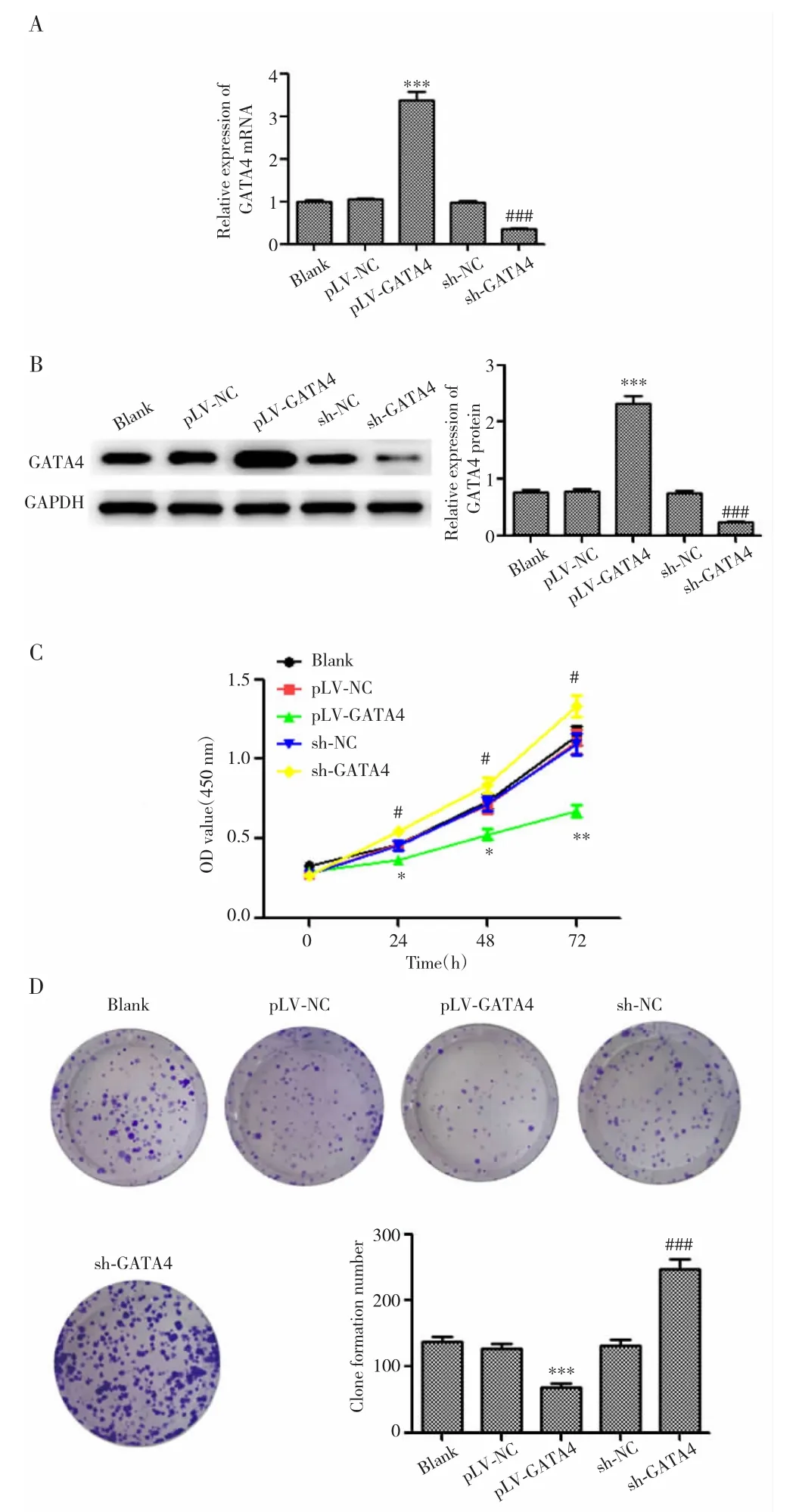
图5 GATA4过表达抑制NSCLC细胞增殖Fig.5 Overexpression of GATA4 inhibited the proliferation of NSCLC cells
3 讨论
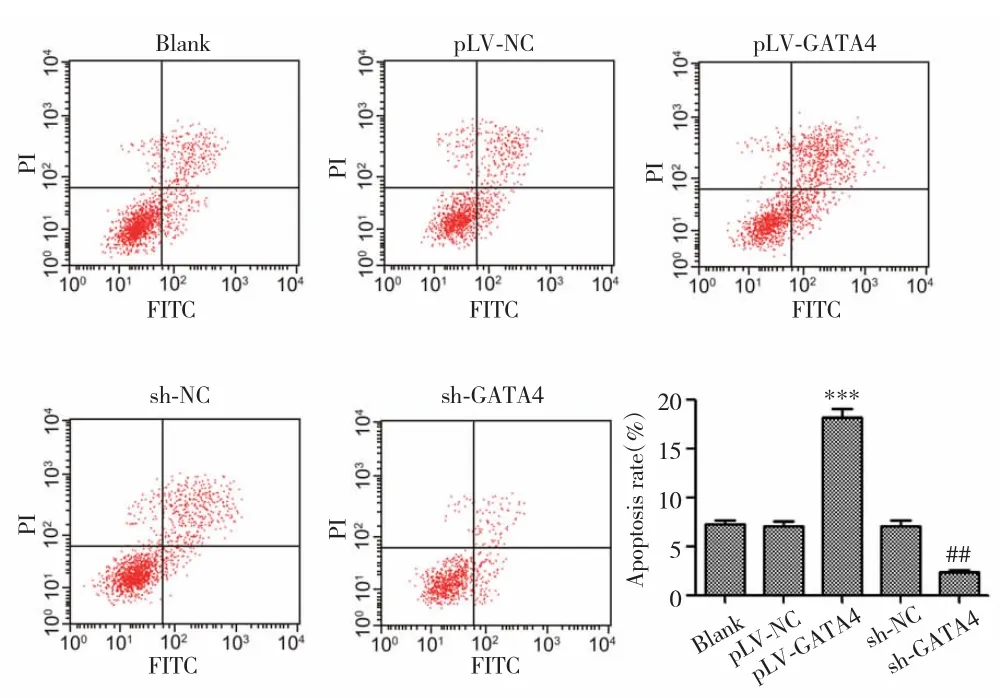
图6 GATA4过表达促进NSCLC细胞凋亡Fig.6 Overexpression of GATA4 promoted the apoptosis of NSCLC cells
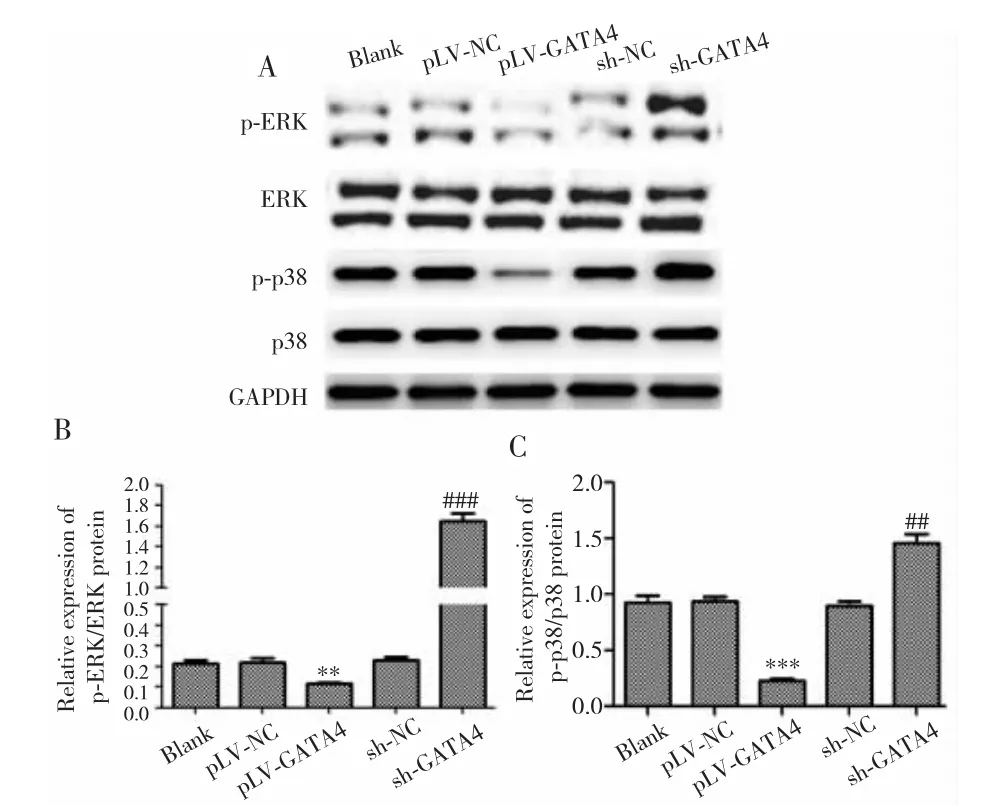
图7 GATA4过表达抑制MAPK通路活化Fig.7 Overexpression of GATA4 inhibited MAPK pathway activation
GATA锌指转录因子家族由6个成员(GATA1~6)组成。其中GATA4在心脏和肺发育中起关键作用[8],其异常表达也与肿瘤发生和恶性进展相关,被认为是癌症治疗的重要候选基因[9]。在口腔鳞状上皮细胞癌组织和细胞中GATA4启动子高度甲基化,且其甲基化状态与患者总体生存率相关[10]。几乎所有乳腺癌细胞系中也都存在GATA4基因甲基化,在乳腺癌组织和细胞系中GATA4表达降低还与预后不良相关,而GATA4过表达可降低乳腺癌细胞存活率、侵袭迁移能力及上皮-间质转化,诱导细胞周期阻滞和凋亡[11]。本研究在NSCLC组织和细胞中同样发现GATA4基因启动子高度甲基化,GATA4呈低表达,相关分析发现GATA4基因甲基化程度与GATA4 mRNA表达和蛋白表达呈负相关,此外GATA4基因甲基化水平还与患者TNM分期和肿瘤大小相关。说明GATA4基因启动子高度甲基化可导致GATA4表达降低,从而参与NSCLC疾病进展。
细胞凋亡是细胞发育和程序性死亡的主要机制[12]。而细胞凋亡途径受Bcl-2家族调控,该家族由促凋亡成员(如 Bax、Bak、Bad、Bcl-xs、Bid、Bik、Bim、HRK、Noxa和 PUMA)和抗凋亡成员(如 Bcl-2、Bcl-xl、Bcl-W、BFL-1和 MCL-1)组成[13]。DNA损伤、能量饥饿和缺氧等细胞应激反应可使促凋亡蛋白去磷酸化和裂解,致使其移位到线粒体,最终导致细胞凋亡[14]。既往研究显示Bcl-2家族蛋白在NSCLC中表达异常,Bcl-2上调及Bax下调与临床耐药有关[15]。本研究检测肺癌组织中促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达,发现Bax蛋白表达下调而Bcl-2蛋白上调,且GATA4基因甲基化程度与Bcl-2蛋白表达呈正相关,而与Bax蛋白表达呈负相关,说明GATA4基因甲基化与细胞凋亡呈负相关。进一步采用慢病毒载体构建过表达GATA4和干扰GATA4的肺癌A549细胞株,发现过表达GATA4可抑制细胞增殖并诱导细胞凋亡,而敲低GATA4则反之,说明过表达GATA4在NSCLC中发挥抗肿瘤作用。
MAPK家族由ERK1/2、p38和JNK三个主要成员组成,可以调节细胞增殖、分化和凋亡等多种细胞过程[16]。既往研究报道激活MAPK通路中的ERK、JNK和p38可增强肺癌细胞抵抗放射线及对DNA损伤修复的能力[17]。在GATA4过表达细胞中也发现显著差异表达的基因部分富集在MAPK通路[18],且过表达GATA4可抑制MAPK通路激活[19]。本研究结果显示,p-ERK和p-p38蛋白在肺癌组织中表达上调,且与GATA4基因甲基化程度呈正相关,提示GATA4基因甲基化可能激活MAPK通路。为了验证GATA4与MAPK通路的关系,进一步进行细胞验证,发现过表达GATA4可降低ERK和p38磷酸化水平,抑制MAPK通路活化;而干扰GATA4则提高了ERK和p38磷酸化水平,促进MAPK通路活化。说明GATA4可能通过抑制MAPK通路下游靶标ERK和p38磷酸化而在NSCLC细胞中发挥抗肿瘤作用。
综上所述,GATA4在NSCLC组织和细胞中均呈高度甲基化,上调GATA4可能通过调控MAPK通路抑制NSCLC细胞增殖,诱导细胞凋亡。GATA4可能是NSCLC治疗的潜在靶点。

