基于生物信息学分析子宫内膜异位症的潜在生物标志物和候选治疗药物
赵旭旭,赵卫东,张璟鹤,陈峥峥,任萍萍,张 影,葛 丽,于明月,朱美玲
子宫内膜异位症(内异症)是妇科常见的慢性、炎症性、雌激素依赖性疾病,是导致育龄期女性出现盆腔疼痛、月经紊乱、组织粘连和不孕的主要原因[1]。其在育龄期女性中的发病率为5%~10%,困扰着全世界约1.76亿女性[2]。内异症确切的病因和发病机制尚不清楚,缺乏特异性的治疗药物。被广泛接受的“经血逆流学说”认为有活性的子宫内膜组织可随逆流经血进入盆腔,然后种植,形成内异症。但经血逆流可发生在超过90%的输卵管未闭的月经来潮女性中,而仅约10%的女性发病。鉴于异位内膜与正常内膜组织具有相似的组织结构和细胞组成,因此异位内膜细胞自身特性的改变可能是发病的重要原因。该研究旨在检测正常内膜和卵巢内异症的异位内膜两组基质细胞的转录谱,并结合公共数据库的基因表达谱数据,比较两组细胞的基因表达差异,分析介导疾病的主要通路和功能,筛选致病的关键基因和潜在生物标志物,并寻找候选的治疗药物。
1 材料与方法
1.1 病例资料2018年10月—2019年5月就诊于安徽医科大学附属省立医院,因卵巢内异症行卵巢囊肿剥除手术的8例女性患者。对照组的正常内膜组织取自行子宫肌瘤手术的3例患者。选取的内膜组织均为晚期分泌期(最接近反流性子宫内膜)。纳入标准:①22~43(33.7±6.2)岁;②未绝经,平素月经规律;③无子宫内膜炎。排除标准:①吸烟者;②有宫内节育器、慢性或免疫性疾病、凝血功能障碍和深静脉血栓病史;③术前6个月内接受过抗感染、免疫抑制治疗,激素治疗或抗凝血剂等治疗。患者的一般临床资料见表1。所有的病理结果均由两位副主任病理医师共同诊断。本研究经安徽医科大学附属安徽省立医院伦理委员会审核通过(2019-ky066),并取得所有患者及其家属的知情同意。

表1 入组患者的临床资料
1.2 主要仪器及试剂DMEM/F-12购自美国Hyclone公司;FBS购自美国Gibco公司;Ⅳ型胶原酶和Ⅰ型脱氧核糖核酸酶购自美国Sigma公司;青霉素-链霉素-两性霉素B购自北京索莱宝科技有限公司;CD10抗体购自美国BD公司(PE/555375);磁珠分选试剂盒和LS分离柱购自德国Miltenyi公司。
1.3 分离基质细胞分离基质细胞步骤如下:①无菌条件下采集的新鲜正常内膜和异位内膜组织,置于冰浴的含10%FBS及三抗(青霉素100 U/ml,链霉素0.1 mg/ml,两性霉素B 0.25 μg/ml)的DMEM/F-12培养液中,至实验室分离;② 1×PBS洗3次,剪碎至直径小于1 mm;③转至含2.5 mg/ml的Ⅳ型胶原酶和50 U/ml的Ⅰ型脱氧核糖核酸酶的DMEM/F-12消化液中混匀,37 ℃消化40 min;④经100目筛网滤除未消化的组织,600 r/min、4 ℃离心10 min,去除混杂的白细胞和红细胞; ⑤1×PBS冲洗基质细胞,重悬备用。
1.4 磁珠分选CD10阳性基质细胞磁珠分选CD10阳性基质细胞步骤如下:①对基质细胞离心计数,以40 μl/107个细胞的比例加入MACS buffer重悬;②吹匀悬液,以10 μl /107个细胞的比例加入10 μl CD10 biotin-antibody cocktail,混匀,4 ℃避光标记20 min;③MACS buffer洗1次,4 ℃离心;④以70 μl/107个细胞的比例加入MACS buffer重悬细胞,以20 μl/107个细胞的比例加入microbeads cocktail,4 ℃避光标记20 min;⑤加入MACS buffer洗1次,4 ℃离心;⑥MACS buffer重悬,过LS柱子;⑦用MACS buffer冲洗挂柱细胞,4 ℃离心,得到纯化的CD10阳性基质细胞。
1.5 基因芯片数据的下载和处理纯化的基质细胞,利用GPL6480(G4112F; Agilent)平台检测其全基因组表达谱。从基因表达谱综合数据库(GEO)筛得基于同平台检测分泌期正常内膜和异位内膜基质细胞的GSE120103和GSE3783两组芯片,补充9个正常内膜组织(GSM3393491-GSM3393499)和14个异位内膜组织(GSM3393500-GSM3393508,GSM928792,GSM928800,GSM928806,GSM928808,GSM928810)。依次用Robust Multiarray Average和sva package对3组芯片的原始数据进行预处理并消除批次差异,得到归一化的标准数据。采用limma软件包和经验贝叶斯方法筛选差异表达基因(differentially expressed genes,DEGs),其中P<0.05,|log2Fold-change|≥1.0的基因被认为表达显著差异。芯片数据可从GEO数据库中获取(GSE132464)。
1.6 差异基因的功能富集分析结合基因本体(GO)数据库和京都基因与基因组百科全书(KEGG)数据库,利用clusterprofiler软件包对DEGs富集通路和功能进行分析和可视化展示。符合错误发现率(FDR)<0.05且P<0.05的条件,被认为是差异有统计学意义的显著富集。
1.7 蛋白质-蛋白质相互作用(PPI)网络的构建将差异基因提交到在线数据库STRING(https://string-db.org/),得到PPI数据。选择综合得分>0.7的PPI节点构建PPI网络。利用生物信息学软件Cytoscape v3.4.0(http://www.cytoscape.org/)分析候选蛋白的交互关系,对各节点蛋白相互作用蛋白数目进行排序,筛选出核心靶点。
1.8 类药物小分子化合物的筛选将差异基因分为上、下调两组,分别输入关联性图谱(CMAP, http://www.broadinstitute.org/cMAP/)数据库检索。比较差异基因与CMAP中小分子干扰基因的表达模式相似性,识别出与疾病相关的小分子化合物。P<0.001且mean绝对值>0.5的小分子被认为与疾病显著相关。
1.9 统计学处理使用GraphPad Prism 8.0统计数据和做图。所有的数据均使用双尾非配对t检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 异位内膜和正常内膜组织中DEGs的筛选为筛选异位内膜和正常内膜组织中DEGs,以P<0.05,|log2Fold-change|≥1.0为条件,对25个样本(10个正常内膜、15个异位内膜)中18 690个基因的表达数据进行筛选。共筛得869(4.6%)个差异表达基因,包括17个上调基因和852个下调基因。见图1A。利用R语言gplots包对差异基因进行聚类分析并可视化。见图1B。
2.2 异位内膜组织中DEGs的功能注释和通路富集为探究异位内膜组织中差异基因的功能,对其进行GO和KEGG功能注释。GO富集分析显示前10位变化条目包括受体配体活性、通道活性、被动跨膜转运蛋白活性、DNA结合转录激活因子活性和RNA聚合酶Ⅱ特异性、底物特异性通道活性、离子通道活性、离子门控通道活性、门控通道活性、细胞因子活性、神经递质受体活性。见图2A。其中,仅DNA结合转录激活因子活性和RNA聚合酶Ⅱ特异性在病灶中被上调。KEGG通路富集分析发现,神经活性配体-受体相互作用通路、细胞因子-细胞因子受体相互作用通路、IL-17信号通路、破骨细胞分化通路、金黄色葡萄球菌感染通路、尼古丁成瘾通路出现功能紊乱。见图2B。结果表明异位内膜组织可能通过这些显著富集的功能条目和通路机制参与疾病的发生、发展。
2.3 异位内膜组织中差异基因PPI网络的构建为深入挖掘异位内膜组织中核心的致病基因和潜在的生物标志物,将全部差异基因输入STRING数据库预测它们之间的相互作用网络。见图3A。根据各网络节点的度(degree,表示网络中和节点相连路线的条数)筛选出与其他节点蛋白相关性最强的8个核心基因,包括甲酰肽受体2(formyl peptide receptor 2,FPR2)、血清淀粉样蛋白A1(serum amyloid A1,SAA1)、松弛肽3(relaxin-3,RLN3)、细胞介素8(C-X-C motif chemokine 8,CXCL8/IL8)、甲酸基肽受体1(formyl peptide receptor 1,FPR1)、血小板因子4(platlet factor 4,PF4)、趋化因子受体7(C-C chemo-kine receptor type 7,CCR7)和趋化因子配体5(C-X-C motif chemokine 5,CXCL5)基因。与其相互作用的关系对和基因如表2所示。利用小提琴图比较8个关键基因的表达变化,结果显示它们在异位病灶中均下调,以FPR2、SAA1和CXCL8基因的下调最显著(t=3.537、P=0.001 8;t=2.995、P=0.006 5;t=2.187、P=0.039 2;t=3.020、P=0.006 1;t=2.256、P=0.033 9;t=2.775、P=0.010 8;t=2.178、P=0.039 9;t=2.258、P=0.0337)。见图3B。这些核心基因可能在异位内膜病灶的形成中起关键作用,有望成为内异症潜在的生物标志物。

图1 差异基因的筛选和聚类分析

图2 差异基因的功能注释和通路富集分析
2.4 与内异症疾病相关的类药物小分子的筛选为寻找治疗内异症的候选药物小分子,并为进一步实验验证提供理论依据,将异位内膜组织的差异基因表达谱与CMAP数据库进行比对。包括Prestwick-692、硫代罗宁、氟硝利嗪、苯海索和喹吡罗在内的5个小分子化合物与内异症的关联性最强(表3)。其中,硫代罗宁和氟硝利嗪与病灶中的差异基因具有相反的作用机制,是拮抗内异症的潜在小分子化合物。而Prestwick-692、苯海索和喹吡罗与内异症某些生物过程或状态有相似的关系,与发病可能有类似的作用机制。硫代罗宁和氟硝利嗪的化学分子式、作用机制和临床应用见表4。
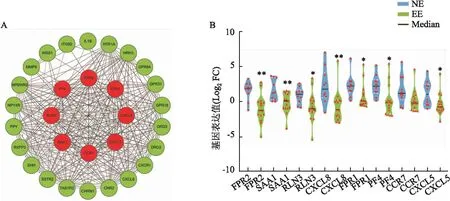
图3 核心差异基因的筛选及表达差异分析

表3 CMAP数据库筛选出的关联度最强的5种小分子化合物

表4 负相关小分子化合物的作用机理及应用
3 讨论
异内症作为一种慢性炎症性疾病,可引起严重的慢性疼痛(痛经、性交困难、腹痛)和一系列生殖问题,长期困扰着世界各地数以百万计的女性。尽管越来越多的证据表明遗传、内分泌、免疫、微生物和环境因素与异内症的发病相关[1],但明确内异症的病因、发病机制和开发特异性治疗药物仍是难点。
本研究表明异位内膜和正常内膜的基因表达谱整体相似,仅少部分基因差异表达,以下调基因为主。在异位内膜病灶中受体配体活性、细胞因子活性和神经递质受体活性的改变可能介导疾病的发生和疼痛的调节,神经活性配体-受体相互作用通路、细胞因子-细胞因子受体相互作用通路和IL-17信号通路等通路的调控紊乱也与疾病发生密切相关,这与之前的研究相符[3]。深入分析病灶中的基因改变,FPR2、SAA1、RLN3、CXCL8、FPR1、PF4、CCR7和CXCL5共8个基因被认为是关键的致病因素,是内异症潜在的生物标志物。本研究首次显示SAA1在人内异症病灶中的表达降低。已有研究表明SAA是由肝细胞产生和释放的一种急性期蛋白,参与维持黏膜组织中的免疫平衡,在肉牛子宫内膜的正常和炎症状态中均表达[4]。炎症消退后SAA1的高表达被认为参与了子宫内膜组织中免疫平衡的重建,因此,人内异症中低表达的SAA1可能反应了组织中的炎症状态[4]。与Volpato et al[5]的研究一致,本研究显示,在分泌晚期异位内膜中FPR2和FPR1的表达水平均降低。膜粘连蛋白A1激活甲酰基肽受体2 /阿司匹林触发脂蛋白(FPR2/ALX)可诱导M1型巨噬细胞向M2型分化,并减弱病灶中IL-6、IL-1β和TNF-α的表达。阻断FPR1和FPR2/ALX以及缺乏ANXA1都可导致腹腔血管平滑肌细胞中IL-6的生成增多,而IL-6水平与NK细胞的溶细胞活性呈负相关,其在降低内异症患者腹腔液中NK细胞的活性起至关重要的作用,有助于异位内膜细胞的存活和植入[5]。已有报道[6-7]称内异症患者的血清和腹腔液中CXCL8的表达均升高,CXCL8可通过促进血管生成和内膜细胞的附着、生长,在疾病发生中发挥作用。而该研究结果表明异位内膜组织中CXCL8的表达水平相较正常内膜下降。考虑到包括CXCL8在内的多种趋化因子配体可介导体内多种复杂的调控网络,如IL-1β和TNF-α通过诱导p38 MAPK信号通路可介导CXCL8在异位内膜中的表达[6],因此,CXCL8在内异症中的价值仍需进一步验证。先前的研究[8]显示宫腔粘连的子宫内膜组织中CXCL5蛋白水平明显降低,CXCL5的表达在维持正常内膜的功能、抑制宫腔粘连形成中具有重要作用。因此,CXCL5在异位内膜病灶中的下调表达可能与内膜组织的损伤和粘连功能改变有关。CCR7被报道[9]在内异症中的表达升高,CCL19/CCR7轴可通过PI3K/AKT信号通路介导子宫内膜基质细胞中B 细胞淋巴瘤因子2(BCL2)、基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)的表达,促进内膜基质细胞的增殖和侵袭。该研究结果与之相反,提示可能有其他通路途径参与调控CCR7在异位内膜病灶中的表达。RLN3是一种肽激素,可通过G蛋白偶联受体信号传导途径介导人子宫内膜基质细胞的蜕膜化[10]。目前尚无关于内异症中RLN3和PF4的研究报道。
治疗内异症,临床常推荐的避孕药、高效孕激素以及促性腺激素释放激素激动剂 (GnRH-a)等多伴随一系列副作用,因此开发特异性强的靶向药物具有重要价值。筛得的硫代罗宁和氟硝利嗪被认为是拮抗内异症的潜在药物。硫代罗宁作用靶点包括甲状腺激素受体α蛋白、β蛋白和增殖细胞核抗原蛋白。细胞增殖已被证实在内异症中起至关重要的作用,藏红花素可通过靶向增殖细胞核抗原的表达抑制内异症的生长[11]。因此,硫代罗宁可能具有类似藏红花素的功能——治疗内异症。氟硝利嗪的作用靶点包括电压依赖性T型钙通道亚基α-1G、-1H、-1I蛋白和组胺H1受体蛋白以及钙调蛋白。相比于正常内膜,异位内膜组织中钙调蛋白表达增高,其可通过钙调蛋白激活钙调磷酸酶/活化T细胞核因子通路介导COX-2的表达,参与内异症中异位内膜组织的增殖[12]。因此,作用于钙调蛋白的靶向剂氟硝利嗪可能在治疗内异症中具有潜在价值。
该研究使用生物信息学分析方法探究了内异症中多功能、多通路、多靶点的复杂致病因素,为进一步筛选疾病相关的生物标志物,阐明发病机制和开发靶向药物提供了新思路。

