谷氨酰胺转运蛋白ASCT2介导激活突变Ptpn11(SHP2)促进骨髓增殖性肿瘤的发生
马牧天,谭振亚,周园琴,吴梦月,郑 红
骨髓增殖性肿瘤 (myeloproliferative neoplasma,MPN)是一类以一种或几种骨髓细胞持续异常增殖为特征的疾病,被认为是髓系肿瘤的一种[1]。在病理后期可转化为急性白血病。蛋白质酪氨酸磷酸酶2(domain-containing protein-tyrosine phosphatase-2, SHP2)是一种由Ptpn11基因编码的非受体型蛋白酪氨酸磷酸酶,在造血细胞的生长发育、增殖分化过程中起着十分重要的作用。多种类型的白血病患者体内存在SHP2蛋白的异常活化,因此,SHP2被认为是白血病的原癌基因[2-4]。谷氨酰胺转运蛋白2(alanine-serine-cysteine transporter 2, ASCT2)是由Slc1a5基因编码的中性氨基酸载体,在多种癌症中可通过调节肿瘤细胞对谷氨酰胺的摄入来影响肿瘤的发病,抑制ASCT2的表达则可有效的抑制癌细胞的恶性增殖[5-7],但血液系统疾病与ASCT2相关的研究报道很少,与MPN发病机制的关系研究尚不清楚。该研究通过构建SHP2激活突变鼠,观察ASCT2对SHP2激活突变后致骨髓增殖性肿瘤的调控作用,为临床治疗寻找新的靶点提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株 自实验小鼠体内分离的原代细胞,包括小鼠骨髓间充质干细胞(bone mesenchymal stem cells,MSC):MSC(Ptpn11+/+)和MSC(Ptpn11E76K/+);造血干细胞(hematopoietic stem cells, HSC): HSC(Ptpn11+/+)和HSC(Ptpn11E76K/+)。
1.1.2主要试剂 Western blot实验抗体购自美国Cell Signaling公司;Glutamate Assay Kit购自美国Cell BIOLABS公司;DMEM、胰蛋白酶(Trypsim)购自美国Gibco公司;胎牛血清(FBS)、青链霉素混合溶液(双抗)购自美国Hyclone公司;PBS粉末、牛血清白蛋白(BSA)购自美国Sigma公司;其他试剂和耗材均购自上海生物工程(生工)股份有限公司。
1.1.3主要仪器 细胞培养箱(型号ELCETRON CORPORATION)、酶标仪(型号3001)、高速低温离心机(型号MultifugeX1R)购自美国赛默飞世尔科技公司;恒温磁力搅拌器(型号79HW-1)、涡旋振荡器(型号XH-89)购自乐清乐成电器厂;倒置显微镜(型号ECLIPSE TS100)购自日本尼康公司;凝胶成像仪(型号FC3)购自美国普诺森公司;超声波细胞破碎仪(型号JY92-2D)购自宁波新芝科技公司。
1.2 方法
1.2.1实验动物的构建 Ptpn11E76K/+突变鼠来自美国埃默里大学血液/肿瘤系瞿成奎教授惠赠;Mx1-Cre+小鼠(C57BL/6J品系)购自上海南方模式动物中心,于安徽医科大学基础医学院动物实验中心SPF级环境中饲养扩繁,于鼠龄4~5周鉴定后,对突变鼠(Ptpn11E76K/+Mx1-Cre+)注射PIPC诱导。
1.2.2骨髓细胞的提取 全程无菌操作,脊柱脱臼处死小鼠后,用75%乙醇浸泡小鼠消毒3 min,自腹部将小鼠皮肤剪开并拨下下肢皮肤,选小鼠后肢自髋关节剪下,存放于无菌PBS中,将小鼠后肢转移至细胞间。将小鼠后肢自膝关节分开,并将骨头上的软组织与骨头分离干净,留下干净的腿骨,置于另一无菌培养皿中,并用PBS浸泡清洗。用5 ml注射器从小鼠腿骨两端钻孔,直至有落空感且针头进入骨内,使骨髓腔两端都与外界相连。吸取1~2 ml无菌PBS反复从腿骨两端冲洗骨髓腔,直至腿骨整体呈白色为止。将含有骨髓细胞的PBS转移至EP管中,吹打均匀后,800 r/min转速离心3 min,吸弃上清液,沉淀即为全骨髓细胞,可用完全培养基重悬细胞至培养皿中进行接种培养。
1.2.3细胞分选与培养 HSC采用流式分选获得;MSC利用磁珠分选获得;MSC培养于含10%FBS的DMEM、含1%双抗青链霉素混合溶液中,置于37 ℃、5% CO2的恒温培养箱中。
1.2.4MTT实验法 消化培养皿中的细胞,并用完全培养基溶液(含10%FBS)配制成单个细胞悬液,计算细胞数。以每孔体积180 μl、细胞数量800~1 200个,将细胞接种至96孔板,置于37 ℃,5%CO2的饱和湿度培养箱中培养1~2 d。每孔加入20 μl MTT溶液(PBS溶液配制,5 mg/ml,pH7.4),继续孵育4 h后,离心后弃去上清液。每孔加入150 μl DMSO,置于37 ℃环境下,震荡10~20 min,使结晶充分溶解。在酶联免疫检测仪上使用490 nm波长,测定各孔吸光度(optical density, OD),并记录结果。
1.2.5谷氨酸检测 将超纯水和10×分析缓冲液按照9:1的比例稀释成1×分析缓冲液。按照说明书制备反应混合物溶液,用1×分析缓冲液调整荧光探针最终浓度为100 μmol/L、HRP最终浓度为0.2 U/ml、谷氨酸氧化酶为0.08 U/ml、谷氨酸丙酮酸转氨酶为0.5 U/ml、L-丙氨酸为200 μmol/L(反应混合物溶液可在4 ℃环境中储存1 d)。用PBS将细胞浓度调整为1×106~2×106个 /ml,转移细胞悬液至1.5 ml EP管中,冰上放置。使用超声波细胞破碎仪破碎EP管中的细胞(间隔8 s,工作3 s,总时长6 min)。将L-Glutamate标准品溶液以1 ∶10的比例,用试剂盒中的1×分析缓冲液稀释配制谷氨酸盐标准品,配制成的每孔50 μl体积的梯度浓度标准品(谷氨酸浓度分别为20、10、5、2.5、1.25、0.625、0.312 5、0 μmol/L)加到96孔板中。每孔中加入50 μl反应混合物溶液,充分混合后,用锡箔纸完全包裹96孔板,置于37 ℃无光照环境下孵育30~45 min。在酶联免疫检测仪上使用590~600 nm的波长,测定各孔OD值,并记录结果。

2 结果
2.1 Ptpn11E76K/+Mx1-Cre+激活突变鼠模型的构建构建模型的原理是利用了生物基因的同源修复机制,基因修饰使得一条链上76位点E突变为K后的Ptpn11部分外显子序列插入小鼠DNA中,此DNA序列同时包含有一个Neo盒并连着一个STOP位点,并且在Neo盒和STOP位点的两端各有一个LoxP位点。此时在无Cre酶的诱导下,由于此序列中存在STOP位点,此E76K位点无法完整转录翻译,该条基因链上的突变SHP2基因无法表达。 通过注射PIPC增加干扰素(IFN)的产生诱导Mx1 启动子启动Cre重组酶的表达,作用于插入DNA序列中LoxP位点,定向切除Neo盒和STOP位点,使得E76K突变的Ptpn11可以完全成功转录翻译而诱导Ptpn11激活突变表达,见图1A,特异性地在转基因小鼠的造血系统及间充质干细胞中实现了Ptpn11E76K基因的表达,此时突变小鼠体内SHP2蛋白得以正常表达,见图1B,插入DNA序列中的Neo盒在骨髓细胞和间充质干细胞中约96.1%和95.4%被切除(F=47.841、56.250,P<0.001),见图1C。
2.2 Ptpn11E76K/+Mx1-Cre+激活突变鼠发生MPN,HSC体外增殖能力增强且依赖培养环境中的谷氨酰胺突变小鼠PIPC注射结束约40 d后,可出现脾脏肿大至0.42 g(正常0.08 g)(F=34.452,P<0.01),见图2A。骨髓及脾脏中髓系细胞增多(F=62.228、43.123,P<0.01),见图2B,显示已罹患MPN。将Ptpn11E76K/+Mx1-Cre+突变小鼠和Ptpn11+/+Mx1-Cre+正常小鼠体内的HSC和MSC自骨髓中分离纯化,并进行体外培养。利用MTT法检测HSCs在体外的增殖能力可观察到,突变小鼠体内的HSCs增殖能力强于正常小鼠,见图2C,但将培养基去除谷氨酰胺后,突变小鼠的HSCs增殖能力反而会弱于正常小鼠,见图2D,提示Ptpn11E76K/+Mx1- Cre+激活突变鼠HSC的体外高增殖能力依赖于外界环境中谷氨酰胺的含量。
2.3 Ptpn11E76K/+Mx1-Cre+激活突变鼠体内谷氨酰胺的含量和ASCT2的表达量Western blot技术检测激活突变鼠体内ASCT2的变化,突变小鼠骨髓细胞中ASCT2的表达高于正常小鼠,并且检测Ptpn11+/+Mx1-Cre+正常小鼠和Ptpn11E76K/+Mx1-Cre+激活突变鼠血清及细胞内的谷氨酰胺含量,显示突变小鼠血浆、骨髓细胞中谷氨酰胺含量高于正常小鼠(F=36.454、65.243,P均<0.01)。同时在构成骨髓微环境的MSC中,激活突变鼠的谷氨酸是正常小鼠的3倍左右(F=62.224,P<0.01),由于谷氨酰胺是谷氨酸的转化前体和主要来源,在其转化过程中谷氨酰胺被水解为谷氨酸和氨,显示SHP2突变型白血病细胞为维持自我增殖的能量、氮源等需求,对谷氨酰胺的摄取能力增强。见图3。

图1 成功构建Ptpn11E76K/+ Mx1-Cre+激活突变鼠

图2 Ptpn11E76K/+ Mx1-Cre+激活突变鼠细胞体外增殖能力高度依赖谷氨酰胺的浓度
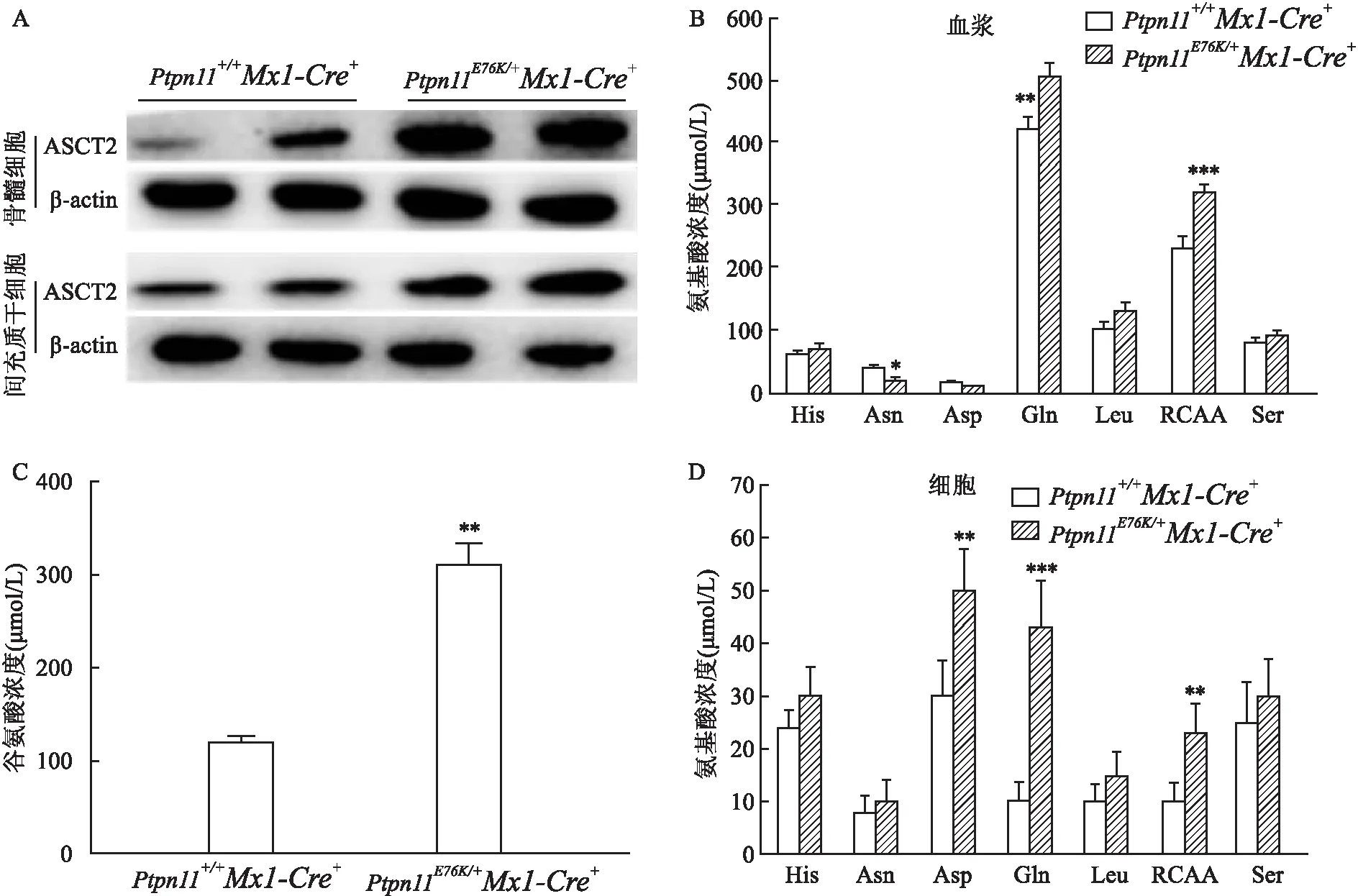
图3 Ptpn11E76K/+ Mx1-Cre+激活突变鼠的谷氨酰胺水平增高
2.4 Ptpn11E76K/+Mx1-Cre+激活突变鼠的细胞能量代谢增强,能量应激及增殖相关的常见信号分子表达增强之前的实验证明,Ptpn11E76K/+Mx1-Cre+激活突变鼠肿瘤模型ASCT2的表达增高,而且大量摄入谷氨酰胺。检测两组小鼠HSC内代谢情况,显示突变小鼠细胞上清液中乳酸水平是正常小鼠的2倍左右(F=73.46,P<0.001),ATP产生是正常小鼠3倍到5倍左右(F=36.25、54.237,P<0.001 ),反映其糖酵解能力增强,见图4A、B。同时利用Western blot技术检测突变小鼠体内相关蛋白的表达水平,表明突变小鼠骨髓细胞内p-mTOR、p-AKT、p-ERK表达增强,p-mTOR/p-S6信号通路也增强,见图4C。
2.5 抑制ASCT2对谷氨酰胺的摄取,可遏制Ptpn11E76K/+Mx1-Cre+激活突变鼠GPNA是较为常见的ASCT2拮抗抑制剂,它可以通过与ASCT2竞争性结合抑制细胞对谷氨酰胺的摄取。将Ptpn11E76K/+Mx1-Cre+激活突变鼠随机分成两组,分别为实验组和抑制处理组:在对两组小鼠注射PIPC诱导完成后,抑制处理组立即注射GPNA溶液,实验组不做处理,持续4周,观察两组小鼠的情况。注射GPNA的处理组小鼠其脾脏小于未注射的小鼠(F=34.230,P<0.01),而且其细胞内谷氨酸含量少于实验组(F=23.440, P<0.01)。见图5A、B。利用Western blot技术检测2组小鼠体内相关蛋白的表达水平,表明抑制ASCT2后,其体内p-mTOR表达降低,显示p-mTOR信号通路活性被抑制,见图5C。HE染色显示注射GPNA溶液的处理组小鼠骨髓、脾脏、肺部和肝中炎性细胞浸润减轻,显示其MPN的发病进程被抑制。

图4 Ptpn11E76K/+ Mx1-Cre+激活突变鼠细胞的能量代谢增强,细胞增殖相关信号表达增强
3 讨论
细胞代谢重构是各种肿瘤细胞普遍的特征[8-9],细胞分化和生长之间的平衡通常与新陈代谢有关,HSCs 的代谢调控日益受到关注。正常 HSC 必须定居在骨髓中低氧、低营养物质的环境中通过激活糖酵解来保持静息状态[10-12]。在增殖和自我更新的过程中,需要葡萄糖、脂肪酸以及氨基酸三大营养物质的代谢提供 ATP 供能。而肿瘤细胞主要依赖葡萄糖和谷氨酰胺。当葡萄糖的代谢途径主要依靠糖酵解产生 ATP 时,谷氨酰胺就成为增殖期细胞(包括肿瘤细胞)的关键的能量来源,它通过代谢可以转化为α-酮戊二酸,进入 Krebs 循环不仅为细胞提供 ATP,还为大分子合成提供前体物质。但谷氨酰胺必须通过载体的转运才能进入细胞内,其中载体 ASCT2 起重要作用。ASCT2(Slc1a5 基因编码)是一个广谱的中性氨基酸载体,主要转运谷氨酰胺、丙氨酸、丝氨酸和半胱氨酸等,为细胞代谢提供重要的营养底物[13-14]。虽然对谷氨酰胺载体 ASCT2 的生理学功能进行了大量的研究,病理情况下,尤其是在血液系统肿瘤中的调控作用相关研究并不多。关于 ASCT2 对 SHP2 激活突变后骨髓微环境及造血干细胞代谢的影响及功能调控,目前尚无报道。本课题探讨了 SHP2 激活突变后ASCT2 对代谢的影响进而揭示其影响疾病发生发展的相关机制。
在低糖和谷氨酰胺缺乏的情况下,干细胞会因为ATP 的缺乏很快死亡[15]。本研究显示SHP2 激活突变后造血干细胞的体外增殖能力增强,去除了培养基中的谷氨酰胺后,增殖能力降低,死亡增多,表明突变细胞的增殖能力增强是谷氨酰胺依赖性的。同时突变鼠的骨髓细胞及间充质干细胞中检测到了高浓度的谷氨酰胺水平。进一步检测突变鼠的骨髓细胞及间充质干细胞中谷氨酰胺转运蛋白 ASCT2 的表达情况,ASCT2 的蛋白表达异常增高。
进一步检测突变鼠的代谢情况显示ATP产生量增加,乳酸水平增高,同时与细胞能量应激、增殖相关的p-mTOR/ p-S6、p-AKT、p-ERK信号分子表达增强。为了证实ASCT2对骨髓造血干细胞及其微环境代谢的影响及SHP2激活突变所致白血病的靶向调节作用,课题组给突变小鼠腹腔注射ASCT2的抑制剂(GPNA),显示相较于未处理的突变组,抑制组小鼠的脾脏较小,骨髓、脾脏、肺及肝脏等脏器中炎性细胞浸润减轻,发生 MPN 及白血病的几率很少,死亡率降低。同时与能量应激相关的p-mTOR信号分子也弱于未处理的突变组,证实了谷氨酰胺转运蛋白ASCT2在SHP2激活突变致骨髓增殖性肿瘤中的调控作用,提示ASCT2蛋白可能是一个新的治疗靶点。

图5 抑制小鼠ASCT2蛋白功能,可抑制MPN(和/或白血病)发病进程 ×20

