前列腺干细胞抗原及其单链抗体-碱性磷酸酶融合蛋白的表达与检测
尚国富,刘江丽,于 欢,唐开义,曾 柱,3,胡祖权,3,王 赟
前列腺癌是男性常见的癌症,也是男性癌症死亡三大原因之一[1]。前列腺癌的患病率在我国呈现迅速上升的趋势,该癌症成为危害我国男性健康的重要疾病[2]。因此,建立快速、有效的前列腺癌检测技术体系,对于临床诊断和治疗具有重要作用。前列腺干细胞抗原(prostate stem cell antigen, PSCA)是一种糖基磷脂酰肌醇锚定细胞表面蛋白,在前列腺组织中的表达有很高的特异性,其表达水平在前列腺癌组织中显著高于正常前列腺组织[3]。因此,PSCA被认为是诊断和预后前列腺癌的生物标志物,也是治疗的理想靶点[3-4]。该研究分别构建PSCA以及抗PSCA单链抗体(single-chain variable fragment, scFv)与碱性磷酸酶(alkaline phosphatase, AP)融合蛋白的原核表达体系,大量表达并检测其活性,为后期发展基于融合蛋白的免疫检测技术提供实验支持。
1 材料与方法
1.1 实验材料大肠杆菌BL21(DE3)、大肠杆菌XL1-Blue、pET-32a载体及pDAP2/S载体由华中农业大学分子生物技术实验室馈赠。pET-32a载体含有TrxA基因,PSCA基因构建到该载体中可诱导表达重组TrxA-PSCA融合蛋白,pDAP2/S载体含有AP基因,PaFv基因构建到该载体中可诱导表达重组PaFv-AP融合蛋白。T4 DNA连接酶、Taq聚合酶、RNAase、DNA Marker购自日本Takara公司;Tryptone、Yeast extract购自英国Oxoid公司;DNA凝胶回收试剂盒购自杭州爱思进生物技术有限公司;BCIP/NBT显色试剂购自武汉博士德生物工程有限公司;蛋白Marker购自美国Thermo-Fisher公司;抗His单克隆抗体、AP标记羊抗小鼠特异抗体、对硝基苯磷酸二钠(pNPP)购自美国Sigma-Aldrich公司;BCA蛋白质定量试剂盒购自天根生化科技(北京)有限公司。
1.2 PCR引物根据NCBI数据库中的PSCA基因序列,利用Primer Primer 5.0软件设计扩增PSCA成熟肽序列的引物,引物(表1)由南京金斯瑞生物科技有限公司合成。

表1 本研究引物序列表
1.3PSCA基因的扩增和PaFv基因的合成培养前列腺癌细胞,采用TRIzol法提取细胞总RNA,采用Oligo(dT)12-18引物反转录合成cDNA,再利用特异引物PHisF/PHisB进行PCR扩增获得PSCA基因。在50 μl反应体系中,分别加入2 μl cDNA、PHisF、PHisB和dNTPs,5 μl 10× PCR Buffer,0.5 μl Taq酶;PCR扩增反应条件为: 95 ℃预处理5 min; 94 ℃、1 min,55 ℃、1 min,72 ℃、80 s,30个循环;72 ℃、10 min。取2 μl PCR产物通过1.2%(W/V)琼脂糖凝胶电泳检测。
为了提高抗PSCA单链抗体PaFv的原核表达效率,根据大肠杆菌的遗传密码偏爱性,利用GenSmart Codon Optimization工具优化PaFv的密码子,由金斯瑞生物科技公司合成,同时在基因的5′端添加SfiI限制酶酶切位点,在3′端同时添加218连接肽和NotI限制酶酶切位点。
1.4 基因克隆与阳性克隆鉴定用BamHI和XhoI分别酶切PSCA目的基因和pET-32a载体,通过琼脂糖凝胶电泳后回收纯化,再在T4 DNA连接酶的作用下将目的基因连入载体中,获得可用于原核表达的pET-32a-PSCA重组载体。经热激法转化至大肠杆菌BL21(DE3)感受态细胞中,涂布于含有Amp (100 μg/ml)的LB培养板上,37 ℃培养15 h。挑取单克隆培养并利用载体特异引物TF/T7t进行PCR扩增检测,根据DNA条带大小鉴定阳性克隆,送公司测序验证。
用SfiI和NotI内切酶分别切割pDAP2/S载体的质粒DNA和PaFv目的基因,通过琼脂糖凝胶电泳回收纯化后,再在T4 DNA连接酶的作用下将目的基因连入载体中,获得可用于原核表达的pDAP2/S-PaFv重组载体。经热激法转化至XL1-Blue大肠杆菌感受态细胞中,涂布于含有Amp (100 μg/ml)的LB培养板上,37 ℃培养16 h。挑取单克隆培养并利用载体特异引物pDAP2-Spel/pDAP2-Sap进行PCR扩增鉴定,阳性克隆送公司测序验证。
1.5 TrxA-PSCA融合蛋白的原核表达与纯化取20 μl甘油保存的重组菌株BL21(DE3)/pET-32a-PSCA接种于20 ml含100 μg/ml Amp的2TY液体培养基[5]中,37 ℃、200 r/min振荡过夜培养后,取16 ml菌液接种至800 ml含100 μg/ml Amp的2TY培养基中,37 ℃、200 r/min振荡培养使其OD600 nm达到0.4~0.6时,加入终浓度为0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG),继续诱导表达5 h。超声波破碎提取TrxA-PSCA融合蛋白,在4 ℃条件下8 000 r/min离心5 min,取菌液上清液利用Ni-NTA基质纯化。纯化后的TrxA-PSCA融合蛋白经BCA定量试剂盒定量后,取4 μg上样进行SDS-PAGE检测。
1.6 PaFv-AP融合蛋白的原核表达取20 μl甘油保存的XL1-Blue/pDAP2/S-PaFv重组菌液,接种于20 ml含有100 μg/ml Amp的2TY液体培养基中,于37 ℃恒温摇床200 r/min培养12 h。取10 ml菌液转接到200 ml新鲜的含有100 μg/ml Amp的2TY培养基中,于37 ℃恒温摇床200 r/min培养使其OD600 nm达到0.5~0.6时,加入终浓度为0.5 mmol/L的IPTG诱导蛋白表达。在20 ℃条件下200 r/min诱导培养14 h。4 ℃、5 000 r/min离心10 min收集菌体,加入15 ml PBS缓冲液重悬菌体[5],经超声波破碎处理后,4 ℃、12 000 r/min离心10 min收集上清液。
1.7 Western blot分析取20 μl XL1-Blue/pDAP2/S-PaFv重组大肠杆菌大量表达的总蛋白经10%SDS-PAGE电泳后,利用半干转印仪将凝胶中的蛋白转印到NC膜上,放入5%脱脂奶粉溶液中封闭2 h后,再用1 ∶5 000稀释的抗His单克隆抗体室温孵育2 h,AP标记的二抗室温孵育2 h,最后用BCIP/NBT显色试剂显色。
1.8 AP显色反应及ELISA检测PaFv-AP融合蛋白的活性原核表达的PaFv-AP融合蛋白通过AP显色反应快速检测融合蛋白的AP活性[5],再通过ELISA反应检测融合蛋白的抗原结合特性。用PBS稀释TrxA-PSCA蛋白至20 ng/μl,取100 μl加入ELISA板孔中,37 ℃孵育2 h,PBS作为空白对照。加入200 μl PBS洗板3次后,每孔加入200 μl 2% (W/V) BSA溶液,37 ℃封闭2 h。甩干ELISA板中的封闭液,每孔加入200 μl PBS洗板3次。随后,每孔加入100 μl表达的PaFv-AP融合蛋白(20 ng/μl),37 ℃孵育1.5 h。用200 μl PBST和PBS分别洗涤3次后,加入100 μl 0.2%(W/V) pNPP显色液,黑暗条件下反应后用酶标仪在405 nm波长下测定OD值。

2 结果
2.1 目的基因的获取以cDNA为模板,利用特异引物通过PCR扩增获得PSCA目的基因,凝胶电泳检测显示目的片段约250 bp (图1A),与预期的大小一致。另外,根据大肠杆菌的遗传密码子的使用频率,优化抗PSCA单链抗体的编码基因,并添加内切酶酶切位点和218连接肽,合成PaFv基因片段,凝胶电泳检测结果如图1B所示,目的基因片段与预期的约850 bp相一致。

图1 PSCA基因及PaFv基因的电泳图
2.2 原核表达载体的构建重组载体pET-32a-PSCA转化大肠杆菌BL21(DE3)后,随机挑取5个单克隆转化子,PCR扩增结果显示5号克隆扩增出的DNA条带大小与预期一致(图2A)。公司测序结果确证PSCA基因成功构建到pET-32a载体中。重组载体pDAP2/S-PaFv转化大肠杆菌XL1-Blue后,PCR扩增结果显示1-3号克隆扩增出的DNA条带清晰明亮(图2B)。测序结果确证成功获得含有pDAP2/S-PaFv重组质粒的阳性转化子。

图2 PCR鉴定阳性转化子
2.3 蛋白的原核表达与检测重组菌株BL21(DE3)/pET-32a-PSCA在37 ℃、200 r/min条件下,0.5 mmol/L IPTG诱导表达5 h,纯化后获得的TrxA-PSCA融合蛋白浓度为0.40 mg/ml。SDS-PAGE电泳检测结果如图3A所示,在约28 ku处出现单一的目的条带,获得了纯度约85%的可溶性TrxA-PSCA融合蛋白。含有pDAP2/S-PaFv重组质粒的大肠杆菌通过IPTG诱导表达,超声波破碎处理提取总蛋白,经SDS-PAGE电泳和Western杂交检测。结果显示有单一的约90 ku大小的蛋白条带(图3B),与PaFv-AP融合蛋白的分子量相一致。
2.4 PaFv-AP融合蛋白的活性分析AP显色反应显示原核表达的PaFv-AP融合蛋白能够快速催化pNPP底物显色,其显色值高于对照组,差异有统计学意义(t=-67.945,P<0.001) (图4)。实验组平均读值为对照组9.2倍,说明融合蛋白可溶性表达并具有很强的AP活性。在ELISA孔中包被TrxA-PSCA重组蛋白,加入原核表达的PaFv-AP融合蛋白进行ELISA检测(图4),PaFv-AP融合蛋白的OD405 nm值与对照组相比,平均读值相差3.2倍,差异有统计学意义(t=-28.946,P<0.001),表明原核表达的PaFv-AP融合蛋白保留scFv和AP的活性,可用于PSCA蛋白的免疫学检测。
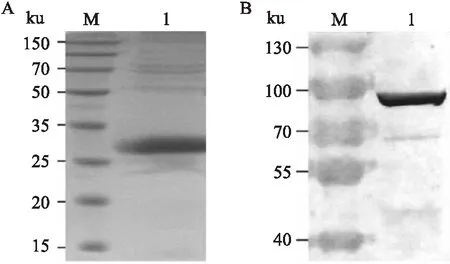
图3 TrxA-PSCA和PaFv-AP融合蛋白的表达鉴定

图4 AP显色反应和ELISA检测PaFv-AP融合蛋白的活性
3 讨论
PSCA是一种前列腺癌肿瘤相关抗原,由Reiter et al[3]在1998年研究前列腺癌的基因表达过程中发现。近年来的研究[3-4,6]表明PSCA的表达与前列腺癌患者的预后密切相关,可作为前列腺癌预后的指标以及晚期患者的治疗靶标。本研究克隆了人PSCA成熟肽的编码基因序列(78~314 bp),通过与促溶蛋白标签TrxA融合表达TrxA-PSCA蛋白作为免疫检测的抗原。
免疫学检测方法具备特异性好、灵敏度高、价格低廉和操作简单等优势,现已被广泛应用于疾病诊断及毒素检测分析等[7-9]。scFv是通过基因工程技术制备的具有完全抗原结合位点的最小抗体片断,对靶抗原的结合活性与天然抗体十分接近[10]。由于scFv的特殊小分子结构,蛋白糖基化修饰对其活性功能影响较小,可在大肠杆菌等原核生物中高效表达,纯化过程和操作简单[11]。更重要的是,scFv基因可根据表达的宿主细胞进行密码子优化来提高表达量、可溶性和活性等,也可在体外进行设计改造或与AP、细胞因子等蛋白质的编码基因通过基因工程操作融合表达,从而改变或增加scFv的特性[12-13]。scFv-AP融合蛋白用于抗原检测时不需要添加酶标记二抗,从而使免疫学检测过程大大加速,检测成本显著下降,应用前景十分广泛[5]。
本研究确定在IPTG终浓度为0.5 mmol/L时,37 ℃诱导培养5 h能够获得大量可溶性表达的TrxA-PSCA融合蛋白;在IPTG终浓度为0.5 mmol/L时,20 ℃诱导培养14 h能够高效可溶性表达PaFv-AP融合蛋白。AP显色反应和ELISA分析结果显示原核表达的PaFv-AP融合蛋白保留了scFv和AP的活性,但尚未达到检测应用的要求,后续将进一步优化表达条件后通过发酵大量生产融合蛋白,或通过分子建模和定点突变等技术提高融合蛋白的活性。本研究通过基因工程操作技术实现了PSCA抗原和PaFv-AP融合蛋白在大肠杆菌中的可溶性表达,为后续前列腺癌免疫诊断的应用研究奠定了实验基础。

