局部他克莫司间断应用对特应性皮炎患者皮肤胶原合成的影响
刘晓雪


[關键词]特应性皮炎;他克莫司;间断应用;皮肤胶原
[中图分类号]R758.22 [文献标志码]A [文章编号]1008-6455(2021)12-0063-04
Effect of Intermittent Application of Topical Tacrolimus on Skin Collagen Synthesis in Patients with Atopic Dermatitis
LIU Xiao-xue
(Department of Dermatology,People's Hospital of Xiangzhou District,Hubei Province,
Xiangyang 441000,Hubei,China)
Abstract: Objective To explore the effect of intermittent application of topical tacrolimus on skin collagen synthesis in patients with atopic dermatitis (AD). Methods A total of 104 AD patients admitted to our hospital from march 2018 to march 2020 were randomly divided into a control group (51 cases) and an observation group (53 cases). Both groups of patients were treated with tacrolimus ointment for the first stage of treatment. In the control group, the drug was stopped after the first stage of treatment, and if the disease recurred, the drug was continued. The usage and course of treatment were the same as the first stage. The observation group continued to use tacrolimus ointment for intermittent maintenance after the completion of the first phase of treatment. The pruritus in the first stage and the second stage before treatment in the two groups were compared. The clinical efficacy and recurrence of the two groups in the first and second stages of treatment were compared. The collagen content in the skin of the two groups before and after treatment at different times were compared. The adverse reactions of the two groups were compared. Results Before the treatment of the two groups, after the completion of the first stage, and 4 and 6 months after the start of the second stage, there were no significant differences in the visual analogue scale score (VAS) (P>0.05). The VAS scores of the observation group at 1, 2 months after the start of the second stage were lower than those of the control group (P<0.05). Compared with before treatment, the VAS scores at 1, 2, 4, 6 months after the start of the second phase of the two groups were lower (P<0.05). The total clinical effective rate after the completion of the first phase and 4 and 6 months after the start of the second phase, the recurrence rate 4 and 6 months after the start of the second phase of the two groups, the differences were not statistically significant (P>0.05). The total clinical effective rate of the observation group were higher than those of the control group at 1 and 2 months after the start of the second phase, of which the recurrence rate were lower than those of the control group (P<0.05). The first recurrence time of the observation group was longer than that of the control group, which of the number of recurrences was less than that of the control group, which of the recurrence duration was shorter than that of the control group (P<0.05). There were no significant differences in skin type I collagen content between the two groups before the treatment, after the completion of the first stage, and 4 and 6 months after the start of the second stage (P>0.05). The content of type I collagen in the skin of the observation group was higher than those in the control group 1 and 2 months after the second phase (P<0.05). There was no significant difference in the total incidence of adverse reactions between the two groups (P>0.05). Conclusion Intermittent application of local tacrolimus can relieve itching in patients, effectively delay and reduce AD recurrence, promote skin collagen synthesis, and is safe and reliable.
Key words: atopic dermatitis; tacrolimus; intermittent application; skin collagen
特应性皮炎(Atopic dermatitis,AD)是常见的慢性炎症性、复发性疾病,以皮肤大面积红斑、丘疹、干燥及顽固性瘙痒为主要临床表现,给患者工作与生活造成严重影响[1]。目前临床尚无AD根治方式,通常采用糖皮质激素类药物暂时控制病情,但长期使用容易导致皮肤萎缩、毛细血管扩张、色素沉着等不良反应[2]。他克莫司是一种大环内酯类钙调磷酸酶抑制剂,具有减轻炎性反应、调节免疫功能的作用,已有研究证实其外用软膏制剂在AD治疗中的有效性,但停药后患者仍面临着较高的复发风险,可能与皮损的亚临床炎症与皮肤屏障功能受损有关,且不同用药方案获取的整体收益存在一定差异[3-4]。胶原可促进成纤维细胞再生,加快皮肤组织代谢及创伤修复,是AD皮损修复的重要基础,目前鲜有关于他克莫司不同用药方案对AD患者皮肤胶原合成影响的研究。本研究以104例AD患者为研究对象,比较他克莫司传统用药方案与间断应用的临床疗效及对皮肤胶原合成的影响。现报道如下。
1 资料和方法
1.1 一般资料:选取2018年3月-2020年3月笔者医院接诊的104例AD患者,随机分为对照组和观察组。对照组51例,男28例,女23例,年龄18~64岁,平均(38.25±5.34)岁;病程2个月至10.5年,平均(5.14±0.71)年,瘙痒程度视觉模拟评分(Visual analogue scale,VAS)2~5分,平均(3.59±0.42)分,湿疹面积及严重度指数评分(Eczema area and severity index,EASI)[5]1.86~4.57分,平均(3.22±0.38)分;研究组53例,男29例,女24例,年龄19~62岁,平均(38.14±5.47)岁;病程3个月至10年,平均(5.07±0.82)年;VAS评分2~5分,平均(3.47±0.51)分;EASI评分1.75~4.42分,平均(3.19±0.40)分。两组性别、年龄、病程、VAS评分、EASI评分比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准通过,所有患者签署知情同意书。
1.2 纳入和排除标准
1.2.1 纳入标准:①符合《中国临床皮肤病学》中AD诊断标准[6],表现为皮肤瘙痒、红斑、干燥等症状;②Rajka and Langeland标准判断病情为中度或重度[7];③AD复发时可于3d内至医院治疗;④精神正常,可配合完成治疗及随访。
1.2.2 排除标准:①AD皮损部位伴有严重感染;②大环内酯类药物过敏者;③入组前7d内外用其他免疫抑制药物或糖皮质激素;④2周内系统性使用其他免疫抑制剂及皮质类固醇;⑤6周内使用光疗者;⑥合并自身免疫性疾病、慢性感染性疾病、糖尿病、血液系统疾病;⑦合并肝、肾等主要脏器功能异常;⑧妊娠或哺乳期女性。
1.3 方法
1.3.1 第一阶段:所有患者均采用他克莫司软膏[国药准字号:H20133243,浙江万晟药业有限公司,10g:3mg(0.03%)]外用涂抹患处,2次/天,连续使用6周。
1.3.2 第二階段:对照组第一阶段治疗完成后即停止使用他克莫司软膏,如病情复发,继续使用他克莫司软膏涂抹患处,用法与疗程同第一阶段;观察组第一阶段治疗完成后继续采用他克莫司软膏间歇维持治疗,每周一、周四使用1次,如病情复发,按照第一阶段的用法与疗程用药。两组治疗过程中避免使用免疫抑制剂、糖皮质激素及紫外线治疗等相关措施,均随访6个月。
1.4 观察指标
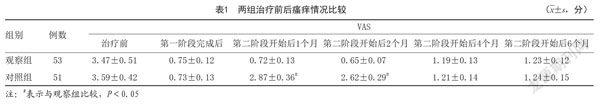
1.4.1 两组治疗前后瘙痒情况:治疗前、第一阶段完成后及第二阶段开始后1、2、4、6个月采用VAS评分评价患者瘙痒情况,分数越高,瘙痒情况越严重。
1.4.2 两组治疗第一阶段、第二阶段临床疗效及复发情况:第一阶段完成后,第二阶段开始后1、2、4、6个月评估两组EASI评分,根据《中国特应性皮炎诊疗指南》判断疗效[8]。治愈:EASI评分降低≥90%;显效:60%≤EASI评分<90%;有效:20%≤EASI评分<60%;无效:未及以上标准。总有效率=(治愈+显效)例数/总例数×100%。
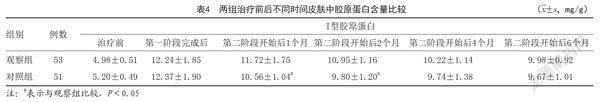
1.4.3 两组治疗前后不同时间皮肤中胶原蛋白含量:治疗前、第一阶段完成后及第二阶段开始后1、2、4、6个月,采用4mm环钻切取患者相同部位非曝光皮损,皮肤组织固定于4%多聚甲醛中,石蜡包埋,盐析法测定皮肤中I型胶原蛋白含量。将皮肤组织与1ml PBS混合,匀浆器10 000r/min离心10min匀浆,胃蛋白酶消化,用4.4、2.4、1.7mol/L氯化钠溶液抽提,获取上清即为I型胶原蛋白,0.001mol/L乙酸透析,测定490nm位置吸光度值,根据标准曲线测定I型胶原蛋白浓度。
1.4.4 不良反应:统计两组治疗及随访期间灼烧感、脓疱疮、卡波西水痘样疹、毛囊炎、股癣等不良反应发生情况。
1.5 统计学分析:数据的处理与分析采用统计学软件SPSS 19.0进行,计量资料以(x¯±s)表示,两两样本的比较采用t检验;计数资料以[n(%)]表示,理论频数为0时,采用Fisher精确检验,理论频数为1~5时采用校正χ2检验,>5时采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后瘙痒情况:两组治疗前、第一阶段完成后及第二阶段开始后4、6个月VAS评分比较,差异无统计学意义(P>0.05);观察组第二阶段开始后1、2个月VAS评分低于对照组,差异有统计学意义(P<0.05);与治疗前比较,两组第一阶段完成后,第二阶段开始后1、2、4、6个月VAS评分均降低,差异有统计学意义(P<0.05)。见表1。
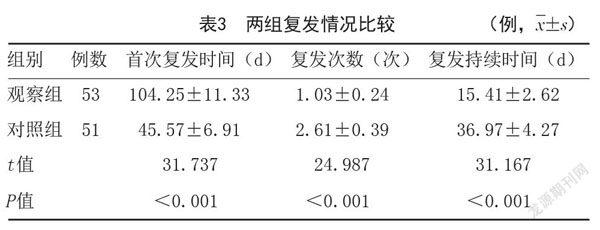
2.2 两组治疗第一阶段、第二阶段临床疗效及复发情况:两组第一阶段完成后,第二阶段开始后4、6个月临床总有效率,第二阶段开始后4、6个月复发率比较,差异无统计学意义(P>0.05);观察组第二阶段开始后1、2个月临床总有效率高于对照组,复发率低于对照组,差异有统计学意义(P<0.05);观察组首次复发时间长于对照组,复发次数少于对照组,复发持续时间短于对照组,差异有统计学意义(P<0.05)。见表2~3。
2.3 两组治疗前后不同时间皮肤中胶原蛋白含量:两组治疗前,第一阶段完成后及第二阶段开始后4、6个月,皮肤中I型胶原蛋白含量比较,差异无统计学意义(P>0.05);观察组第二阶段开始后1、2个月,皮肤中I型胶原蛋白含量高于对照组,差异具有统计学意义(P<0.05)。见表4。
2.4 不良反应:两组不良反应总发生率比较,差异无统计学意义(P>0.05)。两组不良反应均在治疗初期出现,且程度较轻,经对症处理后显著好转,随后很快耐受。见表5。
2.5 典型病例
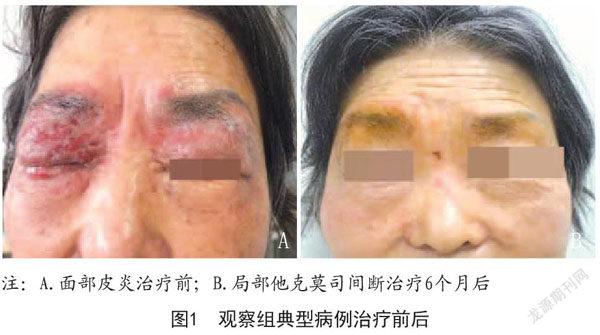
2.5.1 病例1:张某,女,62岁。治疗前表现为皮肤大面积红斑、丘疹、干燥,顽固性瘙痒。采用局部他克莫司间断治疗,治疗6个月后红斑面积显著缩小,干燥、瘙痒等症状显著好转。见图1。
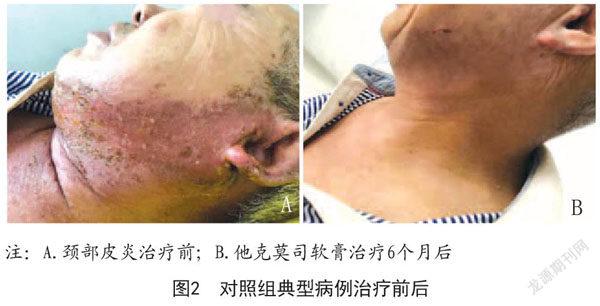
2.5.2 病例2:李某,男,60岁,治疗前表现为皮肤大面积红斑、丘疹、干燥,顽固性瘙痒。第一阶段治疗完成后即停止使用他克莫司软膏,2个月后复发,继续使用他克莫司软膏治疗4个月后显著好转。见图2。
3 讨论
AD好发于学龄前儿童,但近年来成人发病率呈不断增加趋势,患者常因剧烈的瘙痒及外观改变导致生活质量严重降低[9]。目前关于AD的确切发病机制仍处于探索阶段,通常认为与遗传、环境、免疫及精神等因素相关[10]。他克莫司属于外用非皮质类固醇免疫调节剂,其用于AD治疗可阻断抗原特异性T细胞活化,抑制钙调磷酸酶活性,从而减少炎性细胞因子释放,快速缓解瘙痒与红肿[11-12]。尽管多数AD患者的急性炎症经他克莫司治疗后可被有效控制,但仅依赖皮损程度及面积决定用药的被动治疗方案常伴有较高的AD复发风险。因此,相较于暂时控制AD急性炎性反应,长期控制、减少其复发更为重要,他克莫司间断治疗进入临床研究人员的视野。
本研究结果显示,观察组第二阶段开始后1、2个月VAS评分低于对照组,临床总有效率高于对照组,复发率低于对照组,首次复发时间长于对照组,复发次数少于对照组,复发持续时间短于对照组,提示他克莫司间断应用可有效控制病情,减轻瘙痒,延缓、减少病情复发。研究显示[13-14],处于缓解期的AD患者,尽管未表现出明显症状,但仍伴有亚临床炎症及局部淋巴细胞浸润,并且炎性因子受体的亲和力增强,易发生炎性反应。在第一阶段治疗完成后仍规律使用他克莫司,可持续性抑制亚临床炎症,逐渐改善并恢复皮肤功能,并且减轻患者心理及情绪压力,避免突然停药导致患者失去治疗信心。此外,AD患者皮肤组织长期存在水分缺失、角质层长链脂肪酸片段减少等问题,降低皮肤屏障功能,这也是AD复发的主要原因,同时是缓解期间断使用他克莫司的理论基础。随着第二阶段长时间使用他克莫司,两组患者疗效及复发情况趋近,分析原因与患者对他克莫司逐渐耐受有关。
胶原广泛分布于组织细胞中,以角膜、韧带、肌腱及皮肤中含量最为丰富,具有促进表皮细胞增殖、自我修复的功能,其中皮肤胶原蛋白的成分以I型胶原蛋白为主。研究发现[15-16],AD皮损中局部组织成分损伤尤其是胶原蛋白含量的变化可能是导致病情反复的主因之一。本研究结果显示,观察组第二阶段开始后1、2个月皮肤中I型胶原蛋白含量高于对照组,提示他克莫司间断用药可促进皮肤胶原蛋白合成。尽管经第一阶段治疗后可获取接近100%的有效率,但其皮肤修复是一个长期的过程,规律间断使用他克莫司可持续调节T淋巴细胞活性,促进成纤维细胞增殖,增加皮肤胶原合成,维持皮肤形态结构,减少皮肤水分散失,恢复皮肤屏障功能。此外,本研究发现,两组治疗及随访期间不良反应总发生率比较,差异无统计学意义,且程度均较轻,提示他克莫司的两种用药方案均具有安全性。第二阶段使用他克莫司时为每周2次,药量小,且经皮吸收量极少,可在提升疗效的同时避免药物长期使用导致的不良反应,安全可靠。
综上所述,局部他克莫司间断应用可有效減轻患者瘙痒,延缓、减少AD复发,促进皮肤胶原合成,且安全可靠。
[参考文献]
[1]Langan SM,Irvine AD,Weidinger S,et al.Atopic dermatitis[J].Lancet,
2020,396(10247):345-360.
[2]Vakharia PP,Silverberg JI.Adult-onset atopic dermatitis:characteristics and management[J].Am J Clin Dermatol,2019,20(6):771-779.
[3]Calzavara-Pinton P,Fabbrocini G,Girolomoni G,et al.Topical tacrolimus in adult atopic dermatitis:a consensus based on a 15-year experience[J].G Ital Dermatol Venereol,2020,155(1):8-13.
[4]Perälä M,Ahola M,Mikkola T,et al.Young children with moderate-to-severe atopic dermatitis can be treated safely and effectively with either topical tacrolimus or mild corticosteroids[J].Acta Paediatr,2020,109(3):550-556.
[5]赵辨.湿疹面积及严重度指数评分法[J].中华皮肤科杂志,2004,37(1):3-4.
[6]赵辨.中国临床皮肤病学[M].南京:江苏科学技术出版社,2010:66-67.
[7]Emerson RM,Charman CR,Williams HC.The nottingham eczema severity score:preliminary refinement of the rajka and langeland grading[J].Br J Dermatol,2000,142(2):288-297.
[8]中华医学会皮肤性病学分会免疫学组、特应性皮炎协作研究中心.中国特应性皮炎诊疗指南(2014版)[J].中华皮肤科杂志,2014,47(7):511-514.
[9]Cork MJ,Danby SG,Ogg GS.Atopic dermatitis epidemiology and unmet need in the United Kingdom[J].J Dermatolog Treat,2020,31(8):801-809.
[10]Katoh N,Ohya Y,Ikeda M,et al.Japanese guidelines for atopic dermatitis 2020[J].Allergol Int,2020,69(3):356-369.
[11]Mudaliyar VR,Pathak A,Dixit A,et al.An open-label prospective study to compare the efficacy and safety of topical fluticasone versus tacrolimus in the proactive treatment of atopic dermatitis[J].Dermatol Pract Concept,2020,10(4):e2020094.
[12]Dähnhardt D,Bastian M,Dähnhardt-Pfeiffer S,et al.Comparing the effects of proactive treatment with tacrolimus ointment and mometasone furoate on the epidermal barrier structure and ceramide levels of patients with atopic dermatitis[J].J Dermatolog Treat,2020,3:1-9.
[13]Saini S,Pansare M.New insights and treatments in atopic dermatitis.[J].Pediatr Clin North Am,2019,66(5):1021-1033.
[14]Dinulos JG,Trickett A,Crudele C.New science and treatment paradigms for atopic dermatitis[J].Curr Opin Pediatr,2018,30(1):161-168.
[15]Hakuta A,Yamaguchi Y,Okawa T,et al.Anti-inflammatory effect of collagen tripeptide in atopic dermatitis[J].J Dermatol Sci,2017,88(3):357-364.
[16]Manfredini M,Liberati S,Ciardo S,et al.Microscopic and functional changes observed with dynamic optical coherence tomography for severe refractory atopic dermatitis treated with dupilumab[J].Skin Res Technol,2020,26(6):779-787.
[收稿日期]2020-12-08
本文引用格式:劉晓雪.局部他克莫司间断应用对特应性皮炎患者皮肤胶原合成的影响[J].中国美容医学,2021,30(12):63-67.

