穿龙薯蓣茎段组培体系的建立
党裳霓, 刘 影, 高润梅
(山西农业大学林学院, 山西 太谷 030801)
穿龙薯蓣(Dioscoreanipponica)为薯蓣科(Dioscoreaceae)多年生缠绕草质藤本,广泛分布于我国东北、华北、西北(除新疆)及河南、山东、安徽、浙江、江西 (庐山) 、陕西 (秦岭以北) 、四川等地[1]。其根状茎是提取药用成分薯蓣皂甙的重要原料[2]。目前对药源材料的需求持续增加,但穿龙薯蓣野生资源量日趋减少,已处于濒危状态,属国家二级保护植物[3]。生产上虽可通过根状茎繁殖或播种的方法解决对药源材料的需求,但人工栽培存在许多不足,如以根状茎繁殖,不仅要消耗大量的根状茎,而且难以保证药材质量,繁殖速度较慢,人工栽培一般3年后采收;如采用种子进行繁殖,不仅萌发率低,苗期长,且定植5年后才可采收[4-6]。组织培养技术已广泛应用于植物良种培育与快速繁殖,为穿龙薯蓣的大规模种植开辟了新途径,对解决生产中种苗缺乏的突出矛盾,提高穿龙薯蓣的产量和品质具有重要意义[7]。本试验以穿龙薯蓣幼嫩带节茎段为试材,分析消毒时间、培养基激素配比对该种腋芽诱导、继代培养和生根培养等的影响,以期建立稳定、高效的穿龙薯蓣离体再生体系,实现穿龙薯蓣生产的产业化,促进穿龙薯蓣种植产业的健康发展。
1 材料和方法
1.1 植物材料
穿龙薯蓣植株引种自山西省阳城县蟒河国家级自然保护区,2015年春栽种于山西农业大学林学院苗圃。
2016年6月,取生长健壮的穿龙薯蓣植株幼嫩茎段,剪成长1.5~2 cm的带芽茎段,置于饱和洗衣粉溶液的烧杯中清洗后流水持续冲洗30 min,再用蒸馏水冲洗3遍。将供试材料放入超净工作台进行消毒[8]。
1.2 外植体消毒
75%酒精外植体表面消毒30 s后,以0.1% HgCl2进行消毒处理,分别设置3 min、5 min和8 min的处理时间,比较不同时间处理的消毒效果。接种30 d后,统计茎段的褐化死亡率、污染率和萌芽率。其中外植体无污染、未褐变视之为成活,之后有效回收HgCl2[9]。
1.3 茎段离体培养
试验所用的培养基中均添加蔗糖30 g·L-1,琼脂7 g·L-1,pH调至6.0,121 ℃高压灭菌30 min。所有培养物均于(25±1)℃的恒温培养箱中培养,光照强度1 500 lx,光暗各12 h。
1.3.1诱导培养基激素配比
采用3因素3水平的正交试验设计。3个因素为基本培养基、NAA、6-BA,其中,选取3种培养基MS、B5、1/2 MS;NAA选取0、0.1 mg·L-1和0.2 mg·L-13个浓度水平;6-BA选取0、1.0 mg·L-1和2.0 mg·L-13个浓度水平,试验共有9种组合培养基。外植体按适宜消毒时间处理后,分别接种于上述9种培养基中,每种培养基接种20瓶,每瓶接种3个外植体,接种30 d后统计茎段的污染率、褐化死亡率及萌芽率。
1.3.2增殖培养基激素配比
采用2因素3水平实验设计。将初代培养得到的瓶苗剪成1~2 cm带一叶一节的茎段转接到增殖培养基中。2因素为NAA、6-BA,其中,NAA选取0.1 mg·L-1、0.2 mg·L-1和0.3 mg·L-13个浓度;6-BA选取1.0 mg·L-1、2.0 mg·L-1和3.0 mg·L-13个浓度水平,试验共有9种组合。每个处理方式接种20瓶,每瓶接种3株。以30 d为1个继代周期,继代3次后转入生根培养基,统计增殖系数和丛生芽数,观察芽的长势。
1.3.3生根培养基激素配比
以1/2 MS为基本培养基,添加不同浓度的IBA、6-BA、NAA于培养基中,进行生根培养。将生长至3~4 cm长势较为健壮的芽苗转入不同生根培养基中进行根诱导。其中,NAA选取0.1 mg·L-1、0.2 mg·L-1、0.5 mg·L-1和1.0 mg·L-14个梯度;6-BA浓度设置为1.0 mg·L-1;IBA浓度设置为0.5 mg·L-1。每种培养基接种30瓶,每瓶接种3株,60 d后观察不同处理之间的生长状况、生根率、根数、根长及株高情况。
1.3.4瓶苗移栽
由于组培苗幼嫩,一直处于可控的环境下生长,抗性较低。所以移栽前要先炼苗,提高其成活率。
将生根培养后生长良好的试管苗移至(25±1)℃、50%~70%遮阴度的大棚内,进行光培炼苗,自然光下闭瓶炼苗3 d[10]。再将封口膜取下2~3 d,炼苗过程中,每天选择光照弱的时候通风2次,每次30 min[11]。取出幼苗,洗去根部琼脂,移栽于蛭石∶腐殖土∶河沙=1∶1∶1的基质中[12]。并在移栽后满足组培苗所需水分,保持较高的湿度,每天喷雾喷施适量水,20 d后统计移栽成活率。
1.4 数据分析
采用Microsoft Excel、SPSS、DPS软件对试验数据进行统计分析,显著水平为0.05和0.01。
2 结果与分析
2.1 消毒时间对外植体的影响
以污染率、褐化死亡率和萌芽率为评价指标,分析0.1% HgCl2不同消毒时间对外植体的影响,见表1。

表1 消毒时间对外植体灭菌效果的影响
由表1可知,HgCl2消毒不同时间,对萌芽率的影响达显著水平(p<0.01),随着灭菌时间的增加,污染率逐渐降低,在5 min时外植体萌芽率最高(83.33%)。由于材料较幼嫩,消毒时间继续延长,外植体褐化死亡现象加重,萌芽率显著下降,在8 min时死亡率达36.67%,萌芽率降到58.33%。可见,以0.1% HgCl2作为腋芽诱导外植体消毒溶液,消毒时间以5 min为宜。
2.2 蓣茎段腋芽诱导NAA与6-BA浓度的优化
以萌芽率为评价指标,结合腋芽生长情况,分析不同处理对腋芽萌发的影响,结果见表2。

表2 不同浓度NAA与6-BA组合对腋芽萌发的影响
由表2可知,基本培养基类型、2种外源激素NAA和6-BA的浓度对腋芽诱导效果存在显著差异(p<0.01),2.0 mg·L-16-BA对腋芽萌发的效果较好,1.0 mg·L-1次之。在MS、1/2 MS和B5培养基中,2.0 mg·L-16-BA时萌芽率较高,分别为86.67%、75.00%和73.33%。因此,在0~2.0 mg·L-1的6-BA浓度范围内,萌芽率随6-BA浓度增加呈上升趋势,且MS培养基是腋芽诱导的适宜培养基。结合萌芽率和生长状况等,不定芽诱导的适宜培养基为MS+0.2 mg·L-1NAA+2.0 mg·L-16-BA,萌芽率为86.67%,且生长势好,叶色浓绿。
2.3 腋芽继代培养
对不同激素配比培养条件下不定芽的增殖情况进行极差分析,如表3所示。
由表3可知,6-BA对穿龙薯蓣再生苗的增殖影响大于NAA的影响。从不同处理的平均萌芽率(k)的大小可以看出,穿龙薯蓣不定芽增殖培养的适宜水平激素组合为 0.2 mg·L-1NAA+ 3.0 mg·L-16-BA,增殖系数为4.58;6-BA浓度为1.0 mg·L-1和2.0 mg·L-1时,苗弱发黄,长势较弱;6-BA浓度为3.0 mg·L-1时,不仅增殖率高,而且幼苗健壮,叶色淡绿,生长速度快。因此,较低的NAA/6-BA浓度比显著促进穿龙薯蓣芽增殖。

表3 不同浓度NAA与6-BA组合对增殖系数影响的极差分析
2.4 生根培养
将经继代培养后高达3 cm的小植株,接种于添加不同激素的1/2 MS生根培养基上。10 d左右开始出现白色根原基,20 d左右组培苗茎段底部逐渐出现白色根,一个月后小苗生根趋于稳定。
方差分析结果(表4)表明,添加单一激素NAA生根效果明显优于其它处理。与其它处理相比,1号培养基生根效果最好,诱导的根系粗壮且生长较快,叶色浓绿,有明显主根,生根率达到峰值73.34%。而对照的生根率仅次于1号培养基,说明在不添加外源激素的情况下,同样可以诱导生根,生根率为60.02%,但根较细弱,叶色黄绿,无明显的主根,多为须根。随着NAA浓度增加,穿龙薯蓣根的长势表现出先增后减的趋势。NAA浓度为0.1 mg·L-1和0.5 mg·L-1时利于芽苗生根,浓度过高(1.0 mg·L-1)生根率会降低,影响生根效果。在NAA基础上添加6-BA或IBA时,生根率低,且株高、根数和根长均低于含单一激素NAA(处理1、2、3)和对照。

表4 不同植物生长调节剂对生根培养的影响
生根后的幼苗在上述6种培养基培养10 d、20 d、45 d和60 d后,株高见图1 。
由图1可知,生根培养前20 d内,培养基浓度对幼苗株高影响差异不显著(p<0.05),但对培养45 d(C)和60 d(D)的幼苗株高存在显著影响(p<0.05)。不同的培养时间段,1号培养基幼苗株高均高于其他5种处理:10 d的株高为2.48 cm,20 d的株高为5.05 cm,45 d的株高为7.51 cm,60 d时株高达8.68 cm,生长状况最好,株高增幅显著;其次是ck、2号和3号培养基;45 d和60 d幼苗株高1号培养基比ck分别高3.42 cm和4.02 cm。由此可见,生根率和生根情况以及平均株高可作为综合评价组培苗的指标体系。在NAA基础上,添加IBA和6-BA对促进芽苗生根的影响作用较小。

注:不同小写字母示处理间在0.05水平上差异显著。下同。
对60 d内不同浓度生根培养基的组培苗的根数和根长进行方差分析,结果见图2。由图2可知,不同组培苗之间生根数和根长存在一定差异。平均根数和根长在不同浓度的培养基间的差异显著(p<0.05)。其中1号培养基的平均根数13.2条,而5号培养基仅3.4条(图2 A);1号培养基的根长达2.79 cm,而5号培养基根长仅0.8 cm(图2 B)。因此,单一激素NAA与2种激素组合相比,前者诱导生根的效果明显优于后者。由于穿龙薯蓣地下生物量和地上生物量成正比关系,NAA浓度为0.1 mg·L-1时,生根率达到峰值,株高、根数和根长增幅显著,生长状况较好。因此适宜生根培养基为1/2 MS+0.1 mg·L-1NAA。
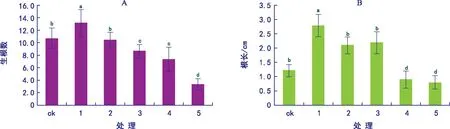
图2 不同浓度的激素组合对生根数和根长的影响
2.5 瓶苗移栽
本次试验选用腐质土∶蛭石∶河沙=1∶1∶1混合物作为移栽基质,炼苗后移栽时基质的选择对组培苗能否成活起着重要作用。而腐质土、蛭石和河沙的混合物是较为理想的基质,通透性与保水性较好,将基质混合均匀且在121 ℃灭菌30 min。移栽初期,组培苗幼嫩,不适应新环境,呈现萎蔫状态。移栽14 d左右,组培苗恢复正常,并长出1~2片新叶,长势良好,移栽存活率可达63.20%(见图3)。

注:A为初代培养芽诱导(MS+0.2 mg·L-1 NAA+2.0 mg·L-1 6-BA);B为第1次继代培养(MS+0.2 mg·L-1 NAA+3.0 mg·L-1 6-BA);C为第2次继代培养 (MS+0.2 mg·L-1 NAA +3.0 mg·L-1 6-BA);D为第3次继代培养(MS+0.2 mg·L-1 NAA+3.0 mg·L-1 6-BA);E为生根培养(1/2 MS+ 0.1 mg·L-1 NAA );F为移栽成活的试管苗。
3 讨论与结论
3.1 讨 论
对于处于濒危状态的物种通过组织培养技术进行大规模繁殖,利于其种质资源的保存,但不同的物种其培养条件各异[13]。
取大田栽培的穿龙薯蓣地上幼嫩带节茎段,较难获得无菌外植体。消毒时间的选择也需谨慎,因为材料较幼嫩,若消毒时间过短,则会出现大面积的污染,从而失去宝贵的试验材料,增加成本;若消毒时间过长,虽可降低污染率,但同时会导致接入培养基后存活率的降低或抑制其生长,加重外植体死亡与褐化现象的发生[14]。且HgCl2毒性大,易残留,环境污染风险高,对使用和回收要求高[15-16]。
生长素和细胞分裂素相互配合在植物离体培养中能够对细胞的分裂与分化、形态建成、控制器官的分化均有着重要的调节作用[17],并且不同组培阶段所需的外源激素种类、浓度和配比不完全相同,对试验结果有相当大的影响[18-20]。在一定浓度范围内,细胞分裂素与生长素的浓度比是关键指标,对芽与根的萌发与发育有重要的影响。生长素与细胞分裂素比值高时,会导致植株的膨大生长,减弱芽生长,利于生根,比值较低时相反[21],有研究甚至提出对带芽茎段萌芽率诱导的比值为10时,腋芽萌发率最高[22]。本研究中,细胞分裂素对芽诱导和芽增殖影响显著,而生长素对2个培养阶段无明显影响。芽诱导的适宜培养基NAA和6-BA激素浓度的比值为10。根诱导是植物组织培养过程中的关键环节,只有诱导出健壮、发达的根,组培苗才能成功移栽。本次试验中,通过比较生根率、根数和根长,并结合组培苗的株高与生长状况,认为单一激素NAA的生根效果优于2种激素组合。
光是植物生长不可缺少的条件,光照强度对植物生长率、叶片数量和株高有重要意义[23]。研究表明,光照强度低时,植物会通过消耗自身的物质来扩大接收光能的面积,同时光合作用的速度减慢,光合作用产物的积累变少,不利于植物生长[24]。由于光照强度影响光合色素合成,叶绿素含量与叶色显著相关[25]。因此,光照强度对植物组培苗的影响主要体现在苗色变化上[26]。本研究发现,穿龙薯蓣腋芽诱导的芽苗转接到增殖培养基后,苗色由深绿变为浅绿。芽苗继代培养与初代培养相比,需要更强的光照,本试验的苗色变化可能是由光照强度减弱引起的,所以一个继代周期后,选择透光性好的培养瓶,芽苗接收光照更充分,苗色逐渐恢复。
3.2 结 论
本研究以穿龙薯蓣幼嫩带芽茎段为外植体,通过对消毒时间、诱导培养基、继代培养基和生根培养基激素配比进行对比优化,构建茎段再生体系如下:
1) 以0.1% HgCl2作为腋芽诱导外植体消毒溶液的消毒时间以5 min为宜。
2) MS+0.2 mg·L-1NAA+2.0 mg·L-16-BA为诱导腋芽的适宜培养基。
3) MS+0.2 mg·L-1NAA+3.0 mg·L-16-BA芽增殖分化效果好。
4) 1/2 MS+0.1 mg·L-1NAA为适宜生根培养基。
5) 腐殖土∶蛭石∶沙河=1∶1∶1作为移栽基质,幼苗成活率高。

