温针灸与骨髓间充质干细胞移植对兔膝骨性关节炎模型血清中MMP-1、 MMP-13和IL-10表达的影响
张艳玲,杨 磊,刘君伟,陈人智,马遇原,武永利,3
膝骨性关节炎(KOA)是由软骨外基质降解与修复动态失衡,致膝关节功能障碍的疾病。基质金属蛋白酶-1、13(MMP-1、13)可直接降解对软骨基质起支撑作用的Ⅱ型胶原,加重膝关节炎症反应和临床症状。抗炎因子白介素-10(IL-10)能够促进成骨细胞的增殖与分化,抑制破骨细胞破坏以减缓KOA进展。骨髓间充质干细胞(BMSCs)具有免疫抑制和抗炎作用,在KOA软骨缺损修复治疗中具有重要作用,温针灸治疗KOA疗效确切[1]。本实验探讨温针灸联合 BMSCs 移植对KOA的治疗作用,研究其效果与炎症因子表达水平的相关性。
1 资料与方法
1.1 一般资料
1.1.1 实验动物及细胞系:50只新西兰大耳兔均为6月龄,体重2.5~3 kg,购自宁夏医科大学实验动物中心(动物许可证号:SCXK2016-0007),雌雄不分。实验过程中的动物相关操作符合动物伦理学要求。2018年7月-2019年9月在宁夏医科大学实验动物中心完成动物实验,在重点实验室完成实验操作。BMSCs(RBXMX-01001)购自赛业生物公司。
1.1.2 实验动物分组与造模:将50只大耳兔随机分为5组(n=10),即:空白组(CT组)、模型组(Model组)、温针灸组(WNM组)、骨髓间充质干细胞组(BMSCs组)、温针灸联合骨髓间充质干细胞组(WNM+BMSCs组)。除CT组外,采用右后肢伸直位石膏管型固定其余4组,固定6周以制备中期兔KOA模型,造模成功后,进行试验干预。
1.2 主要试剂:BMSCs完全培养基(赛业生物公司,批号:RBXMX-90011);L-DMEM培养基、胎牛血清、胰蛋白酶、青霉素、链霉素(Gibco);ELISA 试剂盒(碧云天生物科技有限公司);全蛋白提取试剂盒、一抗:MMP-1、MMP-13单克隆抗体(Abcam),山羊抗兔二抗(BOSEN);细胞培养箱(Sanyo)。
1.3 实验方法
1.3.1 细胞培养与传代:将购买的P1代兔源的BMSCs培养在兔间质干细胞完全培养基中,常规培养,此后依据细胞生长情况2~3 d换液1次。7~8 d后,倒置显微镜下观察细胞可达到达80%~90%融合率后,进行传代培养至P3代为实验对象。
1.3.2 自体血小板裂解液制备:造模前将WNM组、BMSCs组兔抽取耳背静脉血10 mL,放入含抗凝剂的离心管中,以5 000 r/min,离心20 min后获取上层清液,分装后于-20 ℃冰冻12 h后,保存于-80 ℃冰箱中;经37 ℃水浴融化,再次离心(5 000 r/min,20 min)后使用。
1.3.3 BMSCs悬液制备:预热完全培养基、血小板裂解液、0.25%胰蛋白酶至37 ℃,P3代BMSCs用胰酶消化3 min,镜下见细胞突起回缩,形态近卵圆形时,用含血清的完全培养基终止消化。仔细吹打后离心5 min(1 000 r/min),小心弃去上清液,重悬加入的自体血小板裂解液,调整细胞浓度至1×106/mL,分装30支0.5 mL的BMSCs悬液备用。
1.3.4 治疗方法与标本收集:在相同的无菌实验环境下,对造模成功后的各组兔给予相应干预,1个疗程7 d,共处理2个疗程,5组实验兔于疗程结束当天同时取材。① CT组:不予处理,正常饲养。②Model组:仅每天固定于兔架上15 min,不做其它干预。③ WNM组:先针刺内外膝眼、鹤顶、足三里穴,针刺得气后,将针柄上端施加艾条(1 cm)由近端点燃,每个穴位施灸3壮,每日1次。④ BMSCs组:0.5 mL的BMSCs悬液(P3,1×106个)通过内膝眼向关节腔内注射治疗,每个疗程注射1次。⑤WNM+BMSCs组:每个疗程的第1天先通过内膝眼向关节腔内注射0.5 mL经自体血小板裂解液悬浮的BMSCs(P3,1×106个),剩余6 d给予温针灸治疗。2个疗程后试验兔耳缘静脉空气栓塞处死,经腹主动脉采血,室温血液自然凝固20 min,3 000 r/min离心5 min,仔细吸取血清放入EP试管中,保存于-70 ℃冰箱中,统一检测。
1.3.5 软骨损伤评分:对实验兔膝关节软骨组织,依据 Mankin 法[2]进行损伤程度评分。①软骨结构:正常,0 分;表面不平整,1 分;表面不平整且有血管翳形成,2分;裂隙进入过渡层,3分;裂隙进入辐射层,4分;裂隙进入钙化层,5分;结构完全破坏,6 分。②软骨细胞:正常,0 分;细胞呈弥漫性增加,1 分;局部细胞明显增多,2 分;细胞数目明显减少,3 分。③软骨基质染色:正常,0 分;轻度减少,1 分;中度减少,2 分;重度减少,3 分;无着色,4 分。④ 潮线完整性:完整性良好,0 分;完整性差,1 分。
1.3.6 ELISA 法检测细胞因子表达:兔KOA血清中MMP-1和 MMP-13、IL-10的含量使用 ELISA 法检测,具体步骤按试剂盒说明进行操作。
1.3.7 Western blot 检测:提取培养干预后各组细胞总蛋白;按照BCA试剂盒操作步骤,配置10%的分离胶和4%的浓缩胶,对蛋白含量进行测定;经过上样、电泳及转膜后,加入一抗(浓度为1∶100),4 ℃轻摇过夜;完成孵育、洗膜后,选择与一抗来源合适的二抗工作液(浓度为1∶10 000),室温轻摇1 h;二抗孵育完成后再洗膜,辣根过氧化物酶 HRP-ECL 发光法曝光,进行统计分析。
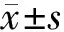
2 结果
2.1 各组Mankin评分比较:Model组Mankin评分高于CT组(P<0.05);治疗后WNM组、BMSCs组、WNM+BMSCs组Mankin评分均比MX组低(P<0.05),但比CT组升高(P<0.05)。WNM+BMSCs组Mankin 评分低于WNM组与 BMSCs 组(P<0.05),见表 1。

表1 各组膝骨关节炎Mankin评分比较(分,
2.2 各组治疗前后血清中MMP-1、 MMP-13和IL-10水平变化情况比较:造模成功后,与CT组对比,其余各组血清中MMP-1和MMP-13水平均明显升高,IL-10水平下降,差异有统计学意义(P<0.05)。给予各组相关干预,2个疗程后与Model组相比,WNM组、BMSCs组、WNM+BMSCs组MMP-1和 MMP-13 均下降,而IL-10升高,差异有统计学意义(P< 0.05),且WNM+BMSCs组明显优于BMSCs组,差异有统计学意义(P<0.05);Model组治疗前后血清中MMP-1和 MMP-13水平变化差异无统计学意义(P>0.05),见表2。
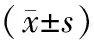
表2 各组治疗前后血清中MMP-1、MMP-13和IL-10表达水平比较
2.3 采用Western blot 检测结果比较:与CT组对比,Model组MMP-1、13蛋白的含量显著性升高(P<0.05);与Model组相比,WNM组、BMSCs组、WNM+BMSCs组MMP-1和MMP-13蛋白水平均下降,差异有统计学意义(P< 0.05),且WNM+BMSCs组明显低于BMSCs 组(P<0.05),见表3、图1(目录后)。
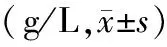
表3 各组血清中MMP-1、MMP-13蛋白含量比较
3 讨论
3.1 细胞因子在KOA病理过程中的作用:KOA的发生主要与软骨细胞凋亡导致KOA关节软骨完整性破坏密切相关,软骨细胞在炎性因子作用下凋亡,促进KOA病情的发生进展。MMP-1、MMP-13是基质金属蛋白酶家族中的一员,属于胶原蛋白水解酶,作为KOA中的关键酶,在生物学与力学因素的影响下,可以直接作用于Ⅱ型胶原蛋白,不可逆地降解细胞外基质。MMP-1在 OA关节软骨退变的过程中,促进软骨细胞合成-分解代谢平衡的破坏,其水平表达的高低,直接影响着OA病理发展[3]。研究表明,MMP-1 在 兔OA模型水平表达明显增高,其活性与软骨退变程度呈正相关性[4-5]。潘朝旺等[6]研究表明,金荞麦提取物可明显下调兔模型软骨组织MMP-1表达,减轻其对软骨组织的降解破坏,进一步保护软骨组织,起到治疗骨关节炎作用。课题组前期研究发现,温针灸治疗后关节软骨中MMP-1、MMP-13的mRNA及蛋白表达较模型组明显降低,说明温针灸通过引起MMP-1、MMP-13表达下降,进一步反向调控JNK信号通路,从而改善KOA的疼痛与关节功能障碍[7]。
IL-10主要由T细胞亚群Th2分泌产生,体内所有的单核巨噬细胞作为IL-10的靶细胞,作为正向调节因子,IL-10通过促进释放抗炎因子,进而抑制巨噬细胞活性,与OA 疾病的发病进展密切相关[8]。IL-10 具有重要的免疫应答作用,当病原体及炎症因子侵犯人体时IL-10参与发挥机体的免疫调节作用[9],其水平的上调能抑制体内过度表达和释放炎症因子TNF-α、IL-1,抑制炎症反应,起到减缓KOA关节肿胀疼痛的作用[10]。王继猛等[11]研究发现弱激光照射后大鼠脊髓损伤组织内IL-10水平增加,除外改善损伤的局部微环境,拮抗前炎症因子引起的继发性炎性反应,更因增加的IL-10水平,直接表现出对神经保护的直接作用。潘建科等[12]研究显示,龙鳖胶囊能有效地治疗KOA,消除KOA大鼠的的临床症状,尤其改善大鼠KOA模型膝关节肿胀,且其产生的作用与升高大鼠血清IL-10水平,降低IL-1β、IL-6水平密切相关。
本研究结果发现,2个疗程后与Model组相比,WNM组、BMSCs组、WNM+BMSCs组软骨降解产物MMP-1和 MMP-13 均下降,而抗炎因子IL-10升高,且WNM+BMSCs组治疗效果明显优于BMSCs组及WNM组,可以在很大程度上调控炎症因子及抗炎因子的表达水平,抑制炎症因子表达,同时促进抗炎症因子的水平增高,起到减缓抑制软骨降解,达到治疗KOA的作用。
3.2 温针灸与BMSCs 对KOA的治疗作用:KOA是中老年人常见高发病,严重影响着患者的生活质量。KOA的主要病因病机为“本虚标实”,表现为气血肝肾亏虚,再感受风寒等外邪,引起气血不通,经脉失养,脉络瘀阻而发生KOA。温针灸是祖国医学治疗KOA主要外治法,具有针刺与艾灸的双重作用,针刺法调整气血阴阳平衡,活血通络以“通则不痛”,配合灸的热敏刺激,调节炎症因子的表达,达到活血通络、温通经脉、止痛的作用。课题组前期已证实温针灸具有益气养血、温阳补虚、散寒逐瘀的功效,所选干预穴位为双侧内外膝眼、鹤顶、足三里,通过局部及阳明经取穴可加强膝关节周围组织内血液循环,加快软骨细胞新陈代谢,调节相关细胞因子参与的信号通路等表达,治疗中远期KOA疗效确切。
BMSCs具有多向分化潜能,在治疗KOA中发挥许多潜能,可直接分化为软骨细胞,参与膝关节软骨基质组织重建及修复损伤关节,并能够合成生物相关活性因子,类似温针灸局部取穴作用,使血管再生通道激活,进而营养软骨。通过给予KOA大鼠关节腔注射BMSCs,可明显降低大鼠血清中炎性因子的表达,可抑制因胶原表达失调所致关节软骨组织的损害。课题组前期证实温针灸联合BMSCs移植可增加Ⅱ型胶原合成,通过减缓软骨细胞凋亡而抑制兔KOA软骨组织损伤[13]。秦丰伟[14]研究结果示BMSCs移植可降低兔KOA关节中炎症因子IL-1、TNF-α、MMP-3的表达,升高抗炎因子IL-10水平,抑制炎症反应的发生进展,从而改善关节软骨的破坏。
本次试验应用全贴壁法培养BMSCs,应用专用培养基进行纯化传代和扩增至P3代,细胞形态长梭形,单一均匀,生长良好。造模后给予BMSCs组、WNM+BMSCs组关节腔内注射P3代BMSCs,结果显示兔KOA模型软骨损伤Mankin 评分降低,关节肿胀减轻,关节功能活动度改善,体现了BMSCs对兔KOA的治疗作用,且下调了MMP-1、MMP-13表达,上调IL-10水平,发挥了免疫调节作用,治疗兔KOA 有效。WNM组、BMSCs组、WNM+BMSCs组 MMP-1、MMP-13蛋白表达水平较Model组均明显降低,且WNM+BMSCs组蛋白水平低于BMSCs组及WNM组,差异有统计学意义,说明温针灸与BMSCs移植联用能够降低软骨细胞 MMP-1、MMP-13蛋白表达水平,从而减缓软骨基质的降解,防治KOA的进展。
综上所述,温针灸与BMSCs 移植可以降低兔KOA血清中MMP-1和 MMP-13表达,升高抗炎因子IL-10表达水平,可能通过降低因炎性介质和因子增加而诱发的软骨细胞凋亡,抑制滑膜和软骨细胞产生炎症反应,延缓软骨退变,恢复软骨细胞功能来治疗兔KOA,与单纯温针灸和单纯 BMSCs 移植治疗相比,联合使用的治疗效果显著。对于温针灸和 BMSC 移植与炎性因子介导相关信号通路抗软骨细胞凋亡的作用机制,尚待进一步研究完善。

