凋落物处理和氮添加对松栎混交林土壤生态酶化学计量的影响
栾历历,刘恩媛,顾 新,孙建新
北京林业大学林学院, 北京 100083
土壤酶活性能反应土壤生物化学过程中微生物对C、N、P等养分元素的吸收利用。目前在生态学研究中,C获取酶通常用β- 1,4-葡萄糖苷酶(β- 1,4-glucosidase,BG)表示,N获取酶通常用 β-N-乙酰氨基葡萄糖苷酶(β-N-acetylglucosaminidase,NAG)和亮氨酸氨基肽酶(leucine aminopeptidase,LAP)表示,P获取酶通常用酸性(或碱性)磷酸酶(acid or alkaline phosphatase,AP)表示,并用酶活性的比值关系BG∶(NAG + LAP)∶AP 来评价微生物对C、N、P 养分需求状况,即用生态酶化学计量来揭示微生物生长和代谢过程的土壤养分资源的有效性[1]。全球尺度上,C、N、P获取酶活性比约为1∶1∶1的关系,反映了C、N、P循环的耦合关系[2],在小区域尺度上,土壤微生物的生长受到养分限制时,C、N、P获取酶活性比偏离1∶1∶1的关系[3- 5]。尽管目前关于土壤胞外酶活性对土壤养分变异的响应已经取得很大进展,但由于土壤养分状况、土壤质地、气候条件等众多因素的影响,不同区域土壤胞外酶活性对土壤养分变异的适应机制仍然存在争议[6- 8]。在微生物研究中,通常将微生物对底物所能承受的限度定义为元素比率阈值(threshold elemental ratio,TER)。元素比率阈值是建立在代谢理论和化学计量理论的基础上,整合了土壤微生物生物量、生态酶化学计量以及微生物元素利用效率对底物C∶N∶P的适应策略,如果底物C∶X(X为N或P)超过这个阈值,则微生物受养分X限制[9]。
土壤酶活性受凋落物质量和数量的影响,有研究显示随着凋落物处理中针叶的比例降低,土壤过氧化氨酶、多酪氧化酶、脲酶的活性升高,提高幅度大于15%[10];也有研究发现脲酶、脱氨酶的活性在混合凋落物处理下要显著高于单一凋落物处理,凋落物的多样性増加不一定会提高微生物活性,凋落物的化学组成很重要[11];也有研究表明剔除凋落物处理下β- 1,4-葡萄糖苷酶、β-N-乙酰氨基葡萄糖苷酶活性均显著低于叶调落物加倍处理及混合凋落物加倍处理[12]。全球气候变化引起的氮沉降通过改变森林生态系统土壤理化性质而改变微生物的功能状况,进而影响土壤酶活性[12]。有研究表明氮添加会降低土壤中纤维素酶活性,增加脲酶和蔗糖酶活性[13];也有研究发现氮添加对β- 1,4-葡萄糖苷酶活性的影响随着氮添加浓度增加由促进转为抑制[14]。但目前凋落物输入和氮添加同时改变是否会通过影响土壤酶活性而影响土壤生态酶化学计量还不清楚。
因此,本研究基于课题组早先的松栎混交林实验样地,通过不同凋落物处理和氮浓度添加,测定了土壤理化性质、微生物生物量和胞外酶活性,以期探究以下问题:(1)不同凋落物处理和氮添加土壤生态酶化学计量是否差异显著以及是否偏离1∶1∶1的关系?(2)不同凋落物处理和氮添加土壤微生物对C、N、P的利用效率和元素比率阈值是否差异显著?(3)不同凋落物处理和氮添加下土壤生态酶化学计量主要受生物因子还是非生物因子的影响?以期为土壤微生物对全球变化的响应机制提供理论依据。
1 材料与方法
1.1 研究区概况
研究样地设在山西太岳山生态定位站灵空山自然保护区(36°38.736′N,12°06.967′E),平均海拔为1618m,该保护区属典型的暖温带半干旱大陆性季风气候,年平均气温8.6℃,年均降水量为662mm,年均日照时数为2650h,土壤类型主要是褐土和棕壤。该保护区内主要优势树种为:油松(Pinustabuliformis)、辽东栎(Quercuswutaishanica)、华北落叶松(Larixprincipisrupprechtii)、山杨(Populusdavidiana)和白桦(Betulaplatyphylla),主要山地灌丛为:黄刺玫(Rosaxanthina)、沙棘(Hippophaerhamnoides)、胡枝子(Lespedezabicolor)等。本研究选取的是该地区典型的油松-辽东栎混交林[13]。
1.2 实验设计
实验样地于2010年9月布设在灵空山林场油松-辽东栎针阔混交林,样地中油松、辽东栎的数量比为1∶2,油松的平均胸径为19.6cm,平均树高分别为7.3cm,辽东栎的平均胸径为18.6cm,平均树高为9.5cm。在该松栎混交林内建立凋落物和氮添加双因子交互处理实验样地,实验采用随机区组设计,布设了60个2 m×2 m的小样方,小样方之间间距0.5m,分为15列,每列4个,每3列划分为1个区组,区组之间相隔1 m,区组重复数为5。每个区组内,分别设置4种凋落物和3个梯度的氮添加的交互处理。凋落物处理:在每一列中随机将一个样方中的所有凋落物移至另一样方中,形成剔除凋落物(N)和混合凋落物加倍(LB);剩余两个小样方进行凋落物叶和枝果组分互换,形成叶凋落物加倍处理(L)和枝果凋落物加倍处理(B)。太岳山地区氮沉降量约为21.2 kgN hm-2a-1,参照当地背景值和北美Harvard forest 等的研究方法模拟氮沉降的强度和频度,氮添加处理设为3个梯度:0 gN m-2a-1(N0),5 gN m-2a-1(N5),10 gN m-2a-1(N10),氮添加施加的氮肥为尿素,每列的施氮率相等,每个区组内各列施氮率完全随机(图1)。从2010年到2018年,每年进行凋落物处理和氮添加,每次取样后按照样地设计对新输入的凋落物进行整理(平均3个月一次)和施加氮肥,施氮方法:将氮肥和少量土壤混合后均匀撒于小样方中[14]。

图1 实验设计示意图Fig.1 Diagram of experimental design实验样地于2010年9月布设,60个小样方(2 m×2 m);B:枝果凋落物加倍Fine woody litter double;L:叶凋落物加倍Leaf litter double;LB:混合凋落物加倍Mixed litter double;N∶剔除凋落物litter removal;N0:0 gN m-2 a-1;N5:5 gN m-2 a-1;N10:10gN m-2 a-1
1.3 土壤样品采集和测定
分别于2018年6月、8月、10月,在每个小样方内用3cm 内径的土钻“S”型选取5个点,采集表层土壤0—5cm,并剔除土样中的石砾、根系等杂物,迅速放入低温冷藏箱,过2mm筛后,其中一部分于-20 ℃冰箱内保存用于测定土壤微生物和酶活性指标,另一部分自然风干,用于分析土壤理化性质。
土壤含水量(SWC)采用鲜土在105 ℃下烘干至恒重(48 h 以上)计算得出;pH用pH计进行测定(土∶水=1∶2.5);土壤有机碳(SOC)的测定采用重铬酸钾氧化法;土壤全氮(TN)的测定采用凯式定氮法;土壤全磷(TP)的测定采用钼锑抗比色法;土壤可溶性碳(DOC)、可溶性总氮(TSN)采用K2SO4浸提法测定;土壤有效磷(SAP)的测定采用NaHCO3浸提—锑抗比色法;土壤微生物生物量碳氮磷(MBC、MBN、MBP)的测定采用氯仿熏蒸—浸提法。以上指标测定参照《土壤农化分析方法》[15]。
土壤胞外酶β- 1,4-葡萄糖苷酶(BG)、β- 1,4-N-乙酰氨基葡萄糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)、磷酸酶(AP)均采用底物诱导法测定[16- 17]。BG和NAG的测定:称取1g过筛2mm的鲜土,放入50mL酶试管内,加0.25 mL甲苯,4mL 0.05mol/L缓冲液和1mL底物,在黑暗且密闭培养箱37℃培养1h。培养结束后立即放置在冰浴条件下,加1mL 0.5mol/L CaCl2和4mL 0.1mol/L Tris(三羟基氨基甲烷)缓冲溶液(pH调至12),充分混合后用定量滤纸过滤,将滤液用紫外分光光度计在405nm波长进行比色测定,每个土壤样品均作对照。LAP和AP的测定:与BG和NAG的测定不同之处,培养结束后用0.5mol/L NaOH溶液代替上述的0.1mol/L Tris缓冲溶液。BG测定的底物为0.05mol/L的β- 1,4葡萄糖溶液,NAG测定的底物为0.01mol/L的β- 1,4-N-乙酰葡萄糖溶液,LAP测定的底物为0.01mol/L的L-亮氨酸- 4-硝基苯胺溶液,AP测定的底物为0.05mol/L的对硝基酚溶液,四种酶活性的单位均用nmol·g-1·h-1表示。
1.4 土壤样品数据计算与分析
(1)土壤生态酶化学计量的计算公式[4]
EEAC∶N=BG/(NAG+ LAP)
(1)
EEAC∶P=BG/AP
(2)
EEAN∶P=(NAG+ LAP)/AP
(3)
式中EEA为土壤胞外酶活性,BG为β- 1,4-葡萄糖苷酶,NAG为β-N-乙酰葡糖氨糖苷酶,LAP为亮氨酸氨基肽酶,AP为酸性磷酸酶。
(2)土壤微生物养分利用效率的计算公式[18]
CUEC∶X=CUEmax(SC∶X/(SC∶X+KX))
(4)
其中SC∶X=(1 /EEAC∶X)(BC∶X/LC∶X)
XUEX∶C=XUEmax(SX∶C/(SX∶C+ Kc))
(5)
其中SX∶C=(1-EEAX∶C)(BX∶C/LC)
式中X为N或P,KX、KC为半饱和常数,KX=0.5,KC=0.5;CUEmax是C能提供微生物生长能量的上限,CUEmax=0.6;XUEmax是N、P能提供微生物生长能量的上限,XUEmax=1.0;BC∶X为微生物生物量C∶N或微生物生物量C∶P;LC∶X为土壤C∶N或者土壤C∶P。SC:X为土壤微生物生物量C∶N或C∶P、胞外酶活性比C∶N或C∶P和土壤C∶N或土壤C∶P的比值,SX∶C为土壤微生物生物量N∶C或P∶C、胞外酶活性比N∶C或P∶C和土壤N∶C或土壤P∶C的比值。
(3)元素比例阈值的计算公式[18]
TERC∶X= (AXBC∶X)/ CUEC∶ X
(6)
其中AX=CUEC∶X/ SC∶X
式中X为N或P,AX为N、P的同化效率。
1.5 数据处理方法
采用 SPSS 17.0对实验数据进行统计分析,用重复测量方差分析(Repeated measures analysis of variance,RMANOVA)上述各个指标在不同取样时间与凋落物及氮添加之间有无交互作用;用单变量多因素方差分析(Univariate)上述各个指标对凋落物和氮添加及其交互作用的响应;同时,用单因素方差分析(One-way ANOVA)分析上述各个指标在4种凋落物处理和3种氮浓度添加中的差异,采用最小显著差异(LSD)进行多重比较(P<0.05);用冗余分析(RDA)土壤胞外酶活性和生态酶化学计量与土壤生物与和非生物因子之间的解释率;用 SigmaPlot 12.0软件进行作图。
2 结果与分析
2.1 不同凋落物处理和氮添加土壤理化性质、微生物生物量及土壤酶活性
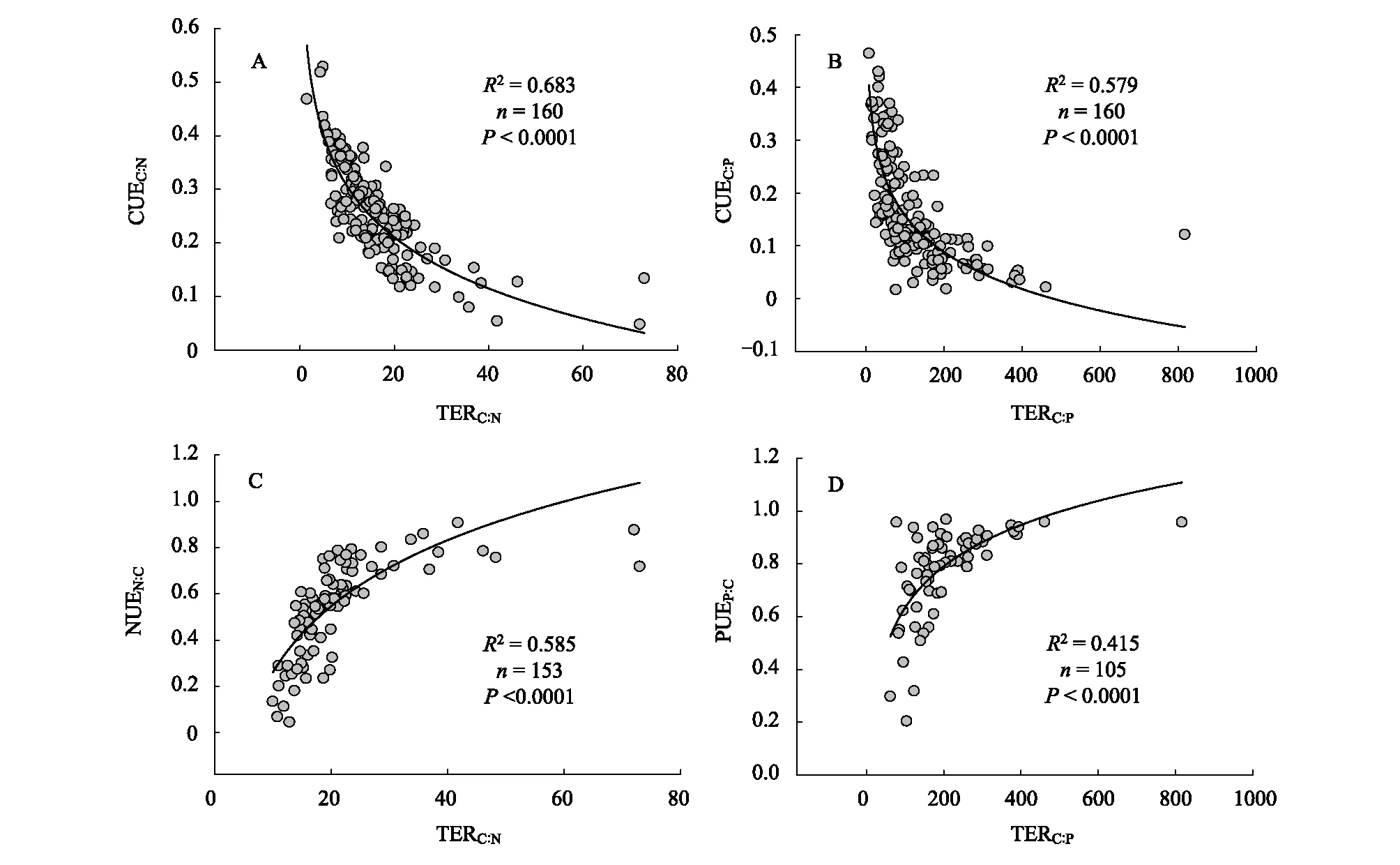
通过重复测量方差分析表明不同取样时间(2018年6月、8月和10月)与凋落物及氮添加之间无交互作用,通过单变量多因素方差分析表明上述测定指标凋落物处理和氮添加之间无交互作用。SWC、SOC、TN、DOC、TSN、SAP、MBC、MBN在不同凋落物处理下差异显著,不同氮浓度添加下无显著差异。在不同凋落物处理下,均表现为在叶凋落物加倍和混合凋落物加倍的处理高于枝果凋落物加倍和剔除凋落物处理;TSN在不同氮浓度添加显著差异,表现为N0、N5处理高于N10处理;pH、TP、MBP在凋落物处理和氮添加下均无显著差异(表1)。BG、NAG、LAP、AP在不同凋落物处理下差异显著,不同氮浓度添加下无显著差异。在不同凋落物处理下,BG、NAG、AP表现为L、LB>B、N,LAP表现为L、LB 表1 不同凋落物和氮添加处理下土壤理化性质和微生物生物量(平均值±标准误差) 图2 不同凋落物和氮添加处理下土壤胞外酶活性(平均值±标准误差)Fig.2 Soil microbial biomass and extracellular enzyme among treatments of litter and nitrogen (Mean±SE)图中不同小写字母表示相同施氮量不同凋落物处理间的差异显著;不同大写字母表示相同凋落物处理不同氮浓度添加的差异显著(P<0.05) 不同凋落物处理和氮添加下,土壤微生物生物量碳氮比(MBC∶MBN)、微生物生物量碳磷比(MBC∶MBP)、微生物生物量氮磷比(MBN∶MBP)均无显著差异(图3)。 土壤生态酶化学计量比用lnBG∶ln(NAG+ LAP)∶lnAP 表示,在不同凋落物处理下,lnBG∶ln(NAG+ LAP)、lnBG∶lnAP和ln(NAG+ LAP)∶lnAP均差异显著,表现为叶凋落物加倍和混合凋落物加倍的处理高于枝果凋落物加倍和剔除凋落物处理;不同氮浓度添加下,土壤生态酶化学计量均无显著差异(图4)。B处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.96∶0.96∶1;L处理∶lnBG∶ln(NAG+ LAP)∶lnAP为1.02∶0.99∶1;LB处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.99∶1;N处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.96∶0.95∶1;N0处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.97∶0.96∶1;N5处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.98∶1;N10处理∶lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.98∶1。整体上,温带松栎混交林样地lnBG∶ln(NAG+ LAP)∶lnAP为0.98∶0.97∶1,其中, lnBG∶ln(NAG+ LAP)为1.01, lnBG∶lnAP为0.98,ln(NAG+ LAP)∶lnAP为0.97。 图3 不同凋落物和氮添加处理下土壤微生物化学计量(平均值±标准误差)Fig.3 Stoichiometric of soil microbial biomass among treatments of litter and nitrogen(mean ± SE)图中不同小写字母表示相同施氮量不同凋落物处理间的差异显著;不同大写字母表示相同凋落物处理不同氮浓度添加的差异显著(P<0.05);MBC∶MBN∶微生物生物量碳氮比soil microbial biomass C∶N;MBC∶MBP:微生物生物量碳磷比soil microbial biomass C∶P;MBN∶MBP:微生物生物量氮磷比soil microbial biomass N∶P 图4 不同凋落物和氮添加处理下土壤生态酶化学计量(平均值±标准误差)Fig.4 Soil ecoenzymatic stoichiometry among treatments of litter and nitrogen(Mean ± SE)不同小写字母表示相同施氮量不同凋落物处理间的差异显著;不同大写字母表示相同凋落物处理不同氮浓度添加的差异显著(P<0.05); lnBG∶ln(NAG+ LAP)表示碳氮获取酶活性比; lnBG∶lnAP表示碳磷获取酶活性比; ln(NAG+ LAP)∶lnAP表示氮磷获取酶活性比 土壤微生物碳利用效率(CUEC∶N和CUEC∶P)在不同凋落物处理下差异显著,表现为枝果凋落物加倍和剔除凋落物的样地高于叶凋落物加倍和混合凋落物加倍的样地,不同氮浓度添加下无显著差异;土壤微生物氮利用效率(NUEN∶C)和微生物磷利用效率(PUEP∶C);不同凋落物处理和氮浓度添加下均无显著差异(表2)。土壤微生物碳氮比率阈值(TERC∶N)在不同凋落物和氮添加处理下均无显著差异;土壤微生物碳磷比率阈值(TERC∶P)在不同凋落物处理下表现为L、LB > B、N,不同氮浓度添加下差异不显著(图5)。土壤CUEC∶N和CUEC∶P分别与TERC∶N和TERC∶P显著正相关(图6);土壤NUEN∶C与TERC∶N显著负相关(图6);土壤PUEP∶C与TERC∶P显著负相关(图6)。 表2 不同凋落物和氮添加处理下土壤微生物养分利用效率(平均值±标准误差) 图5 不同凋落物和氮添加处理下元素比率阈值(平均值±标准误差)Fig.5 Threshold elemental ratio (TERC∶N and TERC∶P) of soil microbial community among treatments of litter and nitrogen (Mean ± SE)不同小写字母表示相同施氮量不同凋落物处理间的差异显著;不同大写字母表示相同凋落物处理不同氮浓度添加的差异显著(P<0.05);CUE :微生物碳利用效率Microbial carbon use efficiency;NUE:微生物氮利用效率Microbial nitrogen use efficiency;PUE:微生物磷利用效率Microbial phosphorus use efficiency 图6 土壤微生物养分利用效率与元素比例阈值Fig.6 Soil microbial nutrient utilization efficiency and threshold element ratios (TER)CUE:微生物碳利用效率microbial carbon use efficiency;NUE:微生物氮利用效率microbial nitrogen use efficiency;PUE:微生物磷利用效率microbial phosphorus use efficiency; 相关性分析表明,BG和NAG与pH显著负相关,与SWC、SOC、TN、DOC、STN、SAP、MBC、MBN显著正相关;LAP与pH显著正相关,与SWC、SOC、TN、DOC、STN、MBC、MBN显著负相关;AP与TP、SAP显著负相关(P<0.05,图7)。EEAC∶N与SWC显著正相关,与土壤C∶N无显著相关性;EEAC∶P与pH显著负相关,与土壤C∶P显著正相关;EEAN∶P与pH呈显著负相关,与土壤N∶P显著负相关(P<0.05,图7)。RDA分析表明,土壤理化性质和微生物生物量共解释胞外酶活性26.4%的变异,其中土壤pH、TN、SOC是土壤酶活性的显著影响因子,分别解释了土壤胞外酶活性14.3%,7.3%,2.2%的变异,土壤pH是土壤酶活性的最大解释因子(表3)。土壤生物和非生物因子共解释土壤生态酶化学计量30.7%的变异,其中土壤pH、C∶P、N∶P是土壤生态酶化学计量的显著影响因子,分别解释了土壤生态酶化学计量13.1%,5.8%,4.8%的变异,土壤pH是土壤生态酶化学计量的最大解释因子(表4)。 图7 土壤胞外酶活性和生态酶化学计量的冗余分析Fig.7 Redundancy analysis (RDA) of soil extracellular enzyme activity and ecoenzymatic stoichiometrySWC∶土壤含水率Soil water content;SOC∶土壤有机碳Soil organic carbon;TN∶土壤全氮Total nitrogen;TP:土壤全磷Total phosphorus;DOC∶可溶性碳 Soluble carbon;TSN∶土壤可溶性总氮Total soluble nitrogen;SAP:有效磷Available phosphorus;MBC∶微生物生物量碳Microbial biomass carbon;MBN∶微生物生物量氮Microbial biomass nitrogen;MBP:微生物生物量磷Microbial biomass phosphorus;BG:β- 1,4-葡萄糖苷酶β- 1,4-glucosidase; NAG:β-N-乙酰氨基葡萄糖苷酶β-N-acetylglucosaminidase; LAP:亮氨酸氨基肽酶leucine aminopeptidase; AP:酸性磷酸酶acid phosphatase;EEA:碳氮酶活性比extracellular enzyme 通常情况下,林地的叶凋落物量大于枝果凋落物量[19],而叶凋落物C∶N、酸不溶残留物∶氮(AUR∶N)的值显著低于枝果凋落物,叶凋落物相对枝果凋落物分解较快,土壤中的微生物可利用养分相对较多[12]。本研究中,凋落物处理与氮添加无交互影响。在不同凋落物处理下,土壤SWC、SOC、TN、MBC、MBN差异显著,均表现为在叶凋落物加倍(L)和混合凋落物加倍(LB)的处理高于枝果凋落物加倍(B)和剔除凋落物处理(N),不同氮浓度添加下无显著差异,与之前本样地研究结果一致[12,14];DOC、TSN、SAP表现为L、LB>B、N,有研究指出,添加凋落物可以提高土壤DOC、TSN[20]和SAP的含量[21];本研究中土壤可溶性总氮(TSN)表现为N5处理显著高于N10,土壤可溶性总氮包括可溶性有机氮和无机氮,本研究和早先课题组研究均发现本样地土壤微生物生物量氮随施氮浓度增加呈先增加后降低的趋势,早先课题组研究发现硝态氮随施氮浓度的增加先增加后降低,这预示着长期的过量氮添加可能会降低微生物生物量及其活性。可能当氮添加到一定程度时,土壤微生物受到了其他因素的制约。土壤TP和MBP在凋落物处理及氮添加下均无显著差异,有研究表明土壤磷主要来自岩石风化,取决于土壤质地[22],土壤MBP的调控机制相对复杂,微生物对P的摄取独立于C和N的摄取[23]。 有研究指出凋落物输入和N 添加会影响土壤胞外酶活性[12,24- 26]。本研究中,不同氮浓度添加下,土壤胞外酶活性均无显著差异。不同凋落物处理下,BG、NAG、AP 表现为有叶凋落物输入的处理高于枝果凋落物输入和剔除凋落物处理,而LAP表现为有叶凋落物输入的处理低于枝果凋落物输入和剔除凋落物处理(图2),可能是LAP与BG、NAG、AP负相关关系,LAP与BG、NAG、AP出现解耦现象,造成这种现象的原因可能是LAP和BG、NAG、AP酶活性检测的基质与标准物不同[2,8]。 不同凋落物处理和氮添加下,微生物化学计量均无显著差异(图3)。有研究指出,微生物生物量C∶N∶P的可塑性是由微生物群落结构的变化导致的[27- 28],但微生物的数量、群落组成以及代谢活动的复杂性,使微生物生物量C∶N∶P对底物C∶N∶P的响应仍不明确[29],研究普遍认为由于微生物本身的内稳态使微生物生物量C∶N∶P变异性很小[30]。早先本课题组研究发现细菌:真菌受不同凋落物处理和氮添加影响并不显著[14]。本研究中,MBC∶MBN、MBN∶MBP和MBC∶MBP的平均值分别为5.7、3.2和17.4,均低于全球土壤平均值[31],本实验样地MBC∶MBN比值偏低,可能是叶凋落物加倍和混合凋落物加倍使土壤中有机碳含量相对增加,有利于细菌的生长,显著提高了细菌总量以及革兰氏阴性细菌的相对含量[14],MBN∶MBP的偏低可能是微生物生长需要投资更多富含磷的核糖体RNA[32]。 表3 影响土壤胞外酶活性的主要因子 表4 影响土壤生态酶化学计量的主要因子 土壤生态酶化学计量可以反映土壤养分资源的有效性和微生物对养分需求的变化[2]。在不同凋落物处理下,lnBG∶ln(NAG+ LAP)、lnBG∶lnAP和 ln(NAG+ LAP)∶lnAP均差异显著,表现为在叶凋落物输入的处理高于枝果凋落物加倍和剔除凋落物处理,王冰冰等[33]研究发现岷江灌丛样地 lnBG:ln(NAG+ LAP)显著高于空地[8],说明凋落物的质和量会改变森林土壤的养分状况,微生物会通过调节土壤生态酶化学计量来调控对自身生长的养分利用。本研究中,不同氮浓度添加下,土壤生态酶化学计量均无显著差异(图4),Chen等研究发现氮添加改变了土壤胞外酶的活性,但并未改变土壤生态酶化学计量。可能森林土壤氮循环受很多因素的影响,氮添加对森林土壤微生物的作用机制并非一个瞬间或简单的过程。因此,土壤微生物对长期氮添加的调控机制未来仍需继续探讨。本研究中,B处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.96∶0.96∶1;L处理:lnBG∶ln(NAG+ LAP)∶lnAP为1.02∶0.99∶1;LB处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.99∶1;N处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.96∶0.95∶1;N0处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.97∶0.96∶1;N5处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.98∶1;N10处理:lnBG∶ln(NAG+ LAP)∶lnAP为0.99∶0.98∶1。说明不同凋落物和氮添加处理下,土壤生态酶化学计量并未明显偏离1∶1∶1的关系,说明说明微生物应对外界变化具有较强的“内稳态”调节能力,土壤微生物在自身代谢过程中, 通过调控胞外酶来适应生态系统中C、N、P的变化[29]。整体上,温带松栎混交林样地lnBG ∶ln(NAG+ LAP)∶lnAP为0.98∶0.97∶1,其中,lnBG∶ln(NAG+ LAP)为1.01,lnBG∶lnAP为0.98,ln(NAG+ LAP)∶lnAP为0.97。说明本研究区内,土壤微生物对P获取酶的投资相对高于C和N获取酶的投资,土壤中微生物的生长可能受到相对的P限制,大多数的研究认为亚热带地区磷是生态系统生产力的限制因子[6- 7,34- 35]。本研究中,不同凋落物处理,微生物化学计量无显著差异,而土壤生态酶化学计量差异显著,说明在土壤养分条件发生改变下,土壤生态酶化学计量比微生物化学计量响应更加敏感,可以更好的反映土壤养分资源的有效性和微生物对养分需求的变化。 土壤微生物养分利用效率指将底物转化为自身生物量的效率,与陆地生态系统养分循环直接相关[18,27]。不同凋落物处理下,土壤微生物碳利用效率(CUEC∶N和CUEC∶P)差异显著,表现为枝果凋落物输入和剔除凋落物的样地高于有叶凋落物输入的样地,有研究指出,CUE与EEAC∶P呈负相关关系[18],本研究中,EEAC∶P∶L、LB > B、N,CUEC∶P∶L、LB < B、N,说明有叶凋落物输入的样地相对无叶凋落物输入的样地微生物可利用的碳源充足,微生物通过调节酶活性对养分变异做出反馈来调控土壤生态系统的稳定性。土壤微生物氮利用效率(NUEN∶C)和微生物磷利用效率(PUEP∶C)差异均不显著,目前关于NUE和PUE的研究较少,有研究指出土壤微生物对于P的吸收是独立于C、N的,C和N的摄取主要通过氨基酸和氨基糖,P的摄取主要通过细胞膜相关的载体蛋白进行[36]。不同氮浓度添加下,CUEC∶N、CUEC∶P、NUEN∶C和PUEP∶C差异均不显著,可能由于本实验的氮浓度添加相对较低或森林土壤氮循环的复杂性,土壤理化性质、微生物生物量、胞外酶活性以及生态酶化学计量均无显著差异,从而对土壤微生物养分利用效率无显著影响。 在微生物研究中,通常将微生物对底物所能承受的限度定义为元素比率阈值(TER)。元素比率阈值是建立在代谢理论和化学计量理论的基础上,整合了土壤微生物生物量、生态酶化学计量以及微生物元素利用效率对底物C∶N∶P的适应策略,如果底物C∶X(X为N或P)超过这个阈值,则微生物受养分X限制[28- 29],低的TERC∶N和TERC∶P表明土壤微生物更易受N和P的限制[37-38]。本研究中,TERC∶N在不同凋落物和氮添加处理下均无显著差异,说明不同处理下土壤微生物对N的承受限度没有差异;TERC∶P在不同凋落物处理下表现为有叶凋落物输入的样地高于无叶凋落物输入的样地(图5),说明叶凋落物输入相对提高了土壤微生物对P的承受限度,可相对缓解P的限制,土壤有效磷(SAP)表现为有叶凋落物输入的样地高于无叶凋落物输入的样地(表1)。 土壤微生物养分利用效率与元素比率阈值的关系可为底物变化微生物的调控机制提供理论依据[39]。本研究中,土壤CUEC∶N和CUEC∶P分别与TERC∶N和TERC∶P显著正相关(图6),说明土壤微生物在自身调节过程中,通过胞外酶与土壤中C、N、P的利用效率之间的耦合关系对土壤环境进行正负效应驱动来调节气候变化对生态系统造成的影响[18]。目前,关于土壤微生物氮和磷养分利用效率与元素比率阈值相关性的研究较少。本研究中,NUEN∶C与TERC∶N显著负相关(图6),PUEP∶C与TERC∶P显著负相关(图6),可能是由于土壤微生物C利用效率与土壤微生物N和P利用效率成负相关关系[18]。 土壤胞外酶活性与生态酶化学计量受资源有效性的调控[5],本研究相关性分析表明,BG和NAG与pH显著负相关,与SWC、SOC、TN、DOC、STN、SAP、MBC、MBN显著正相关。而LAP与pH显著正相关,与SWC、SOC、TN、DOC、STN、MBC、MBN显著负相关(图7)。LAP与BG和NAG呈不同的分布特征,可能是检测方法造成了LAP与BG、NAG解耦合,BG、NAG酶活性检测的基质是基于MUB的,而LAP检测的基质则是基于AMC[2,8]。AP与TP、SAP显著负相关,受资源分配理论的影响,土壤磷酸酶活性通常与土壤有效P含量成反比,当土壤中微生物的生长受到P限制时,土壤微生物将增加对磷酸酶的投资[35]。EEAC∶N与SWC显著正相关,与土壤C∶N无显著相关性;EEAC∶P与pH显著负相关,与土壤C∶P 显著正相关;EEAN∶P与pH呈显著负相关,与土壤N∶P 显著负相关(图7)。研究发现,不同的生态系统生态酶化学计量与土壤化学计量的相关性不同。例如:EEAC∶N与土壤C∶N无显著相关[34- 35]或显著负相关[41],EEAC∶P与土壤C∶P显著正相关[8,41]或负相关[6- 7,35],EEAN∶P与土壤N∶P 显著正相关[40]或负相关[8,35,41]。说明生态酶化学计量与土壤化学计量的关系相对复杂,不同的生态系统生态酶化学计量对土壤养分的响应机理并不相同。 RDA分析表明,土壤理化性质和微生物生物量共解释胞外酶活性26.4%的变异,其中土壤pH、TN、SOC是土壤酶活性的显著影响因子,分别解释了土壤胞外酶活性14.3%、7.3%、2.2%的变异,土壤pH是影响胞外酶活性的最大解释因子(表3)。土壤生物和非生物因子共同解释土壤生态酶化学计量30.7%的变异,其中土壤pH、C∶P、N∶P是土壤生态酶化学计量的显著影响因子,分别解释了土壤生态酶化学计量13.1%,5.8%,4.8%的变异,土壤pH是生态酶化学计量的最大解释因子(表4)。本研究中,土壤pH是胞外酶活性和生态酶化学计量最主要的影响因子,原因是土壤pH通过调控土壤微生物生物量和群落组成以及酶与土壤颗粒的结合状态,从而影响土壤胞外酶活性和生态酶化学计量[42]。目前不同生态系统中,影响土壤酶化学计量的主要因子并不一致,例如:Xu等[7]在不同森林生态系统中研究发现土壤pH是生态酶化学计量的主要影响因子;王冰冰等[8]在岷江干旱地区研究发现土壤含水率(SWC)是生态酶化学计量的主要影响因子;乔航等[6]在茶油人工林研究发现土壤有机碳(SOC)是生态酶化学计量的主要影响因子。研究发现土壤的非生物因子比生物因子更能影响土壤胞外酶活性和生态酶化学计量。研究不足之处,生态酶化学计量的RDA分析模型中各因子总解释率并不高,造成这种结果的原因,可能是某些未检测因子(土壤温度、团聚体、有机酸等)及其空间自相关间接影响了土壤生态酶化学计量的变异[6,8]。 研究发现土壤生态酶化学计量在不同凋落物处理下差异显著,表现为叶凋落物输入的样地高于枝果凋落物输入和剔除凋落物样地,在氮添加下土壤生态酶化学计量无显著差异,说明凋落物的质和量对森林土壤微生物的影响较氮添加显著,可能氮添加对森林土壤微生物的作用机制并非一个瞬间或简单的过程。不同凋落物和氮添加处理下,土壤生态酶化学计量均未明显偏离1∶1∶1的关系,说明微生物应对外界变化具有较强的自身调节作用。土壤微生物碳利用效率(CUE)表现为叶凋落物输入的样地低于枝果凋落物输入和剔除凋落物样地,TERC∶P表现为叶凋落物加倍和混合凋落物加倍处理高于枝果凋落物加倍和剔除凋落物处理,说明微生物会通过调节胞外酶和养分利用效率对养分变异做出响应,叶凋落物的输入相对缓解了P的限制。本研究发现凋落物处理和氮添加下土壤的非生物因子比生物因子更能影响土壤胞外酶活性和生态酶化学计量。基于土壤生态过程的复杂性,微生物对森林地表凋落物变化以及长期氮添加的调控机制未来仍需继续探讨。

2.2 不同凋落物处理和氮添加土壤微生物与生态酶化学计量特征

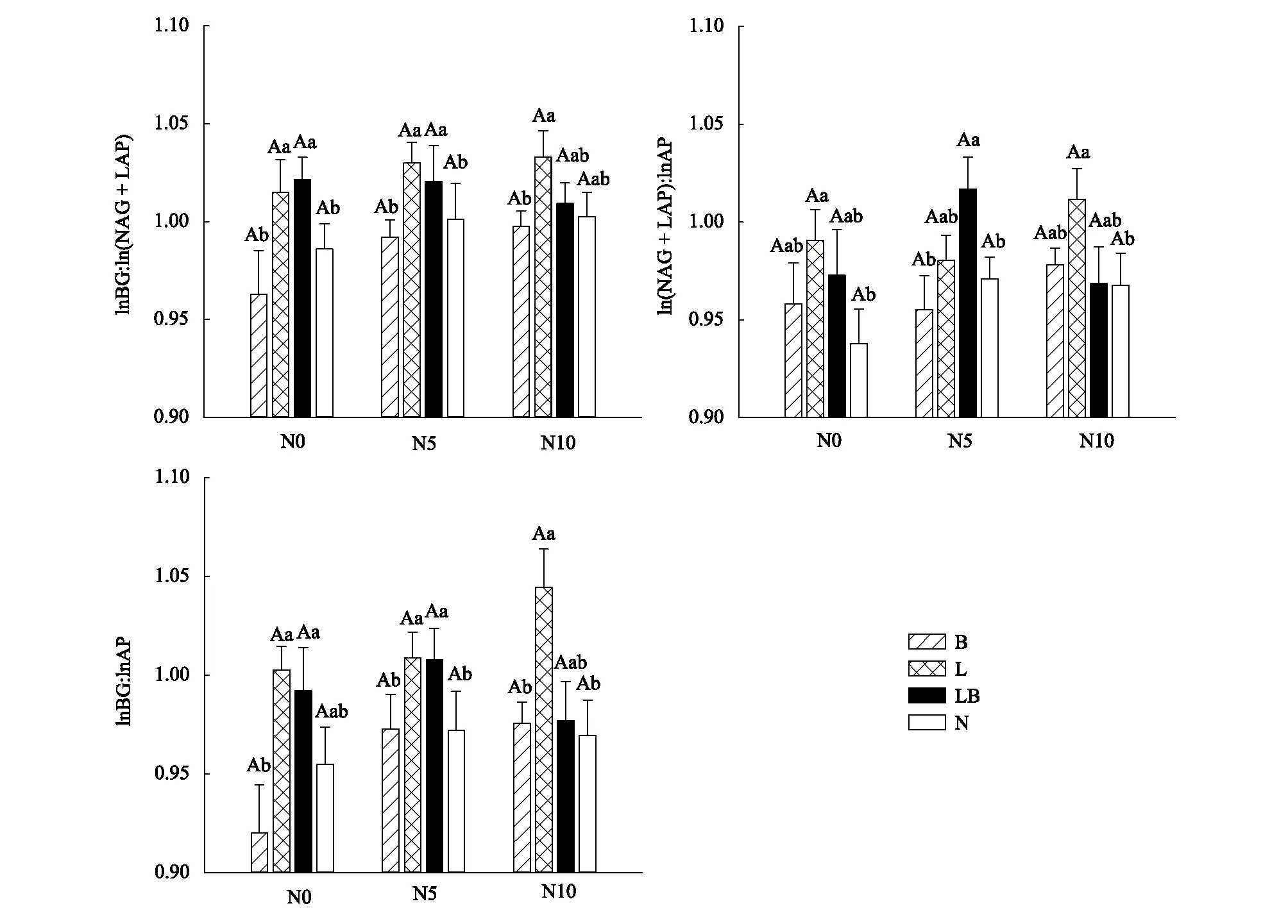
2.3 不同凋落物处理和氮添加土壤微生物养分利用效率与元素比率阈值


2.4 影响土壤胞外酶活性与生态酶化学计量的主要因子

3 讨论
3.1 不同凋落物处理和氮添加对土壤理化性质、微生物生物量及土壤酶活性的影响
3.2 不同凋落物处理和氮添加对土壤微生物与生态酶化学计量的影响


3.3 土壤微生物养分利用效率与元素比率阈值
3.4 影响土壤胞外酶活性与生态酶化学计量的主要因子
4 结论

