青藏高原高寒湿地GPP变化特征及对生长季积温的响应
祝景彬, 贺慧丹, 李红琴, 张法伟, 李英年,5,*, 杨永胜,5, 张光茹,4, 王春雨,4, 罗方林,4
1 枣庄学院旅游与资源环境学院, 枣庄 277160 2 中国科学院西北高原生物研究所, 西宁 810001 3 洛阳师范学院生命科学学院, 洛阳 471934 4 中国科学院大学, 北京 100049 5 中国科学院高原生物适应与进化重点实验室, 西宁 810001
根据IPCC第五次评估报告,由于大气中温室气体浓度的增加,将导致2100年的全球平均气温升高0.3—4.8℃[1],“温室效应”将会对陆地生态系统的碳循环过程产生重大影响[2]。全球湿地生态系统的面积虽然只占陆地表面的5%—8%,但其土壤中储存的有机碳却占全球土壤碳库的25%—30%。因此,近年来更多的研究聚焦在湿地生态系统在气候变化中的作用[3- 4]。青藏高原的湿地约占中国湿地总面积的三分之一,其土壤有机碳占中国湿地土壤有机碳的30%—40%[5- 6]。此外,由于海拔较高和气温较低,导致青藏高原高寒生态系统的碳平衡对全球变暖非常敏感[7- 9]。因此,研究高寒湿地生态系统的碳循环动态,对于有效预测未来全球碳循环对环境变化的响应具有重要参考价值[10- 12]。
生态系统总初级生产力(GPP)是指单位时间内植物通过光合作用固定的有机碳量,是生态系统碳循环的基础,GPP的变化动态对大气中CO2的含量具有重要影响[9]。研究表明,随着温度的升高,生态系统GPP有增大趋势,但增大缓慢且具有较高异质性[13]。植物进行光合作用过程中相关酶的生理活性以及酶促反应速度受到温度调控[14],温度是影响植物光合作用的关键因子[15- 17]。但是,温度与总初级生产力的关系较为复杂,一定程度上温度的升高有利于光合速率的提高,但是超过其最适反应温度又开始下降[13]。此外,大量研究表明,不同生态系统的碳平衡状态存在较大差异,这是由不同生态系统生物和非生物因素之间的差异造成的[18-19]。同时,年均温的年际差异也导致了碳循环各过程的波动[20]。因此,在全球气候变化的背景下,研究总初级生产力对气候变暖的响应极其重要。
国内外对陆地生态系统碳循环方面的研究主要集中在低海拔地区,而对于高海拔地区青藏高原高寒生态系统碳循环方面的研究相对较少;此外,目前对青藏高原高寒生态系统碳平衡的研究主要是短期内的变化动态和影响机制的研究[21],而对于较长时间尺度的年际变化动态和响应机制研究相对较少。在高寒地区的研究表明,气候变暖提前了融雪期和植被返青期,延长了生长季长度,并促进高寒生态系统的CO2同化和植被生产[22]。近几十年来,青藏高原经历了显著的变暖,但有关高寒湿地生态系统碳平衡的研究相对较少[23]。同时,永冻层和冰川融化可能在青藏高原上形成更多的湿地,因此气候变暖导致的高寒湿地范围的扩大可能会引起土壤碳储量和区域碳平衡的变化[24]。此外,研究表明在不同的时间尺度上,气候环境因子可能对碳循环有不同的影响[11]。在不同时间尺度上分析气候环境因子对碳通量的影响,更能准确的反应其客观的关系。因此,研究在不同时间尺度上分析了2004年至2016年生长季利用涡度协方差(EC)技术在青藏高原东北部高寒湿地获得的13年连续通量数据。研究目的是:(1)量化高寒湿地生态系统生长季GPP与GDD在不同时间尺度上的变化特征;(2)明确不同时间尺度上高寒湿地生态系统生长季的GPP对GDD的响应。
1 材料与方法
1.1 试验地概况
试验在青海海北高寒草甸生态系统国家野外科学观测研究站(海北站) 附近的高寒湿地中进行。海北站地处青藏高原东北隅祁连山北支冷龙岭东段南麓坡地(37°29′—37°45′N,101°12′—101°23′E,海拔3200—3600 m)。该地区属高原大陆性气候,有明显的干冷(11月至次年4月)和暖湿(5月至10月)季节[25]。根据1980年至2010年的气象资料,年平均气温约为-1.0℃。最温暖的月份在7月,温度约为10℃;最冷的月份在1月,温度约为-15℃。年平均降水量约480 mm,其中80%的降水量集中在暖湿季节。此次研究实验地发育着典型的沼泽土—有机寒冻潜育土,土壤呈微碱性,有机质含量丰富,0—30cm土层C和N的平均含量分别为24.5%和1.46%。高寒湿地在四月底或五月初开始返青,地上生物量从5月到8月呈上升趋势,在7月下旬或8月达到最大值[26]。湿地以帕米尔苔草(CarexpamirensisMarsh)为建群种,次优势种有华扁穗草(Blysmussinocompressus)、黑褐苔草(Carexatrofusca)、青藏苔草(C.moorcropt)、乳白香青(Anaphalislectea)等[27]。
1.2 研究材料及分析方法
1.2.1通量和温度的监测
涡度协方差法包括三维超声风速仪(CSAT3, Campbell, USA)和开路红外CO2/H2O分析仪(LI- 7500, LI-Cor, USA)。原始数据的采样频率为10 Hz。通过WPL (Webb, Pearman和Leuning)密度相关计算和调整30分钟通量,并使用数据记录器(CR5000, Campbell, USA)记录。微气候观测系统包括风向和风速(150 cm和250 cm)、空气温度和湿度(150 cm和250 cm)等。括号里的数字是安装设备的高度。因湿地地表积水,未测量土壤含水量、土壤热通量等。Zhang等[27]描述了进一步的细节。有效积温(GDD)为大于5℃日气温的和[28]。参考以往研究经验,将生长季定义为高寒湿地生态系统的5—9月[11, 14]。本研究中日尺度GPP、GDD为当天的GPP(gC m-2d-1)、GDD(℃);月尺度GPP(gC m-2月-1)、GDD(℃)为当月每天GPP、GDD的和;生长季尺度GPP(gC m-2季-1)、GDD(℃) 为整个生长季每天GPP、GDD的和。
1.2.2数据处理
本研究采用的数据是2004—2016年生长季的涡度相关系统观测的数据。收集数据后,对所有通量和气象数据进行质量控制。由于研究地点地势相对平坦,当冠层高度较低时,小偏差可以被忽略,因此未对原始涡流数据进行轴向旋转和趋势消除[14, 21]。研究采用的通量数据处理方法来自ChinaFLUX的标准处理方法[29]。GPP和GDD的关系采用线性相关分析,对所测定的数据利用Excel和SPSS 20.0软件对数据进行统计分析。
2 结果与分析
2.1 高寒湿地生态系统的日GPP变化特征及其对气温(Ta)的响应
图1可见,高寒湿地生态系统的日GPP在2004—2016年生长季(5—9月)的变化趋势基本一致,表现为先增加后减小的单峰变化趋势。十三年的数据表明,日GPP在每年7月达到峰值,日GPP的最大值为2012年7月10日的7.75 gC m-2d-1。高寒湿地在2004—2016年生长季(5—9月)日平均气温(Ta)变化趋势基本一致,表现为先升高后降低的单峰变化趋势(图1)。最高气温出现在2013年7月15日,为17.89 ℃;最低气温出现在2013年5月12日,为-3.66 ℃。线性回归分析表明(图2),日GPP与Ta呈极显著正相关(GPP=0.42Ta-0.06,R2=0.46,P<0.001),由此表明在日尺度上气温越高,高寒湿地植被的光合生产能力越强。

图1 高寒湿地日总初级生产力(GPP)与气温(Ta)的变化特征Fig.1 Variation characteristics of daily gross primary productivity (GPP) and temperature (Ta) of alpine wetland
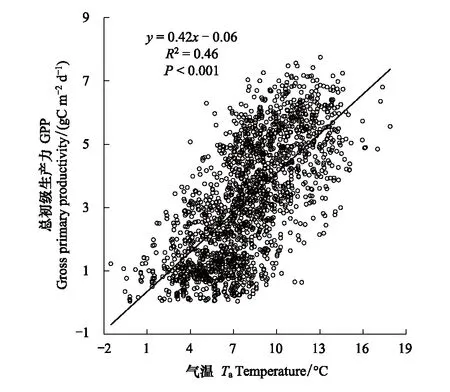
图2 高寒湿地日总初级生产力(GPP)与气温(Ta)的关系Fig.2 The relationship between daily gross primary productivity (GPP) and temperature (Ta) of alpine wetland
2.2 高寒湿地生态系统的月GPP变化特征及其对GDD的响应
图3可见,高寒湿地在2004—2016年生长季(5—9月)GPP月变化趋势基本一致,表现为先增大后减小的单峰变化趋势,2004—2016年生长季的月GPP基本都在7月达到峰值,只有2007年在8月达到峰值,为159.05 gC m-2月-1;月GPP的最大值为2012年7月的值,为191.98 gC m-2月-1。2004—2016年生长季的月GPP都在5月达到最小值,5月GPP的均值为(13.19±6.32) gC m-2月-1。6、8、9月GPP的均值分别为(76.06±16.98)、(147.77±13.47)、(72.25±15.76) gC m-2月-1。高寒湿地在2004—2016年生长季(5—9月)的月GDD变化趋势基本一致(图3),在7、8月达到峰值,7、8月GDD的均值分别为(317.28±25.43)、(303.18±44.74) ℃,整体上看7月GDD相对更大。5月GDD最小,其均值为(77.61±23.97) ℃;6、9月GDD均值分别为(232.74±27.30)、(130.08±28.37) ℃。
线性回归分析表明(图4),在整个生长季的月GPP与月GDD呈极显著正相关(GPP=0.51GDD-15.66,R2=0.82,P<0.001),此外,我们分别分析了2004—2016年生长季每个月的GPP与GDD的关系(表1),研究发现在5、9月GPP与GDD没有显著相关性(P>0.40),在6、7、8月GPP与GDD呈显著相关(P<0.05),并且在生长旺盛期(7、8月)的相关性更显著(P<0.01),在7月GPP与GDD的相关性最强(R2=0.52,P<0.01)。这种结果可能是由不同月份之间水热条件、光合有效辐射等环境因素的差异造成的,所以在不同月份GPP与GDD的相互关系存在差异(表1),在生长季旺盛期(7、8月)这种相关性最强,说明在高寒湿地植被生长最旺盛时期,热量条件对植被光合生产能力有更显著的影响。整体上看,在月尺度上,生长季每个月积温越大,越有利于生态系统总初级生产力的提高。
2.3 高寒湿地生态系统的生长季GPP变化特征及其对GDD的响应
图5可见,整个生长季(5—9月)GPP的值变异较大,没有明显的变化趋势,生长季GPP的最大值出现在2012年,其值为499.94 gC m-2季-1;生长季GPP的最小值出现在2009年,其值为414.34 gC m-2季-1;2004—2016年的生长季GPP均值为(458.82±25.78) gC m-2季-1。2004—2016年生长季有效积温变异较大,没有明显变化趋势(图5),最大值为2016年的1220.45 ℃,最小值为2009年的908.35 ℃,整个生长季GDD的均值为(1060.89±84.07) ℃。线性回归分析表明(图6),生长季GPP与GDD呈极显著正相关(GPP=0.22GDD+229.27,R2=0.50,P=0.007),由此说明在生长季尺度上,高寒湿地生态系统生长季有效积温(GDD)的增大有利于提高整个生长季的总初级生产力(GPP)。

图3 高寒湿地的月总初级生产力(GPP)与生长季有效积温(GDD)的变化特征Fig.3 Variation characteristics of monthly gross primary productivity (GPP) and growing season degree days (GDD) over alpine wetland
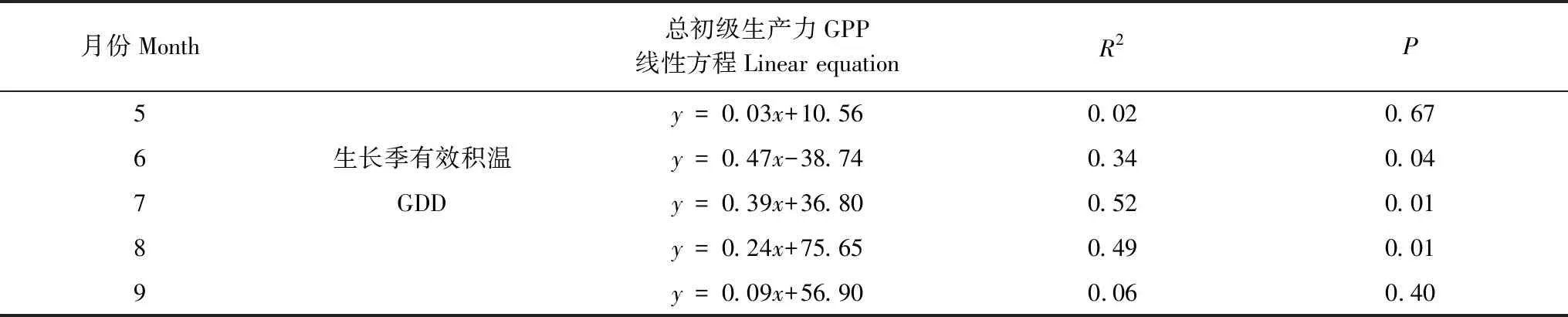
表1 高寒湿地在生长季每个月总初级生产力(GPP)与生长季有效积温(GDD)的相关性

图4 高寒湿地的月总初级生产力(GPP)与生长季有效积温(GDD)的关系Fig.4 The relationship between monthly gross primary productivity (GPP) and growing season degree days (GDD) over alpine wetland
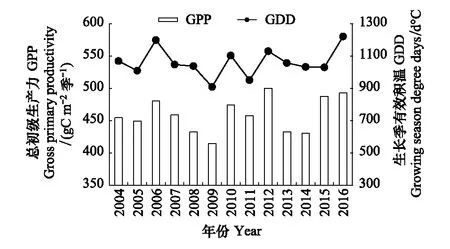
图5 高寒湿地的生长季(5—9月)总初级生产力(GPP)与生长季有效积温(GDD)变化特征Fig.5 Variation characteristics of gross primary productivity (GPP) and growing season degree days (GDD) in growing season (May—Sep) over alpine wetland
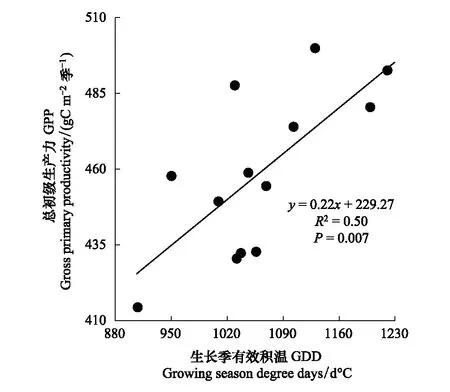
图6 高寒湿地的生长季(5—9月)总初级生产力(GPP)与生长季有效积温(GDD)关系Fig.6 The relationship between seasonal gross primary productivity (GPP) and growing season degree days (GDD) in growing season (May—Sep) over alpine wetland
3 讨论
过去的研究表明草地生态系统植被的光合生产能力与温度的变化密切相关,但研究结果也指出,群落生物量对生态系统热量条件变化的反应具有一定的“时滞”性,因此,分析生态系统温度的累加值与植被光合生产能力的关系更能客观的反应其真实的响应模式[30]。研究中,GPP和GDD在日尺度、月尺度的变化趋势都表现为先升高后降低的单峰变化趋势,都是在7、8月达到峰值,这和Zhao等[26]、Zhang等[27]的研究结果基本一致。在生长季尺度上,2004—2016年的生长季GPP和GDD变异性较大,没有表现出明显的变化趋势,这与李红琴[11]的研究结果类似。
但是,过去的研究大多局限于短期的研究,研究表明在不同的时间尺度上环境因子可能对生态系统生产力有不同的影响[21,26],因此本研究在不同时间尺度上探讨了植被总初级生产力(GPP)对生长有效积温(GDD)的响应。研究结果发现,在不同时间尺度上GPP与GDD都呈极显著正相关关系。说明高寒湿地生态系统植被的光合生产能力直接受到热量条件的控制,这可能是因为高寒植被有更大的地上生物量[8,23,31],并且温度的累积效应是打破植被休眠、植被返青和生长代谢的主要控制因素[9,21,28,32]。因此,高寒植被在生长代谢方面受到温度的重要影响[33]。此外,温度能够影响土壤中微生物的生物量,以及相关酶的活性,由于湿地土壤中含有大量土壤有机质,并且微生物分解土壤有机质的过程对温度极其敏感,较高的温度能够刺激土壤有机质的分解,为植被的生长提供更多的养分,因此间接有利于提高植被的光合生产能力[21,23]。此外,较高的温度能够促进植被的蒸腾以及湿地表面水分的蒸发,研究表明,湿地表面的水深对土壤呼吸有重要影响;当湿地土壤表面的积水越浅时,越有利于大气中的氧气进入土壤,土壤中的氧气越多,则越有利于微生物对土壤有机质的分解,因此越有利于土壤对植被的养分供应,所以就间接促进植被光合生产能力的提高[34]。
但是,本研究中值得注意的结果是,我们对2004—2016年生长季中每个月份的GPP与GDD做了线性回归分析,发现在5、9月GPP与GDD没有显著相关性,在植被生长旺盛期(7、8月)相关性较强,在7月GPP与GDD的相关性最显著。这可能是由在生长季中不同月份的降水、光合有效辐射、水汽饱和亏等环境因素之间的差异造成的[26-27]。严格上来讲,高寒湿地生态系统植被的总初级生产力受到多种环境因子的控制,并且同一时期的环境因子是相似的,因此分析2004—2016年生长季分别每个月的数据,可以一定程度上减弱其它环境因子对分析结果的干扰,更能准确阐述GPP与GDD之间的客观关系。研究结果显示,在5、9月GPP与GDD没有显著相关性,这可能是因为在生长季初期和末期植被生长缓慢[21,26],光合生产能力较弱,而此时有效积温也较小,所以有效积温的改变对植被光合生产能力的影响并不显著。但是,7月份雨热条件最好[14, 22],植被生长最旺盛,植被在这个时期的光合生产能力最强,因此在这个时期有效积温的变化,会对生态系统的总初级生产力产生极显著的影响,说明此时热量条件对GPP变化的控制作用更强。总体上看,高寒湿地生态系统的总初级生产力受到热量条件的显著影响,即有效积温越大,越有利于植被光合生产能力的提高。我们的研究结果表明,在全球变暖的背景下,有利于青藏高原高寒湿地总初级生产能力的提高,但是有研究也表明温度的升高也会增加生态系统呼吸,因此对于高寒湿地生态系统的碳平衡状态还需要进一步深入的研究。
Wang等[35]利用CENTURY 模型对松嫩平原的预测表明,一定幅度温度的增加,有利于提高植被光合生产能力,当温度升高超过一定阈值,将会造成植被光合生产能力的下降。所以,高寒湿地GPP对温度升高是不是存在阈值效应,以及具体阈值如何等问题仍需进一步深入分析。此外,研究仅探讨有效积温对高寒湿地生态系统总初级生产力的研究,仍有一定的局限性。在今后的研究中应加强对实测生物量、碳储量、碳通量等资料的收集和整理,为生态系统模拟模型的验证和评价工作提供充分的依据,这对未来气候变化的预测更具有实际意义。
4 结论
(1)青藏高原高寒湿地生态系统的日GPP和月GPP表现为先增大后减小的变化趋势,在7月达到峰值。不同年之间的生长季(5—9月)GPP变异性较大,没有明显的变化趋势。
(2)高寒湿地在生长季每个月的有效积温(GDD)表现为先增大后减小的变化趋势,在7、8月达到峰值,5月GDD最小。不同年之间的生长季(5—9月)GDD变异性较大,没有明显的变化趋势。
(3)在日尺度、月尺度、生长季尺度上,GPP与GDD都呈极显著正相关关系(P<0.01)。在7月份的月GPP与GDD相关性最显著(P<0.01)。整体上看,高寒湿地GDD的增加有利于促进GPP的提高,由此表明在全球气候变暖的背景下,将会提高青藏高原湿地生态系统植被的光合生产能力。

