泥炭沼泽湿地土壤分解过程中可溶性有机质氧化还原能力变化特征及其影响机制
陈袁波, 邓思宇, 余 珂, 周旭东, 于志国
南京信息工程大学水文与水资源工程学院, 南京 210044
全球泥炭沼泽湿地(泥炭地)面积仅占陆地总面积的3%,其碳储量却占全球碳储量的30%左右[1]。泥炭地向大气排放大量甲烷,贡献全球CH4负荷的2%—10%[2]。同时,湿地系统特别是泥炭地有机质极为丰富,被认为是固碳能力显著的有机碳库[3]。泥炭分解过程是控制泥炭地碳排放的关键过程,其中可溶性有机质(DOM)是泥炭分解过程主要输出物,前期研究表明DOM富含具有氧化还原活性的官能团(如酚基、醌基),其在有氧和无氧条件下均可参与到湿地生物地球化学关键过程中(如土壤呼吸过程等),相关研究受到广泛关注[4- 8]。酚基可抑制水解酶的活性,进而控制泥炭分解过程,对泥炭碳排放起关键影响作用[9]。通常泥炭地地下水位变化频繁,枯水期地表泥炭土壤可与空气充分接触进而加速泥炭分解,此时,酚基的抗氧化性对减缓泥炭地分解起到关键作用[10]。DOM中除酚基外,醌基氧化还原特性也在实验中也得到验证,其主要形式是通过醌-氢醌的氧化还原循环来进行电子转移[11- 12]。但在醌基参与的实验过程中,总电子转移量略高于醌基得电子能力[13],故推断DOM中还存在其他官能团,如有机硫基团(如硫酸酯等)和含氮官能团(芳香胺)也能参与氧化还原过程[6,14- 15]。
DOM因其无处不在且活性高的特点,成为泥炭地土壤有机质库中最为活跃的组分,对泥炭地碳动态平衡乃至源汇转换具有重要意义。同时DOM作为氧化还原缓冲剂,在临时缺氧条件下将醌基还原为对苯二酚,可以减少甲烷的产生[16]。而DOM的氧化还原能力会受各种因素影响(如来源不同、官能团组成不同、干湿交替等),因此探究其氧化还原能力的主要影响因素,能进一步从机制上厘清DOM对泥炭地参与碳循环、减少甲烷排放的贡献。
有机质中醌基、酚基参与泥炭氧化还原过程已经得到证实,而如何定量分析其参与湿地生物地球化学过程中氧化还原能力变化程度至关重要。此前,广泛应用传统湿化学方法表征DOM氧化还原性能,该方法是基于定量测定化学氧化剂(例如Fe3+物质)的还原或还原物质(例如H2S)的氧化来实现的[5,17]。但上述方法为间接测定的方法,且存在一些问题,如发生副反应、反应缓慢或DOM会与加入的铁一起沉淀等[18]。针对以上方法的不足,Aeschbacher 等[18]开发了介导的电化学分析法,该方法利用恒定的、控制良好的氧化还原条件,直接测定DOM氧化还原过程中痕量的电子转移数,进而实现定量DOM的氧化还原能力变化:电子接受能力(Electron Accepting Capacities,EAC)和电子供给能力(Electron Donating Capacities,EDC),从而精确评估氧化还原梯度变化下DOM参与生物地球化学过程中氧化还原能力的响应程度。
本研究选取德国巴伐利亚州东北部莱斯滕巴赫(Lehstenbach,LB)集水区和德国西北部哈尔茨山脉内的雨养型沼泽奥德斯普伦穆尔(Odersprungmoor,OS)为研究对象,采集两个采样区(LB/OS)地表水、地下水和孔隙水的样品以及采样区OS的泥炭孔隙水剖面,利用创新电化学技术等,定量评估DOM氧化还原能力变化,同时结合DOM的荧光光谱参数结果和泥炭孔隙水剖面数据结果进行整合分析,综合探讨DOM不同来源、DOM官能团组成、泥炭分解程度等对DOM氧化还原能力变化的影响机制,为厘清泥炭沼泽湿地中DOM参与重要生源要素生物地球化学关键过程中可能起到的重要驱动作用提供理论支撑。
1 材料与方法
1.1 研究区域
本研究共选取了两个研究区域。研究区域1为位于德国巴伐利亚州东北部的LB集水区(矿养型沼泽为主,其间有少量雨养型沼泽),面积4.2 km2,海拔695—877 m,1971—2000年年均降水量1150 mm,年均气温5.3℃。云杉覆盖了该集水区95%以上的面积,而湿地则占了该区域面积的30%。在森林覆盖的区域,地下水位在大多在地表以下10 m,而在湿地覆盖的区域,地下水位则在地表附近。本研究在选取了该集水区两个具有代表性的湿地采样点:点1 Gemos(GM)(重新湿润的泥炭地)和点2 Schloppnerbrunnen(SP)[19]。同时对高地泉水 Schloppnerbrunnen Quelle(SQ)点也进行了采样[20]。集水区LB主要受湿地、森林土壤和深层地下水影响[21]。研究区域2为位于德国西北部哈尔茨山脉的自然保护区内的雨养型沼泽OS,海拔800—821 m,平均泥炭深度为3 m,约有17公顷的面积没有任何树木覆盖,为我们采样的区域。沼泽OS主要受泥炭土影响,且泥炭土是本研究该采样区域DOM的唯一来源。
1.2 样品采集
我们于2018年5月和2018年8月分别对LB采样区和OS采样区进行采样。在LB采样区中,我们在泥炭地使用被动式采样器采集深度为35—200 cm地下水,在6个深层地下水观测井中使用抽吸式采样器采集深度为300—1500 cm的深层地下水,并使用土壤溶液取样器(孔径0.15 μm,长度9 cm,直径4.5 mm,Macro Rhizon,荷兰产)分别在GM点采集10—30 cm的孔隙水,在SP点采集10—50 cm的孔隙水。在OS采样区中,我们在泥炭地使用被动式采样器采集深度为35—200 cm地下水,使用上述土壤溶液取样器以5 cm的间隔采集5—50 cm的孔隙水,同时使用抽吸式采样器在0—60 cm浅层以20 cm间隔采集孔隙水,在60—210 cm深层以30 cm间隔采集孔隙水。为尽量减小植被生长可能带来的影响,我们在进行泥炭孔隙水剖面采集时,选取附近没有植被生长的区域,并去除可能含有大量植物残体的最上层土壤。
两采样区的地表水样品均在沿溪流流动路径且距源头不远处采集。另外还需注意:为避免氧化,所有地表水、孔隙水样品均用注射器注入棕色铝塑盖玻璃瓶中保存。所有样品均在4℃条件下进行储存,并尽快运送到实验室,在实验室中用N2冲洗以除去痕量的氧气。分析时所有样品仅在无氧手套箱内打开以避免氧化。
1.3 分析方法
Aeschbacher等[18]通过介导的电化学还原(Mediated Electrochemical Reduction,MER)和氧化(Mediated Electrochemical Oxidation,MEO)实现DOM氧化还原能力的量化,并对Klüpfel等[22]的设置进行调整。设置调整后灵敏度增加,可以检测碳浓度极低(低至2 mg/L)的样品。将9 mL玻璃碳筒作为工作电极和电化学反应容器,以Ag/AgCl作为参比电极,施加一定的氧化还原电位Eh进行测量。对还原(MER)和氧化(MEO)期间的电流峰进行积分,即可量化EAC和EDC(EAC、EDC均以mmole-/gC计)。所有的电化学实验均在无氧手套箱(O2<1 mg/L)中进行。
激发-发射荧光矩阵光谱法(Fluorescence Excitation Emission Matrices,EEM)可用于鉴定DOM氧化还原的官能团。本研究利用Cory和McKnight[23]的平行因子分析(PARAFAC)模型,该模型描述了各样品EEM中13个预识别的固定组分,这13种成分中7种被鉴定为醌类荧光成分。在本研究中,由于没有在缺氧条件下进行荧光测量,故不区分还原和氧化的醌类荧光成分。此外,利用特定紫外吸光度SUVA254(Specific Ultraviolet Absorbance at 254 nm),即水样中标准化DOC浓度在254 nm的紫外吸收率,来获得关于DOM芳香性的信息[24]。使用Aurora 1030湿式氧化TOC分析仪测量DOC浓度和δ13CDOC。
1.4 数据处理和分析
利用Excel 2013和sigmaplot 14.0软件对数据进行处理和分析,并用sigmaplot 14.0软件进行绘图。利用Pearson相关分析法对ETC值与DOM光谱性质参数以及0—210 cm孔隙水剖面的δ13CDOC与SUVA254进行相关性分析。
所有地表水、地下水和孔隙水样品均分成3组平行样品,进行3次重复测定,且标准差范围都在1%内,因此文中图中数据均为平均值。
2 结果与讨论
2.1 表征DOM氧化还原能力的指标的选取
DOM的化学组成和老化程度是影响其参与氧化还原的官能团相对丰度和活性的重要因素。研究选取取自LB采样区森林土壤的DOM与OS采样区沼泽的DOM作为对照,从而对比DOM长时间处于落干和淹水缺氧条件下的区别。对比结果如图1所示。

图1 不同研究区域溶解有机质(DOM)的氧化还原性质对比图Fig.1 Comparison of redox properties of dissolved organic matter (DOM) in different research areasLB:莱斯滕巴赫 Lehstenbach;OS:奥德斯普伦穆尔Odersprungmoor;GW:地下水 Groundwater;LB:地表水 Surface water;PW:孔隙水 pore water
LB采样区森林土壤数据集包括取自森林覆盖区域的深层地下水和从高地泉水SQ点流至森林覆盖区域的地表水,它们在同一地点被采集;OS采样区沼泽数据集包括取自仅受泥炭土影响区域的地表水。沼泽样本的EDC均值为1.6 mmole-/gC,略高于森林土壤样本的0.9 mmole-/gC。而EAC恰好相反,沼泽样本的EAC均值为2.5 mmole-/gC,远低于森林土壤样本的5.1 mmole-/gC。此外,沼泽样品的EDC/EAC比值为0.63,远高于森林土壤样品的0.18(图1)。
除了在LB采样区的深层地下水样品中有很高的ETC值(Electron Transfer Capacities,EAC与EDC之和,即电子转移能力)(中值为8 mmole-/gC,最高可达1 mmole-/gC),两采样区其他样品的ETC值主要在2至4 mmole-/gC之间。对于地表水和地下水而言,两个研究区域内其ETC值差异不大(图1)。因此可以得出,ETC值作为评价氧化还原能力指标,相较于EAC值、EDC值和EAC/EDC比值等指标,不受不同研究地点实际氧化还原状态不同的影响,可更好反映DOM本身的氧化还原能力,故选取ETC值作为表征DOM的氧化还原能力的指标。

2.2 ETC和荧光光谱法联合定量表征DOM氧化还原官能团贡献率
上文我们选取ETC值表征DOM氧化还原能力,为了进一步评估DOM氧化还原活性官能团的贡献,我们将ETC值与DOM的光谱性质参数(SUVA254值和醌类荧光成分比例)进行了相关性分析。用SUVA254值指示DOM中的酚基,醌类荧光成分比例指示醌基[23]。探讨ETC值与SUVA254值和醌类荧光成分比例的相关性,即为验证酚基和醌基是否是控制DOM氧化还原能力变化的关键变量。
对于酚基,在LB采样区,深层地下水样品主要受森林土壤影响,DOC浓度非常低(大多数<3 mg/L),与回归线偏差较大,因此从数据序列中排除(图2)。受湿地影响的样品的ETC值与SUVA254值的相关性不大(R2=0.21,N=16,P<0.05)。在OS采样区,所有样品的ETC值与SUVA254值的相关性很强(R2=0.90,N=24,P<0.01)。除LB采样区中受森林土壤影响的样品外,整个样品数据集(即LB湿地样品和OS沼泽样品)的ETC值和SUVA254值之间的R2=0.70(N=40,P<0.01),相关性较强。

图2 ETC值与DOM光谱性质参数的相关性分析Fig.2 Correlation of ETC with spectroscopic DOM quality parameterDOM:可溶性有机质Dissolved organic matter
对于醌基,在OS采样区中,ETC值与醌类荧光成分比例之间具有很强的相关性(R2=0.87,N=24,P<0.01)。而LB采样区由于样品差异较大,整个样品数据集的ETC值与醌类荧光成分比例之间没有相关性,所以我们通过泥炭颜色和植物堆积物情况将样本分为高分解度泥炭和低分解泥炭,其中高分解度泥炭偏黑褐色和黑色,植物残体较少且不易辨认;低分解度泥炭偏浅棕色和浅褐色,含有大量易于辨认的植物残体[2]。高分解度泥炭样品取自GM点和SP点;低分解度泥炭样品取自GM点和SP点的上游,该区域主要以沼泽为主。相同醌类荧光成分比例下,高分解度泥炭样品与其他样品相比,ETC值较低,与回归线偏差较大,因此从数据序列中排除;同理,相同醌类荧光成分比例下,受森林土壤影响的深层地下水样品与其他样品相比,与回归线偏差较大,也从数据序列中排除(图2)。除LB采样区中受森林土壤影响和高分解度的样品外,整个样品数据集(即LB和OS沼泽样品)的ETC值和醌类荧光成分比例之间存在较强相关性(R2=0.73,N=35,P<0.01)。
在OS采样区沼泽样品的数据中,泥炭土作为DOM的唯一来源,ETC值与PARAFAC模型中的所有醌类荧光成分比例之间存在强相关性。LB采样区样品数据的一部分,其DOM性质与OS采样区相似,主要在OS采样区的回归线上。基于Inamdar等[27]的分类,OS采样区的样品与LB采样区低分解度泥炭样品之间的相似性得到了较高比例的C5荧光成分(作为来自高等植物的DOM的指标)和较低比例的C3荧光成分(作为微生物驱动的DOM的指标)的支持。这些结果表明,仅对于具有相似组成的DOM,来自Cory和McKnight[23]的PARAFAC模型的醌类荧光组分比例可用作DOM中氧化还原活性部分的指示物,而不同类型土壤影响的DOM以及不同分解程度的DOM不适合相互对比。同理,在OS采样区沼泽样品的数据中,泥炭土作为DOM的唯一来源,ETC值与SUVA254值之间存在强相关性。LB采样区受湿地影响的样品,其DOM性质与OS采样区相似,主要在OS采样区的回归线上。而受森林土壤影响的样品DOM性质与OS采样区不同,与回归线偏差较大,从数据集中排除。通过上述分析,发现除去部分与回归线偏差很大的样品,整体样品数据集(即泥炭沼泽湿地土壤)的ETC值与SUVA254值和醌类荧光成分比例存在强相关性(特别是OS采样区的样品),结果表明酚基和醌基是泥炭沼泽湿地土壤DOM的氧化还原能力重要组成部分。
荧光光谱表征DOM的一个重要问题是,DOM不是许多明确定义的化合物的混合物,而是由多种相对低分子量组分组成的集合,并通过疏水相互作用和氢键稳定形成动态关联[28]。因此,通过将荧光光谱与PARAFAC组分的光谱进行比较并不能鉴定明确定义的化合物。此外,有可能会出现一个或多个醌基部分的荧光反应非常弱或者被其他不相关的DOM化学成分的荧光反应所掩盖,并且不能从整体EEM模式中分离[29]。因此,即使该醌基部分的浓度恒定,该特定醌类荧光成分与总荧光的比例也可能会随着其他化学组分的荧光反应变化而变化。根据本研究测定数据,尚未发现特定醌类荧光成分与EAC值或EDC值之间的任何相关性,这与Macalady和Walton-Day[29]和Maurer[30]等研究结论一致,他们也没有发现化学或电化学还原过程中荧光光谱的预期变化。研究中预期变化的缺失的可能原因是荧光测量并未在无氧条件下进行操作,而是在在有氧条件下进行的。
2.3 泥炭分解程度与DOM氧化还原变化关系
“2.2节”定量、定性的确定酚基、醌基是DOM参与氧化还原重要官能团,但仍有部分电子流归趋不详,推断可能是其他含硫、含氮官能团起到相关作用。与此同时,为了厘清泥炭分解具体与哪种官能团有关,又是通过什么途径影响DOM氧化还原能力变化,本部分对“2.2节”中ETC与SUVA254和醌类荧光成分比例相关性较好的OS采样区进行进一步采样分析,在5—50 cm和0—210 cm两种采样深度范围内分别探讨孔隙水中DOM氧化还原特性(醌类荧光成分比例、SUVA254、ETC)与受泥炭分解影响程度(泥炭分解指标C/N比和δ13CDOC)的关系等。各参数随深度变化情况如图3所示。
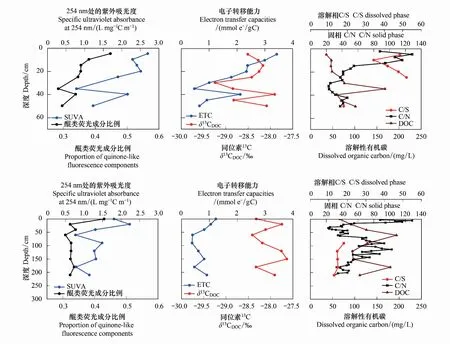
图3 OS采样区土壤孔隙水剖面各参数随深度变化图Fig.3 Variation of various parameters of soil pore water profile with depth in OS sampling area
利用土壤溶液取样器(孔径0.15 μm,长度9 cm,直径4.5 mm,Macro Rhizon,荷兰产)获得的5—50 cm深度的土壤孔隙水剖面的数据表明:从整体变化趋势上来看,醌类荧光成分比例和SUVA254值的变化趋势相似,大体上都是从近地表向深层递减,并在35—40 cm深度出现递增;两者的最高值都出现在5 cm深度处(0.45 L (mg C)-1m-1和2.7 L (mg C)-1m-1),最低值也都出现在35 cm深度处(0.28 L (mg C)-1m-1和0.8 L (mg C)-1m-1)。但不同的是,醌类荧光成分比例在最初的5—15 cm深度迅速减少,而SUVA254值在最初的5—20 cm深度相对恒定,在20—35 cm深度出现迅速下降。ETC值和醌类荧光成分比例的变化趋势几乎完全一样,与SUVA254值的变化趋势也就5—20 cm较浅深度略有不同。相比之下,δ13CDOC仅在深度大于25 cm时具有与醌类荧光成分比例,SUVA254值和ETC值类似的趋势,在最初的25 cm中,值在-28.5和-28.2‰之间,然后在30 cm深度下降至-29.2‰,最后在40 cm内再次增加至-27.9‰。固相的C/N比值在表面附近最高,为85至130,在15 cm处降至54,随后在50 cm处降至25到50之间。C/N比的最小值为23,出现在醌类荧光成分比例,SUVA254,ETC和δ13CDOC最小值所在的深度处。
利用抽吸式采样器获得的0—210 cm深度的土壤孔隙水剖面的数据表明:醌类荧光成分比例从地面的最高值0.43迅速减小到20 cm深度处的0.32,然后相对恒定,平均值为0.33。从整体上来看,δ13CDOC与SUVA254值具有高度相似的变化规律,且有较强的相关性(R=0.71,N=8,P<0.05)。但δ13CDOC在深处再次达到与表面附近相似的值(150 cm处约为-27.6‰,而20 cm处为-27.8‰),而SUVA254值通常在较大深度处较低(在150 cm处为1.3 L (mg C)-1m-1,而在20 cm深度中为2.2 L (mg C)-1m-1)。ETC值在前60 cm深度从1.2 mmole-/gC下降到0.4 mmole-/gC,然后随着深度慢慢增加,在210 cm深度处又增加到0.9 mmole-/gC。固相的C/N比值具有与δ13CDOC和SUVA254值相近的变化趋势。
δ13CDOC作为一种表征泥炭分解的常见指标,一般来说,由于微生物在分解过程中优先摄取12C,13C在DOM的氧化分解过程中富集[31]。在泥炭分解过程中,δ13CDOC还受气候和植被等其他多种因素的影响[32]。一些研究表明,对于泥炭沼泽来说,气候因素可能是δ13CDOC的最重要的影响因素[10],但这一点仍然存在争议,并且在不同的研究地点,观察到完全相反的影响作用[33]。因此,必须考虑使用其他指标来共同表征泥炭分解。C/N比是另一种表征泥炭分解程度的常用指标,基于分解过程中C相对N较高的损失[34]。
固相的C/N比值表明,泥炭在40和60 cm之间高度分解,而在该深度中,δ13CDOC和SUVA254也脱脂。虽然δ13CDOC受很多因素影响,但δ13CDOC和SUVA254值作为芳香性的指标,之间存在高度相似的变化规律,主要与酚基含量和较低的氧化转化率有关,由此可知泥炭分解主要通过其自身酚基含量的变化与DOM氧化还原能力变化联系起来。而泥炭孔隙水剖面分析结果表明在近地面δ13CDOC与其他参数之间没有关系,这可能是由于该区域层全年没有积水,而与缺氧条件下相比δ13CDOC在有氧条件下受各种其他因素影响更大。
在两种土壤孔隙水剖面中,除近地面的部分深度样品外,SUVA254值始终与ETC值的变化趋势高度相似;而醌类荧光成分比例仅在近地面20 cm深度的样品中显示出与ETC值高度相似的变化规律,在更深层它是相对恒定的。这是由于醌基可以在芳族酚部分的酶促氧化过程中形成[35],但这只能在有氧条件下实现[9],在长时间的缺氧条件下新的醌类化合物不太可能产生。由此可以得出结论,仅在全年没有淹水的近地面20 cm深度,醌基含量是影响ETC值变化的关键因素,而在任意深度ETC值始终受到与EDC值相关的酚基含量的影响(其对ETC值贡献了约75%)[36-37]。因此,在泥炭沼泽湿地土壤中,醌基仅在没有淹水、有氧的近地表20 cm深度是影响DOM氧化还原能力的重要因素,而在任意深度酚基始终起到关键作用,特别是在未受地下水位泥炭孔隙水波动影响的较大深度处。

图4 OS采样区C/S比值与ETC值,EDC值和EAC值的相关关系Fig.4 Correlation between C/S ratio and ETC, EDC and EAC in OS sampling area
2.4 有机硫基团对DOM氧化还原能力影响的可能机制
OS采样点中,由于泥炭孔隙水中的硫代硫酸盐浓度大多较低[25],且无机硫可以忽略不计,可以推断大部分硫是以有机态赋存在泥炭土壤中。因此,本研究使用C/S比指示不同来源DOM中硫的变化情况。在5—50 cm泥炭孔隙水剖面中:溶解相中的总硫含量为75—500 μmol/L,平均值为173 μmol/L。在近地表30 cm深度剖面,C/S比值在34和50之间,而在50 cm深度处比值为18(图3)。在0—210 cm剖面中:总硫含量整体呈现随深度增加浓度增加的趋势,泥炭孔隙水剖面中溶解相中的总硫含量为变化范围是340—1000 μmol/L,平均浓度为620 μmol/L 。计算的C/S比值从90 cm深度处的18随着深度略微减小到210 cm深度处的12(图3)。
上述结果表明OS采样区样品中硫含量较高,且主要以有机态赋存。因此,为了研究有机硫基团的对DOM氧化还原能力的影响,将EAC值,EDC值和ETC值与OS采样区孔隙水样品的C/S值比进行比较(图4)。随着C/S比值的增加,EAC值,EDC值和ETC值也增加,这反映了地表样品中较高的C/S比值伴随着较高的EAC值,EDC值和ETC值。如果有机硫基团是过去暴露于高硫酸盐沉积的腐蚀性泥炭中的重要氧化还原活性部分,我们可以预期C/S比值与EDC值之间存在负相关,如Yu等[38]发现在向标准腐殖酸添加硫化氢后溶DOM的EDC测定值也增加。而在我们的研究中正好相反,这可能与本研究所选样地硫主要以有机态赋存,还原性无机硫含量较少有关。研究中OS采样区C/S比值和EAC值,EDC值以及ETC值之间出现正相关关系,但所有这些值在近地表均较高,相关关系存在偶然性,可能彼此之间并无因果关系。因此,虽然有机硫基团可能对DOM氧化还原能力有一定影响,但根据本研究实验结果尚不能直接证实,其可能的影响机制还需进一步的实验探究。
3 结论
(1)研究通过测定来自LB和OS采样区地表水,地下水和孔隙水样品DOM的氧化还原性质结果发现:所有泥炭沼泽湿地的样品ETC值与SUVA254值和醌类荧光成分比例具有强相关性,表明在泥炭沼泽湿地中酚基和醌基对DOM的氧化还原能力具有重要作用。
(2)在OS采样区泥炭沼泽湿地土壤孔隙水剖面中,对DOM氧化还原能力指标ETC值、酚基和醌基的光谱参数,泥炭分解指标,C/S比值等之间的相关关系进行研究得出:泥炭沼泽湿地土壤孔隙水中,醌基仅在没有淹水、有氧的近地表20 cm深度是影响DOM氧化还原能力的关键因素,而在任意深度酚基始终是DOM氧化还原活性部分重要的驱动因素,特别是在未受地下水位波动影响的较大深度处。至于有机硫基团对DOM氧化还原活性的贡献,本研究尚未得到明确结论。
该研究表明,在泥炭分解过程中,DOM中的酚基全程参与氧化还原过程,起到了至关重要的作用,是评估DOM参与湿地生物地球化学过程中的关键变量。同时DOM中的酚基含量随泥炭分解程度变化而变化,对泥炭分解本身以及泥炭分解输出的DOM也起到重要的控制作用。本研究探讨泥炭分解过程中DOM氧化还原特性能力变化特征及其影响机制,为厘清有机质与泥炭沼泽湿地生物地球化学过程提供理论支撑。

