下肢人工血管移植物内瘘的应用及中远期效果观察
彭嘉欣,万恒
(南方医科大学南方医院 血管外科,广东 广州 510515)
终末期肾病(end stage renal disease,ESRD)是各种原因导致的慢性肾脏疾病进展到终末期阶段,国内成年人患病率达0.03%[1]。大部分ESRD患者选择血液透析肾脏替代治疗,因此,功能良好且通畅率令人满意的血管通路对其至关重要。目前国内外专家共识均认为,自体动静脉内瘘(arteriovenous fistula,AVF)是ESRD患者维持血液透析首选的血管通路,对于无条件构建AVF的患者,人工血管移植物内瘘(arteriovenous graft,AVG)是仅次于AVF通路的第二选择[2-3]。其中上肢是患者构建血液透析通路的首选位置,但部分患者因各种原因存在上肢血管资源耗竭或中心静脉资源耗竭(中心静脉闭塞无法开通的或开通后无法维持中心静脉的长期通畅)等问题,无法构建上肢血管通路。针对这一问题,可以考虑构建下肢AVG作为患者长期血液透析的通路[4],目前国内关于下肢AVG构建及中远期通畅情况的报道较少,本研究回顾性分析本中心构建的下肢AVG患者临床资料与中远期随访结果。
1 资料与方法
1.1 一般资料
收集自2014年3月—2018年11月南方医科大学南方医院血管外科收治的建立下肢AVG的32例患者的临床资料,男1 4 例,女1 8 例;平均年龄为(58.1±13.56)岁,构建下肢AVG的指征:⑴年龄≥18岁;⑵确诊为ESRD,需要行规律血液透析;⑶中心静脉(上腔静脉和/或双侧无名静脉)资源耗竭无法行上肢的AVF或AVG;⑷手术侧肢体血管条件良好。 排除标准:⑴全身合并未控制感染或手术区域存在感染;⑵手术侧股静脉、髂外静脉以及下腔静脉狭窄或闭塞;⑶手术侧下肢动脉存在严重粥样硬化或钙化;⑷凝血功能障碍;⑸低血压[收缩压<90 mmHg(1mmHg=0.133 kPa)]。本组患者一般情况见表1,用于构建AVG的人工血管为美国戈尔GORE-TEX(S46045)或即穿型人工血管(GORE ®Acuseal)。
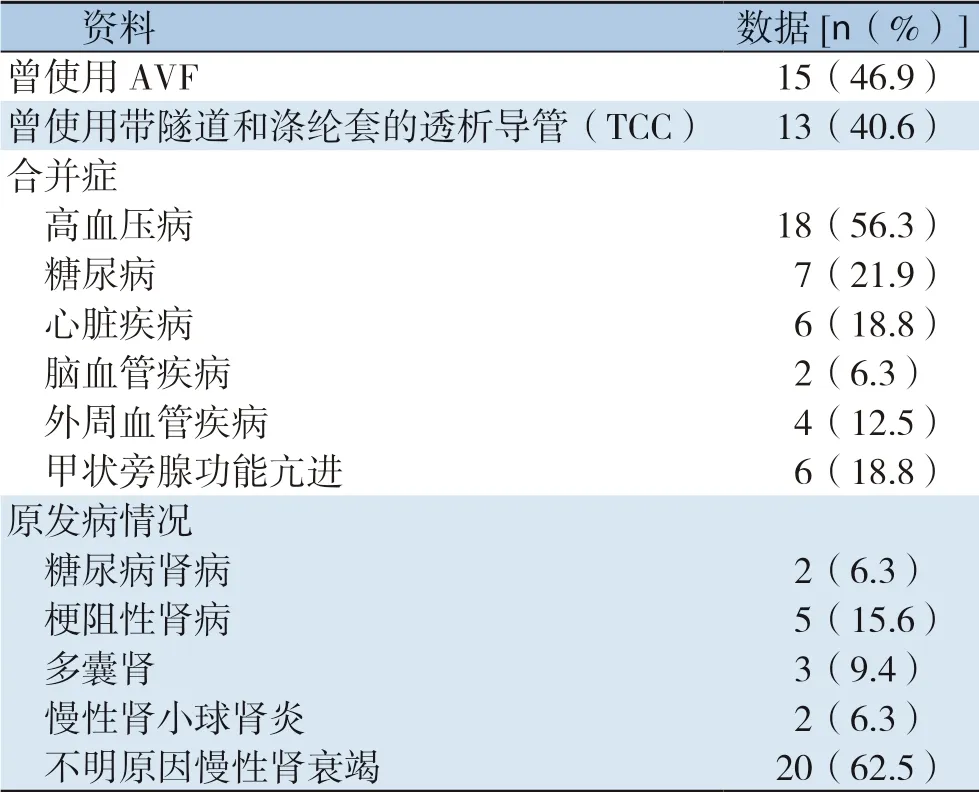
表1 患者一般情况Table 1 The general data of the patients
1.2 手术方法
患者均采用椎管内麻醉,以移植物植入大腿上段为例:取腹股沟中点沿股动脉走行长5~6 cm纵行切口,切开皮肤、皮下组织(若静脉端吻合至大隐静脉则游离大隐静脉后备用),切开深筋膜,分离出股总动脉、股浅动脉及股深动脉并过带备用(若静脉端吻合至股静脉则游离股静脉备用)。于大腿上段偏外侧做皮下隧道,植入人工血管,先吻合动脉,阻断欲吻合段动脉的远端及近端;以CV-7膨体聚四氟乙烯(expanded polytetrafluoroethylene,ePTFE)血管缝线将人工血管与动脉行端侧吻合;根据情况,人工血管静脉端与相应静脉行端端或端侧吻合,吻合完成前注意排气排屑;开放循环后,检查各吻合口漏血及人工血管搏动及震颤情况,确认移植物通畅后,逐层缝合切口。大腿上段和下段植入的手术图片见图1-2。AVG植入情况如表2所示。
1.3 术后随访及评价指标
术后不常规抗栓治疗,术后要求患者第1个月以及之后每3个月复诊,随访内容包括查体、瘘管流量、静脉压、透析过程是否异常等,并进行常规超声检查等,随访过程中发现AVG狭窄、闭塞或其他情况,采用腔内或外科开放手术进行相应修复。初级通畅时间:从透析通路建立到第一次需要进行手术处理的间隔时间。次级通畅时间:从血管通路建立到通路废弃的时间间隔,不论通路曾实施过多少次手术干预。

图1 大腿上段AVG(股浅动脉-大隐静脉上段) A:术前设计;B:手术完成Figure 1 Upper thigh AVG(femoral artery-upper saphenous vein)A:Preoperative design;B:Operation completion
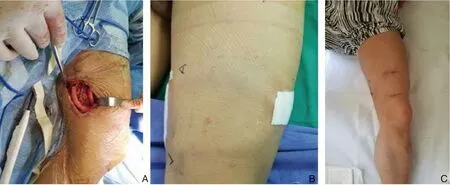
图2 大腿下段AVG(股浅动脉下段-大隐静脉下段) A:移植物位置;B:手术完成;C:术后2年Figure 2 Lower thigh AVG(lower superficial femoral artery-lower great saphenous vein) A:Graft position;B:Operation completion;C:Two years after operatio
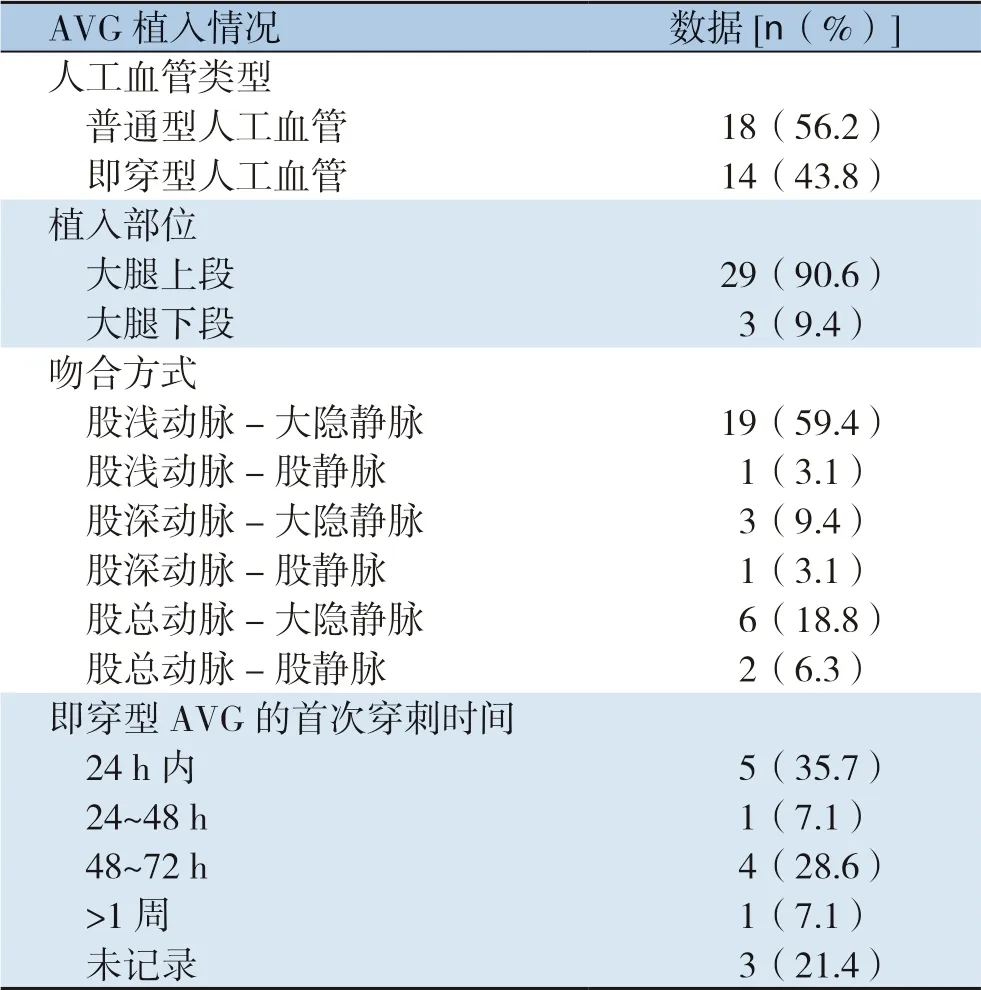
表2 AVG 植入情况Table 2 Characteristics of AVG
1.4 统计学处理
用Excel汇总患者的手术方式、术后随访等临床资料,采用SPSS 19.0进行统计学分析,计量资料用均数±标准差(±s)表示,计数资料用例数(百分比)[n(%)]表示,用Kaplan-Meier法计算患者术后的初级通畅率和次级通畅率。
2 结果
2.1 手术结果
本组32例患者术后均能触及AVG震颤,1例患者术后出现慢性心功能不全急性发作,予药物、加强透析治疗后未见明显好转后死亡;2例患者术后第1天出现移植物血栓形成,切开导管取栓后造影未见吻合口及流出道静脉狭窄,术后AVG恢复通畅,顺利透析。本组患者下肢AVG的手术技术成功率90.6%。所有患者围术期间无感染、透析通路相关性肢端缺血综合征(hemodialysis accessinduced distal ischemia,HAIDI)、假性动脉瘤等并发症发生。
2.2 随访结果
术后随访1~60个月,中位随访时间为14.1个月。随访期间3 例患者因肺部感染死亡,3 例患者逐渐失访。随访期间出现A V G 狭窄的患者有1 3 例(40.6%),闭塞10例(31.3%),经外科手术或腔内手术修复后恢复AVG通畅。人工血管移植物感染3 例(9.4%),其中1 例患者移植物局段感染,行人工血管移植物感染段切除,自体静脉移植术后顺利保留AVG并用于透析,2例患者因移植物全段感染予全段切除。随访期间未出现假性动脉瘤、HAIDI等并发症。患者术后初级通畅时间为(20.4±3.32)个月,1、2、3年初级通畅率为64.6%、44.7%、19.6%;次级通畅时间为(38.7±5.52)个月,1、2、3年的次级通畅率为79.6%、79.6%、54.6%,通畅时间曲线如图3所示。
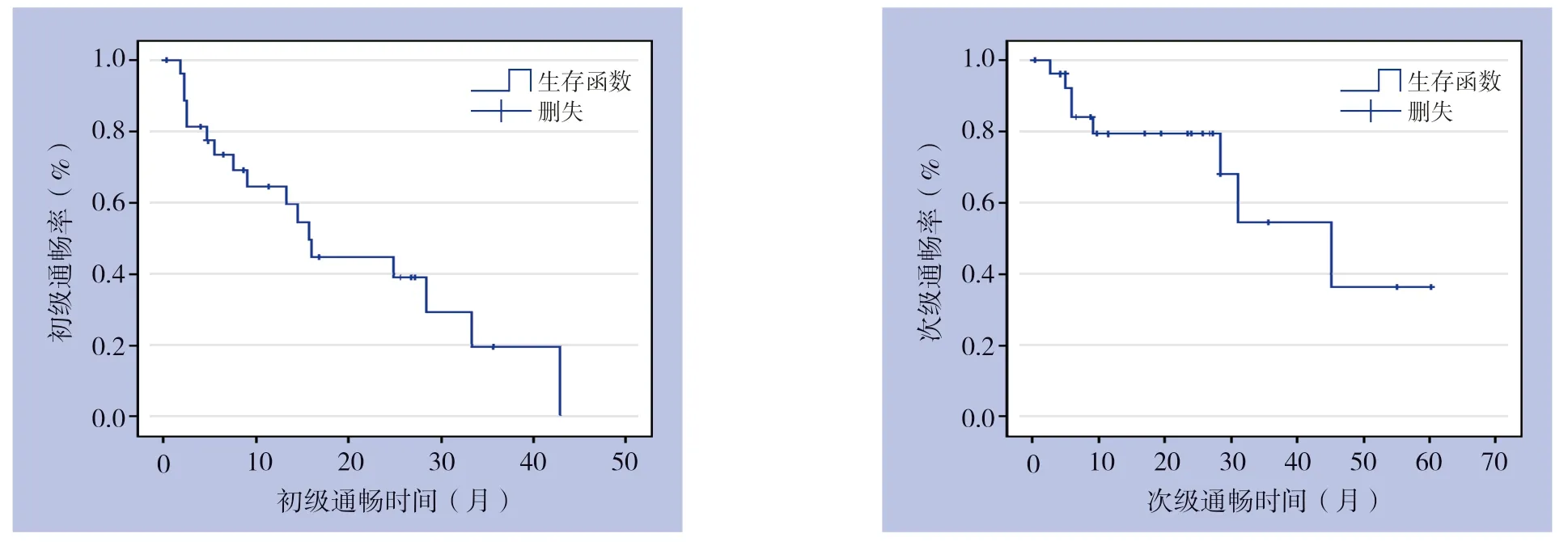
图3 初级通畅时间曲线和次级通畅时间曲线Figure 3 Primary patency time curve and secondary patency time curve
3 讨论
随着血液透析治疗技术发展,ESRD患者生存期逐渐延长。患者透析龄增加,往往合并高血压、糖尿病等全身基础疾病,自身血管条件较差,加之缺乏早期建立透析通路的理念使得中心静脉导管置入患者比例较高,导致上肢静脉资源耗竭或中心静脉资源耗竭的病例不断增多。对于无法建立上肢血管通路的患者,下肢血管通路成为重要的替代方案[5]。
近年国外文献报道下肢A V G 的1、2、5年的初级通畅率约为3 8%~7 1%、2 7%~4 0%,1 7%~1 9%,1、2、5年的次级通畅率约为61%~90%,54%~83%,38%~51%[6-10],本组患者中1、2、3年初级通畅率为6 4.6%、4 4.7%、1 9.6%;1、2、3年的次级通畅率为7 9.6%、79.6%、54.6%,与国外报道的通畅率相似。与TCC相比,下肢AVG的次级通畅率(HR=4.44,P<0.001)和无感染存活率(HR=3.77,P<0.001)具有明显优势[7]。近年也有研究[11]报道中心静脉资源耗竭的患者可以建立导管-人工血管复合装置的HeRO(hemodialysis reliable outflow)系统,认为HeRO系统与下肢AVG的通畅率、感染率、全因病死率、维持通畅的干预措施次数相似;也有研究[12-13]表明下肢AVG在初级、次级通畅率上优于HeRO系统,在维持通畅的干预措施上,HeRO系统组每年需要行2.21次干预治疗,而下肢AVG组仅需1.17次(P=0.003)[14]。且若导管导丝无法开通严重的中心静脉病变(长段闭塞),则无法植入HeRO系统。此外,文献报道下肢AVG和上肢AVG的无干预生存率、无血栓生存率和次级生存时 间相似[15],下肢AVG与下肢AVF的初级通畅率、再干预率、病死率相似[16]。另一项长达8年的纵向随访研究[17]中发现下肢AVG的无血栓形成率和无干预生存率较上肢AVG和AVF的高,且5年次级生存率较AVF高(47% vs.11%,P<0.01)。因此,下肢AVG经外科手术或腔内技术等修复方法仍可以达到较满意的次级通畅率,对于无法建立上肢血管通路患者而言,是优于TCC和HeRO系统的选择。
本组纳入A V G 的两种类型人工血管分别是ePTFE材质的普通型人工血管和即穿型人工血管。即穿型的人工血管由于特殊的三层管壁结构,能够使患者术后早期穿刺透析成为可能[18]。Wagner等[19]的研究中约4 5%的患者在术后3 d 内使用AVG。本组中有10例(71.4%)患者术后3 d内顺利使用即穿型AVG进行透析。文献[19-20]表明两种AVG在通畅率和并发症(HAIDI、移植物感染等)上无明显差异,由于构建下肢AVG的患者中心静脉病变无法行导管植入,采用即穿型的移植物构建AVG可以使患者无需使用透析导管过渡或者极大的减少透析导管过渡的时间,可以更好的保护下肢深静脉资源,减少导管相关的并发症的发生率。
有关下肢A V G 吻合的动脉及静脉血管的选择,目前仍有争议,在本组的患者中,动脉端吻合的部位包括股总动脉、股浅动脉以及股深动脉,从预防术后出现HAIDI的角度出发,股深动脉应是最佳的选择,因为股深动脉对于下肢远端供血的贡献较小,但从解剖角度出发,股深动脉的分离暴露较为困难,且能够游离的血管长度较小,吻合的难度较大。因此,具体动脉端吻合部位的选择,应根据动脉局部条件(管径的大小、是否合并严重的动脉粥样硬化或钙化等)来决策。静脉端可以选择大隐静脉或股静脉,本组患者中静脉端吻合部位大多选择大隐静脉,因大隐静脉位置表浅,在汇入至股静脉之前的部位管径较粗,吻合难度较小,且可以保留股静脉作为以后的静脉流出道。
下肢A V G 并发症与上肢A V G 的相似,术后主要的并发症仍是通路狭窄和继发血栓形成,文献[15]报道下肢AVG的无血栓通畅率与上肢AVG相似,也有文献[17]报道下肢AVG的无血栓形成率和无干预生存率较上肢AVG的高,对此暂无定论。下肢AVG通路狭窄和闭塞的处理原则与上肢AVG基本相似。狭窄部位处理包括外科开放手术(移植物旁路、补片)和腔内介入手术(球囊扩张、支架植入)等手段。但无论使用何种方法进行修复,AVG静脉端狭窄性病变易于复发,术后再狭窄的发生率高[21-24],因此定期检查随访、早期发现狭窄性病变并进行处理可大幅度减少移植物血栓形成的频率。
下肢A V G 因其位置靠近腹股沟区和会阴部,移植物感染率高于上肢A V G,感染率约为11.1%~46.0%[9,15,25],其中Cull等[26]报道移植物感染率约40.8%,包括围术期感染率约11.2%。本组患者中有3 例发生感染,均与穿刺相关,感染率约9.4%,通过手术过程中严格的无菌操作及预防性抗菌素使用,可以有效的降低围术期的移植物感染发生率,嘱患者养成良好的卫生习惯以及穿刺过程严格的无菌操作有助于降低穿刺相关的移植物感染。根据移植物局部或全段感染的具体情况,采用需采用移植物部分切除、重建或移植物全部切除,原则上尽量保留移植物。AVG感染的致病菌大多是革兰氏阳性菌(如金黄色葡萄球菌),但文献[27]报道与上肢AVG相比,下肢AVG革兰阴性菌感染的比例更高(31% vs.4%,P=0.003),且下肢AVG更容易发生转移性感染(15% vs.3%,OR=5.24),因此下肢AVG感染初步经验用药时应酌情使用广谱革兰氏阴性菌覆盖的抗生素(如氨基糖苷类或第三代头孢菌素)。
尽管临床上将通路血流量>1.5 L/ m i n 和(或)通路血流量/心输出量≥20%的内瘘称为高流量内瘘[2],但其确切阈值尚未得到严格验证[28]。患有慢性心脏疾病患者建立高流量内瘘后可能导致高输出量心力衰竭,目前文献中多见于病例报道[29],发病率尚不明确。本组患者中1例术后出现心功能不全急性发作,考虑患者既往慢性心功能不全,建立下肢AVG后使回心血量增加,导致高输出量心力衰竭。为避免发生,术前应详细评估心脏功能,术中应控制人工血管吻合口径;然而慢性心功能不全的患者仍可能在低于阈值时出现充血性心力衰竭症状,因此对风险较高的患者建议改用TCC或腹膜透析等治疗。
下肢AVG常见并发症还有HAIDI、假性动脉瘤等,本组均未发生。文献[26,30]报道下肢AVG肢体缺血的发生率较上肢AVG的高,发生率约1%~16%。HAIDI治疗原则上尽可能保护通路,但若使用保暖、药物等保守治疗后缺血症状(肢体末端苍白、发凉、疼痛、坏疽)无明显改善,应尽快行瘘管缩窄、结扎内瘘、甚至截肢等手术治疗。为避免HAIDI的发生,术前应充分评估下肢动脉有无狭窄、钙化等病变,但目前并无准确预测缺血发生的方法。穿刺相关假性动脉瘤是反复穿刺同一部位所致,将增加感染和出血的风险,因此透析时尽量采用绳梯式穿刺,以减少发生。不合并感染的假性动脉瘤治疗上多采用假性动脉瘤切除、自体血管或人工血管桥接,覆膜支架植入等。
总之,对于中心静脉资源衰竭的ERSD患者而言,下肢AVG是安全、有效的血管通路,规范的术前评估、严格的手术及穿刺无菌操作以及规律的随访是保证其远期通畅的重要因素。但本研究纳入病例数较少且为单中心回顾性研究,下肢AVG的远期通畅率及并发症发生率等更准确的数据有待大样本的随机对照研究来验证。

