颈动脉体瘤的无术前栓塞手术切除的疗效分析:附单中心65例报告
王浩骅,杨斌,张承磊
(昆明医科大学第一附属医院 血管外科,云南 昆明 650032)
颈动脉体瘤(carotid body tumor,CBT)又称副神经节瘤或化学感受器瘤[1],是一种发生于颈总动脉分叉处的罕见的化学感受器肿瘤,发病率低(1:30 000),占头颈部副神经节瘤的60%[2-7]。国内外临床相关文献报道,其多发于30~40岁人群[8],女性发病率远超男性发病率,男女比例约1:31.2[9],多为单侧发病,双侧发病更为少见,有家族遗传倾向[10-12],其发病机制尚不明确,可能考虑同慢性低氧刺激及女性激素变化有关[13-15]。因体瘤发病部位特殊,时常累及颈部重要神经和血管,病变发展后可能引起相关的占位症状,故目前国内外主张一旦诊断明确,应尽早手术切除[16-20]。由于病变血供丰富,部分学者认为可通常使用术前栓塞术[21-24],但该方式一直存在争议。支持者认为栓塞可以最大程度减少术中失血和相关并发症,批评者认为该方式造成卒中的风险大于获益[25-26]。因此本文回顾性分析昆明医科大学第一附属医院血管外科3年间收治的65例CBT患者的临床资料,对无术前栓塞情况下切除肿瘤的相关治疗经验做一总结,现报告如下。
1 资料与方法
1.1 一般资料
选取昆明医科大学第一附属医院血管外科2017年1月—2020年1月确诊并行手术的65例患者的临床资料,其中男9例,女56例,男女比为1:6.22;年龄11~73岁,年龄中位数48岁,平均年龄为4 9.0 8 岁;单侧病变6 3 例,双侧病变2 例(选取第一次手术侧资料),共计6 5 个瘤体;病程6个月至26年,中位数为3.7年;肿瘤大小为1.0 cm×0.5 cm×1.0 cm~8.0 cm×6.5 cm×8.5 cm,平均大小为4.6 cm×3.2 cm×2.3 cm。根据Shamblin分型[27],63例单侧CBT患者的分型分别为:I型13例,II型32例,III型18例;2例双侧CBT患者的分型分别为:左侧I型、右侧II型1例,左侧II型、右侧III型1例(表1)。因单纯颈部肿块就诊、无其他临床症状者57例,伴肿物疼痛者3例,伴头晕者4例,伴声音嘶哑者1例。1例有家族遗传病史(其父曾诊断C B T)。患者地域分布为:保山1 例,楚雄7 例,大理3 例,迪庆2 例,红河3 例,昆明16例,丽江1例,怒江1例,普洱1例,曲靖16例,玉溪5例,昭通9例。
1.2 临床表现
多数患者为无意中发现颈部包块或行其他检查提示颈部包块前来就诊,少数患者表现为声音嘶哑、吞咽不适或头晕为首发症状。阳性体征:触诊可及下颌角颈动脉分叉处搏动性包块,不能上下移动可左右平移,部分患者听诊可闻及杂音。入院时合并声音嘶哑1例,头晕4例,术前恶性高血压(有神经内分泌活性)3 例。双侧病变2例,左侧病变36例,右侧病变27例。
1.3 诊断方法
主要根据体格检查及B 超或C T 血管造影(computed tomography angiography,CTA)做出诊断。所有患者均行术前CTA检查,表现为颈动脉分叉处近圆形边界清晰的肿块,增强后明显均匀强化,颈动脉分叉变大,部分患者肿块不同程度包绕颈动脉,CTA同时明确头颈动脉血管走形情况及大脑Willis环是否完整(图1)。

表1 65 例患者一般资料情况Table 1 General information of the 65 patients
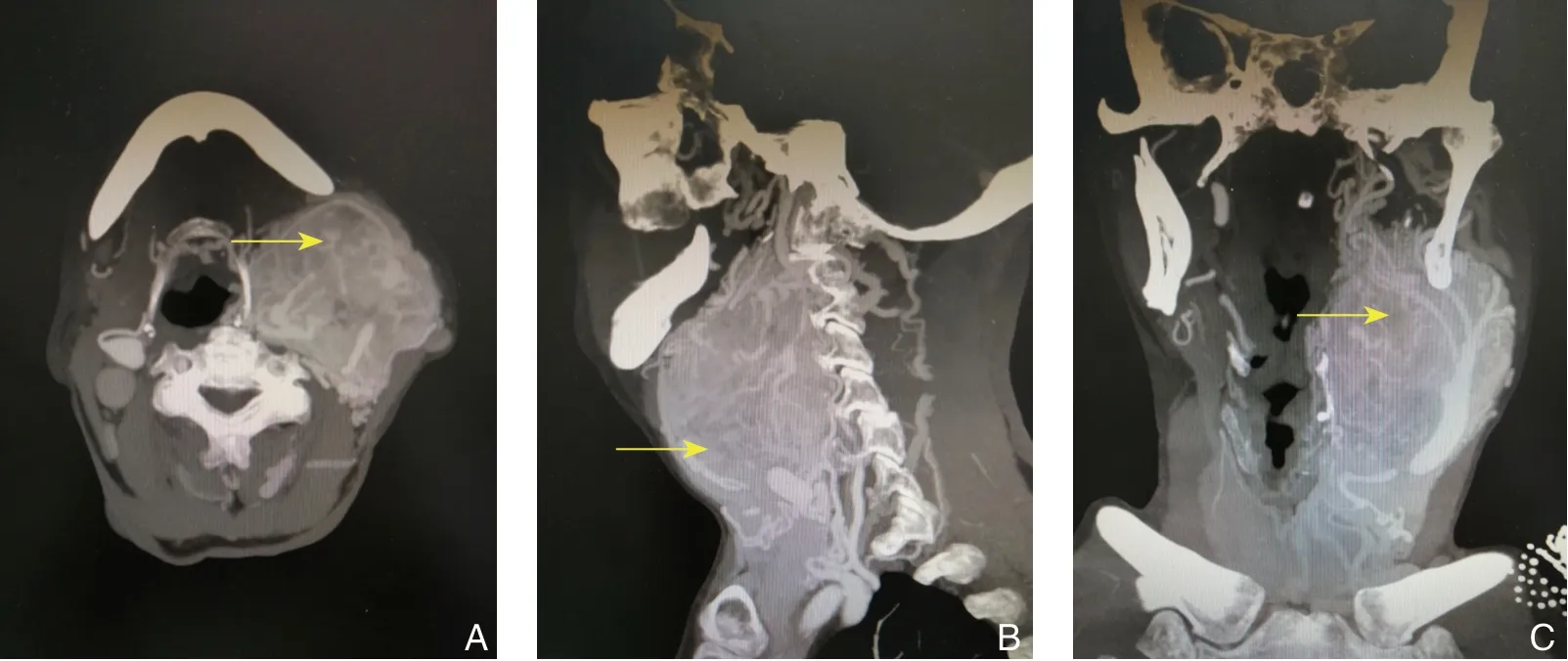
图1 1 例Shamblin III 型CBT 患者的CTA 图像(瘤体较大,包绕颈动脉,瘤体内血供丰富) A:横断面;B:矢状面;C:冠状面Figure 1 CTA images of one case with Shamblin type III CBT(a relatively large tumor enveloping the carotid artery,with abundant blood supply in the tumor body) A:Transverse plane;B:Vertical plane;C:Coronal plane
1.4 手术方法
65例患者术前诊断明确,均于全麻下行手术治疗,术前予以颈动脉压迫试验(Matas试验)锻炼患者16例,术前2周开始,每天3~5次,单侧按压开始5 min逐渐增加至20~30 min,以出现缺血情况为止,以促进脑血管侧支循环的建立。2例双侧病变患者评估后均先行瘤体较大侧手术,手术切口选择胸锁乳突肌前缘,切口长度约5~10 cm,常规分离至颈动脉,探查瘤体与颈内外动脉关系,暴露颈总动脉、颈内动脉、颈外动脉及甲状腺上动脉,分别过阻断带预阻断,若术中出现严重出血可立即予以阻断。
单纯瘤体切除:瘤体较小易于剥离,未损伤周围血管;瘤体切除合并颈外动脉结扎:此类患者瘤体较大,血供大多来自颈外动脉,术中分离困难,可保留颈内动脉且出血量大需快速下瘤时选择结扎颈外动脉同瘤体一同切除;瘤体、颈内动脉、颈外动脉切除并重建颈内动(选择自体大隐静脉):均为Shamblin III型CBT,其瘤体同颈内动脉粘连紧密,无法分离或分离过程中动脉破裂。结扎颈外动脉及重建颈内动脉者,术中均肝素化,术后均予以阿司匹林(100 mg)、氯吡格雷(75 mg)双联抗血小板治疗3个月后改为单一药物抗血小板治疗维持。
1.5 随访
术后1、3个月返院复查,术后半年、1年分别电话随访方式,随访内容包括:血压及心率情况,有无声音嘶哑、饮水呛咳等不适,有无复发,有无头晕、头痛,有无肢体活动障碍等。
2 结果
2.1 患者手术情况
本组患者行单纯瘤体切除51例,行瘤体切除合并颈外动脉结扎患者8例,行瘤体、颈内动脉、颈外动脉切除并重建颈内动脉6 例。术中失血量为10~1 800 mL,平均247 mL。4例患者应用转流管,其余患者未用。本组病例手术成功率100%,围术期1例出现术后脑梗塞死亡。14例患者出现迷走神经损伤症状,表现为声音嘶哑、饮水呛咳;5例患者出现舌下神经损伤症状,表现为伸舌偏斜、吞咽困难(表2)。病理检查结果,65例均为颈动脉副神经节瘤。部分患者相关图片资料见图2-4。
2.2 患者术后随访情况
均门诊随访,术后1个月返院复查完善颈动脉CTA后,2例患者颈内动脉闭塞(均为自体大隐静脉重建颈内动脉后),其中1例无明显临床症状,复查CTA见同侧椎动脉代偿良好,暂予以保守治疗。另1例颈内动脉闭塞患者表现为头晕并存在声音嘶哑和吞咽困难,其余随访患者血管通畅。后期平均随访18个月,失访3例,2例双侧病变者均建议择期行对侧手术,其余随访患者无复发。随访患者神经损伤症状者术后建议加用甲钴胺等营养神经治疗,随访后均不同程度恢复,6例症状同术后出院,无明显恢复。上述3例患者随访CTA资料见图5。
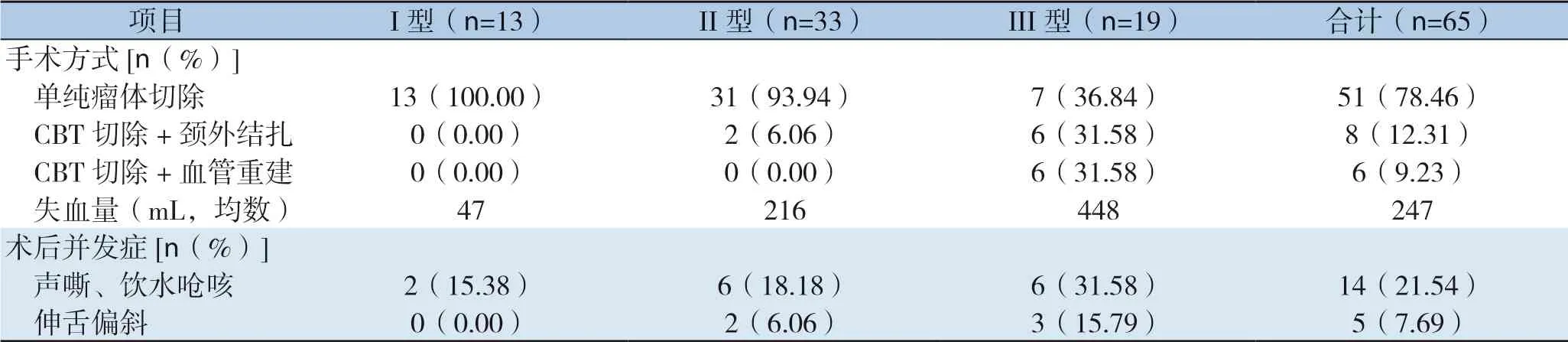
表2 65 例患者手术情况及术后并发症情况Table 2 Surgical characteristics and postoperative complications of 65 patients
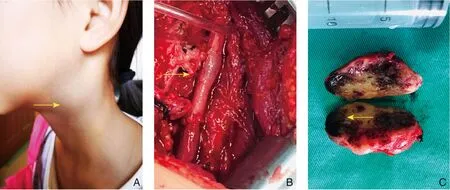
图2 患者1(遗传性家族史的年轻患者,术中可见颈内动脉收侵蚀,由于患者年轻,评估后选择自体大隐静脉行颈内动脉重建) A:体表可见包块;B:术中重建颈内动脉;C:瘤体剖面Figure 2 Patients 1(a young patient with a family history,carotid artery invasion found during operation,and autologous great saphenous vein for internal carotid artery reconstruction recommended due to young age) A:A lump on the skin surface;B:Reconstruction of the internal carotid artery during operation;C:Cut section of the tumor

图3 患者2(瘤体侵蚀颈内动脉予以切除) A:瘤体切除;B:自体大隐静脉移植;C:瘤体标本见切迹Figure 3 Patient 2(resection of the internal carotid artery for tumor invasion)A:Tumor resection;B:Autologous great saphenous vein transplantation;C:Incisura presented in the tumor specimen
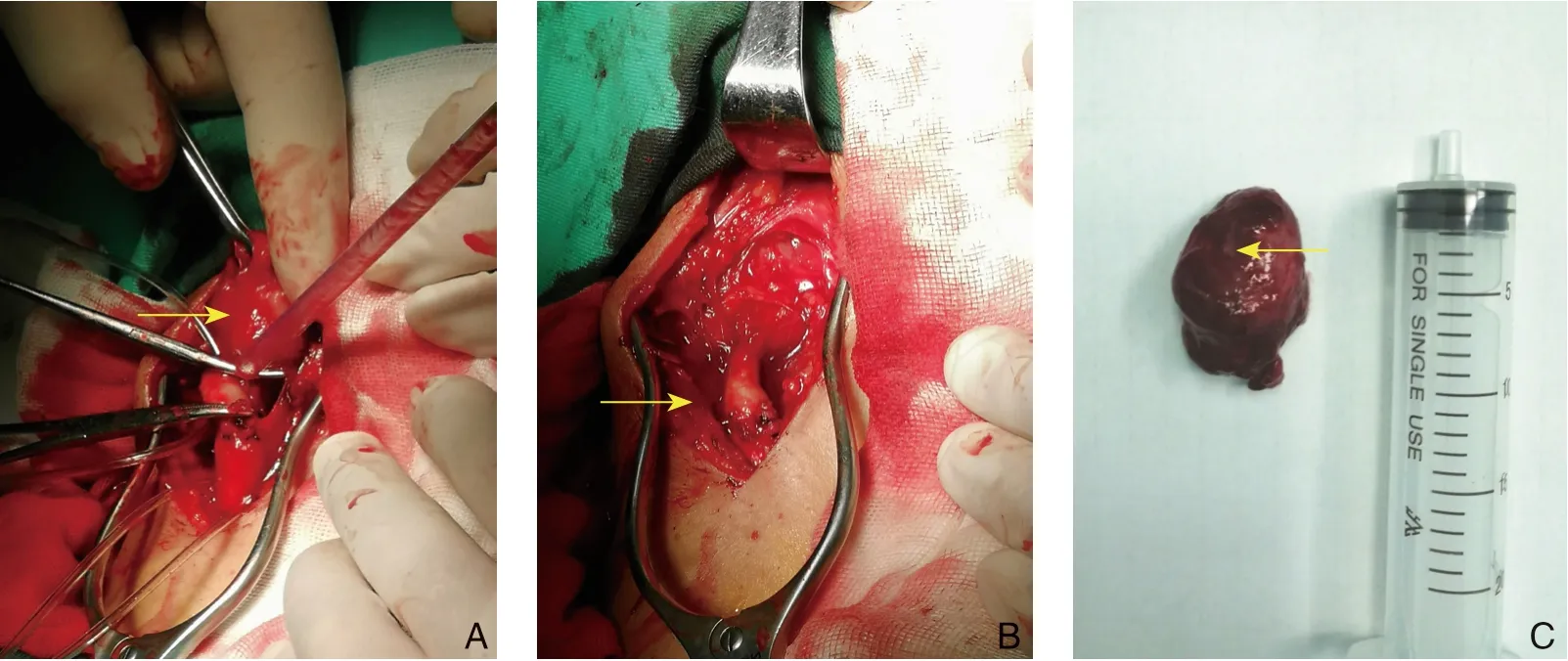
图4 患者3(瘤体较大,术中结扎颈外动脉后完整切除瘤体) A:瘤体切除中;B:瘤体切除后;C:瘤体标本Figure 4 Patient 3(a relatively large tumor,and complete resection of the tumor after external carotid artery ligation during operation)A:Resecting the tumor;B:View after tumor resection;C:Tumor specimen
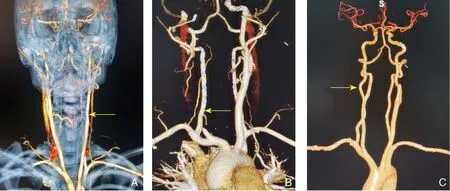
图5 随访CTA 资料 A:患者1 术后1 个月颈内动脉通畅;B:患者2 术后1 个月见颈内闭塞(患者未诉不适,CTA 见椎动脉代偿可暂予保守治疗);C:患者3 术后1 个月随访颈内动脉通畅Figure 5 CTA data during follow-up A:Patent internal carotid artery in patient 1 on postoperative one month;B:Occlusion of the internal carotid artery in patient 2 on postoperative one month(undergoing conservative treatment for no discomfort complaint and CTA showing vertebral artery compensation);C:Patent internal carotid artery in patient 3 on postoperative one month
3 讨论
CBT起病隐匿,通常表现为无痛性肿块,女性多见[22,28]。其发病机制尚不明确,可能考虑同慢性低氧刺激及女性激素变化有关,增生型CBT的患者多长期暴露于低氧刺激中,在观察中发现CBT的发生主要见于罹患慢性阻塞性肺疾病、先天性紫绀型心脏病的患者及在海拔>5 000英尺(约1 525 m)氧浓度低的地区的居民[13]。
本组患者中有2例患者双侧发病,考虑CBT为交界性副神经节瘤,存在恶变可能,瘤体越大其恶变可能性越高[29-30],故本组2例患者均优先处理较大一侧。本组患者中死亡1例,为颈内动脉自体血管重建术后患者,死亡原因考虑术后移植血管再发血栓而导致的急性脑梗塞有关。其余患者存在不同程度的神经损伤,表现为声音嘶哑、饮水呛咳、伸舌偏斜、吞咽困难等,随访后期部分患者并发症得到改善,参考相关文献考虑多是由术中过度牵拉引起的暂时性神经麻痹,涉及迷走神经、舌下神经和下颌神经[31-32]。
近年来关于CBT患者术前栓塞方式的利弊仍存在争议,有关术前栓塞有研究认为其可以减少术中的出血情况并不增加并发症,但此类研究尚少[33-34]。但也有文章提出完全相反的观点,认为术前栓塞可能导致患者术中出血量增加,栓塞手术患者其平均住院日延长,平均住院费用增高[35]。一项Meta分析[19]显示,在手术相关参数和手术切除后并发症方面,接受术前栓塞治疗的CBT患者和未接受手术栓塞治疗的CBT患者没有显著差异。这表明术前栓塞方式对患者无益[27,31]。于大瘤体患者,Sen等[36]完成的一项研究中,79%的患者为Shamblin III型患者,其文章指出术前栓塞确实可以减少术中出血,但却并没有降低神经系统相关并发症的发生率。与此同时,近期也有学者[37]认为无需进行术前栓塞同样可以安全切除病变,同栓塞组患者相比不增加并发症的发生率。
CBT血供丰富,毗邻颈部重要神经血管,手术难度随瘤体增大而增大,故建议发现尽早行手术治疗。术中剥离瘤体为整个手术的关键,能否完整剥离涉及是否损伤周围血管及是否需重建血管,瘤体剥离过程的难易同瘤体质地有不同变化,瘤体质地软,完整剥离的可能性较大;瘤体质地较硬,手术损伤周围颈内、颈外动脉可能性较大,查阅文献目前尚无关于瘤体质地的相关报道,需进一步总结研究。
本研究局限性在于病例样本量较少,所有患者均为手术切除瘤体,是由于本中心术前栓塞组样本量尚少,尚不能完成组间对比统计,此外瘤体的大小通常在患者是否行术前栓塞起很大作用。具有前瞻性设计的随机对照试验可能更有帮助阐明这个主题。
综上所诉,C B T 因肿块累及重要血管和神经,建议发现后早期行手术治疗,手术并发症的严重程度与手术方式以及肿瘤大小有关,无术前栓塞情况下切除肿瘤安全有效。

