小鼠中脑下丘神经元对单、双耳听觉信息突触反应的多样性研究
林涛 何娜 刘秀萍 鄢俊
中枢听处理障碍性疾病(central auditory processing disorders, CAPD)临床常见,儿童、成人和老年人均可发病,是由各种原因导致中枢听处理能力下降的一类疾病[1, 2]。其病因多样,主要包括中枢听神经系统的器质性病变,如听神经纤维瘤、神经胶质瘤、脑血管意外等;老年性退行性改变,如阿尔兹海默病、孤独症等[3, 4];其潜在的病因学基础和神经解剖生理学基础有待深入研究。
中枢听神经系统是由位听神经、耳蜗核、上橄榄核、外侧丘系、中脑下丘、内侧膝状体及听皮层听觉中枢等组成的一个高度复杂的神经网络,它能处理从双耳获得的神经信息,并做出正确的解释和相应的反应[5]。中脑下丘(inferior colliculus, IC)是双耳听觉信息向中枢传递的重要中继核团,可接收来自中脑以下几乎所有听觉结构的投射[6]。但下丘对传入的信息并不是简单的进行中转,而是对来自两侧耳的输入信息进行提取、加工和整合,经优化整合后再沿上行听觉通路投射到听丘脑[7]。因此,本研究拟探讨下丘对双耳听觉信息的整合反应,探索其潜在的神经生理学基础与神经回路,期望为CAPD病因学研究提供神经解剖及神经生理学线索。
1 材料与方法
1.1实验动物 本实验全程在加拿大卡尔加里大学生理与药理学实验室进行,采用3~6周龄的52只正常C57小鼠,体重约15~21 g,由加拿大蒙特利尔Charles River实验室提供。本实验已通过加拿大卡尔加里大学动物伦理委员会批准。
1.2手术暴露小鼠下丘 采用氯胺酮(ketamine,85 mg/kg)和甲苯噻嗪(xylazine,15 mg/kg)混合液对小鼠进行腹腔注射麻醉,并每隔40~60 min追加麻药以维持麻醉状态。剪去小鼠头顶部的毛皮,除去结缔组织,暴露顶骨,将小鼠固定在电声屏蔽室内的立体定位仪上,使小鼠头部的前囟(bregma)和后囟(lambda)水平对齐。参照小鼠颅脑解剖图谱,利用立体定位仪定位左侧中脑下丘(lambda后0.5~2 mm,中线左0.5~2 mm),打开颅骨,暴露下丘,除去硬脑膜,并用生理盐水清洗和覆盖以防止脑表面干燥。电动恒温电热毯维持小鼠体温恒定在37 ℃。术后1~2 h后开始电生理记录。
1.3声刺激及记录方法 实验采用封闭声场刺激。声刺激系统由声信号数字化软件(TDT)、RZ6多模I/O处理器、数字衰减器(PA5)、多场磁扬声器(MF1)等组成,将数字生成的纯音(持续时间为5 ms,上升-下降时间为0.2 ms)转换为模拟信号进行传输。实验前对进入小鼠耳的声音进行校正并保存,声刺激强度以dB SPL表示(参照于20 μP)。在安静条件下用纯音测定神经元的频率-幅度反应域(frequency-amplitude response area, FARA),测试声音频率范围为5~35 kHz(步阶1 kHz),幅度范围为0~70 dB SPL(步阶为5 dB),随机重复3次,相邻两次声刺激之间的时间间隔为800 ms。据此得到神经元的特征频率(characteristic frequency, CF)和最低阈值(minimum threshold, MT)。记录部位在左侧下丘神经元,同侧刺激即为左侧耳传入的声刺激,而对侧刺激即为右侧耳传入的声刺激。
1.4in-vivo全细胞膜片钳技术 记录电极为玻璃微电极,由Sutter P-97拉制仪拉制而成,尖端直径约1~1.5 μm, 阻抗为7~10 MΩ, 电极内液成分及其浓度(mmol/L)为:125 K-gluconate,20 KCl,10 Na2phosphocreatine,4 MgATP,0.3 Na2GTP,0.5 EGTA,10 HEPES,调至pH 为7.25及渗透压为290 mosM。另外,电极内液中加入0.5%的生物素(biocytin)用于定位和标识记录的IC神经元。
参照本课题组前期研究报道的方法[8],首先将玻璃电极(内设压力为200~300 mbar)放置在左侧下丘脑表面,在微电极操纵仪下快速插入脑表面下350 μm到达下丘中央核附近,静候3~5分钟,然后在电压钳模式下缓慢利用测试方波(10 mV,10 ms)电脉冲以盲法寻找细胞。当电极尖端电阻急剧增加20%,持续时间超过10秒时,释放玻璃电极内残留正压或稍加以负压,使电极尖端与细胞形成高阻封接,然后用轻微负压(-30 mbar左右)破膜,形成全细胞记录。串联电阻在20~60 MΩ,补偿60%~80%。在电流钳模式开始电生理记录,将钳制电流设置为0 pA模式。电流信号经MultiClamp 700B膜片钳放大器、DigiData1550数-模转化器、Clampex 10.1以及BrainWare数据软件(TDT)采集、贮存及分析。
收集同一个神经元在单耳最适声刺激(频率CF,声强MT)、以及双耳同时刺激条件下的突触反应变化,包括突触后电位变化及动作电位变化等。双耳神经元是指对双耳声刺激敏感的神经元。参考前期研究的分类方法[8],在电流钳模式下,记录到的正极波形表示去极化,即兴奋性突触后电位(excitatory postsynaptic potential, EPSP);负极波形表示超极化,即抑制性突触后电位(inhibitory postsynaptic potential, IPSP)。根据神经元对单耳刺激的反应是兴奋(excitation, E)、无反应(no response, O)还是抑制(inhibition, I),可将神经元分为EE (excitation-excitation)、EO(excitation-no response)、EI(excitation-inhibition)、II(inhibition-inhibition)、IO(inhibition-no response)、IE(inhibition-excitation)等类型。因听觉系统中下丘神经元普遍对单耳对侧声刺激呈优势反应[9, 10],故命名中通常将记录部位对侧单耳刺激的听反应写在前,同侧单耳刺激的听反应写在后。
当对侧与同侧声刺激同时传入时,EE神经元对双耳信息的提取可进行不同的加工,出现三种不同的整合效应:抑制(inhibition, I)、易化(facilitation, F)和无整合(no integration, N),主要表现为突触后电位波幅的增高或降低、动作电位(及放电)个数的增多或减少。通常将双耳(侧)同时声刺激产生的突触后电位(PSP)与优势侧(对侧)单耳声刺激产生的PSP进行比较,波幅或放电数降低20%或以上为抑制;升高20%或以上为易化;波幅或放电数变化值介于-20%~20%之间为无整合。
1.5组织染色 小鼠经过度麻醉处死后取出大脑,浸泡在10%的福尔马林中,4 ℃冰箱过夜。利用振荡脑切片机(Leica VT 1200S,德国)进行冠状切片,层厚30 μm,在暗室中用0.1 M PBS漂洗3~4次,每次5 min左右。用1% Triton X-100边震荡边浸泡脑片30~60 min进行破膜,加入抗体(1∶200稀释比例)混匀浸泡,4 ℃培养12 h。用PBS漂洗3~4次,每次15 min。将脑片铺平,盖上盖玻片,在C1si光谱共聚焦显微镜下(488激光,尼康,日本)观察膜片钳记录位点和神经元形态。
1.6统计学方法 应用Sigmaplot 8.0和SPSS 16.1软件进行实验数据处理。数据以均数±标准差表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
本实验在52只小鼠的中脑下丘,采用全细胞膜片钳技术成功记录到146个神经元。记录的平均深度,即与脑表面的平均距离为531.3±96.9 μm,处于下丘中央核(central nucleus of the inferior colliculus, CIC)范围(图1a)。经组织染色后,在共聚焦显微镜下确认膜片钳记录部位为CIC(图1a),且成功全细胞记录并标识下丘神经元(图1b)。这146个成功记录的下丘神经元的静息膜电位为-59.9±7.8 mV。
2.1下丘神经元对单耳听觉刺激的基本特征 分析神经元对听觉刺激的频率-幅度反应域(FARA),发现这146个下丘神经元对单耳对侧、同侧声刺激的特征频率基本相似,CF-对侧平均值为14.9±4.8 kHz,CF-同侧平均值为14.7±5.0 kHz,两者之间差异无统计学意义(P> 0.05),且CF-对侧与CF-同侧成直线相关,相关系数为1.025 8(图1c)。CIC神经元对单耳对侧、同侧声音刺激的最低阈值差异显著(P<0.001),MT-对侧为19.3±19.3 dB,显著低于MT-同侧(45.1±18.6 dB),提示CIC神经元对单耳对侧声刺激呈优势反应。MT-对侧与MT-同侧之间无相关性(图1d)。
2.2下丘双耳神经元的分类 本实验中共记录到7种不同类型的双耳神经元,分别为EE、EO、EI、II、IO、IE和CM(complex-mode, CM),分别占66.4%(97/146)、15.8%(23/146)、4.1%(6/146)、6.8%(10/146)、1.4%(2/146)、1.4%(2/146)和4.1%(6/146),见图1e。
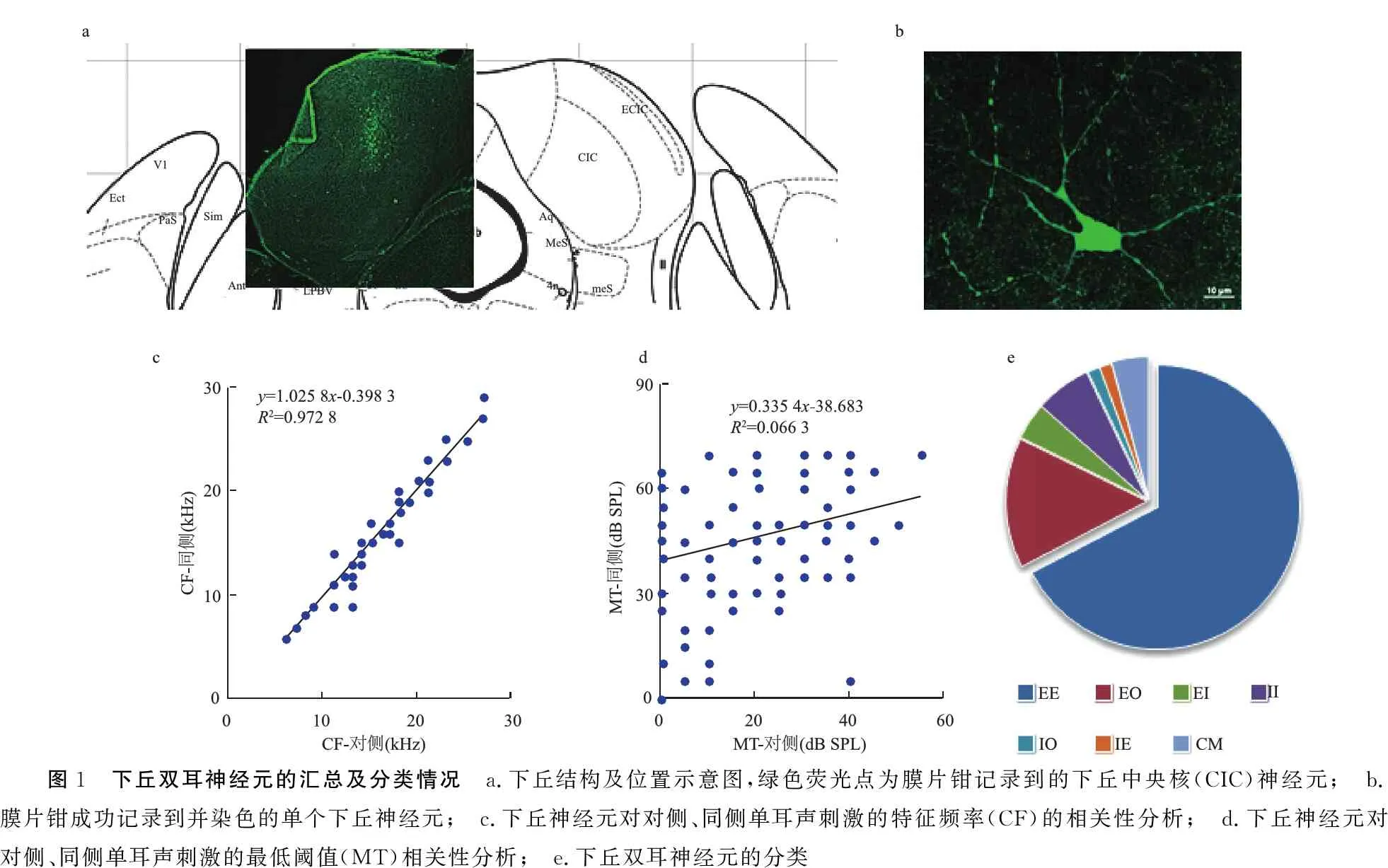
图1 下丘双耳神经元的汇总及分类情况 a.下丘结构及位置示意图,绿色荧光点为膜片钳记录到的下丘中央核(CIC)神经元; b.膜片钳成功记录到并染色的单个下丘神经元; c.下丘神经元对对侧、同侧单耳声刺激的特征频率(CF)的相关性分析; d.下丘神经元对对侧、同侧单耳声刺激的最低阈值(MT)相关性分析; e.下丘双耳神经元的分类
2.2.1EE神经元及其双耳信息整合反应 EE神经元即记录神经元对双侧单耳刺激均为兴奋性反应(图2),是下丘双耳神经元中最重要的类型,占66.4%(97/146)。
根据神经元的单耳输入特性及双耳整合特性,又可将EE双耳神经元进一步细分为EE/I(excitation-excitation/inhibition)(图2a)、EE/F(excitation-excitation/facilitation)(图2b)和EE/N(excitation-excitation/no integration)(图2c)双耳神经元。在这97个EE神经元中,EE/I、EE/F和EE/N各占38.1%(37/97)、20.6%(20/97)和41.2%(40/97)。
2.2.2EO和EI神经元及其双耳信息整合反应 EO神经元为记录神经元对对侧单耳刺激为兴奋性反应(EPSP),而对同侧单耳声刺激无听反应(图3)。EI神经元对对侧单耳刺激为兴奋性反应(EPSP),而对同侧单耳声刺激为抑制性反应(IPSP)(图4)。
在23个EO神经元中,根据双耳整合,又可分为EO/I(excitation-no response/inhibition)(图3a)和EO/N(excitation-no response/no integration)(图3b),其分布比例接近,分别为12(52.2%)和11个(47.8%)。
6个EI神经元均表现为EI/I(excitation-inhibition/inhibition)的双耳整合效应,即完全抑制(图4a,占83.3%,5/6)和部分抑制(图4b,占16.7%,1/6)。
2.2.3II、IO和IE神经元及其双耳信息整合反应 II、IO和IE神经元为记录神经元对对侧单耳刺激为抑制性反应(IPSP),而对同侧单耳声刺激为抑制性反应(II,图5a、b)、无听反应(IO,图5c)、兴奋性反应(IE,图5d),分别占总数的6.9%(10/146)、1.4%(2/146)、1.4%(2/146)。
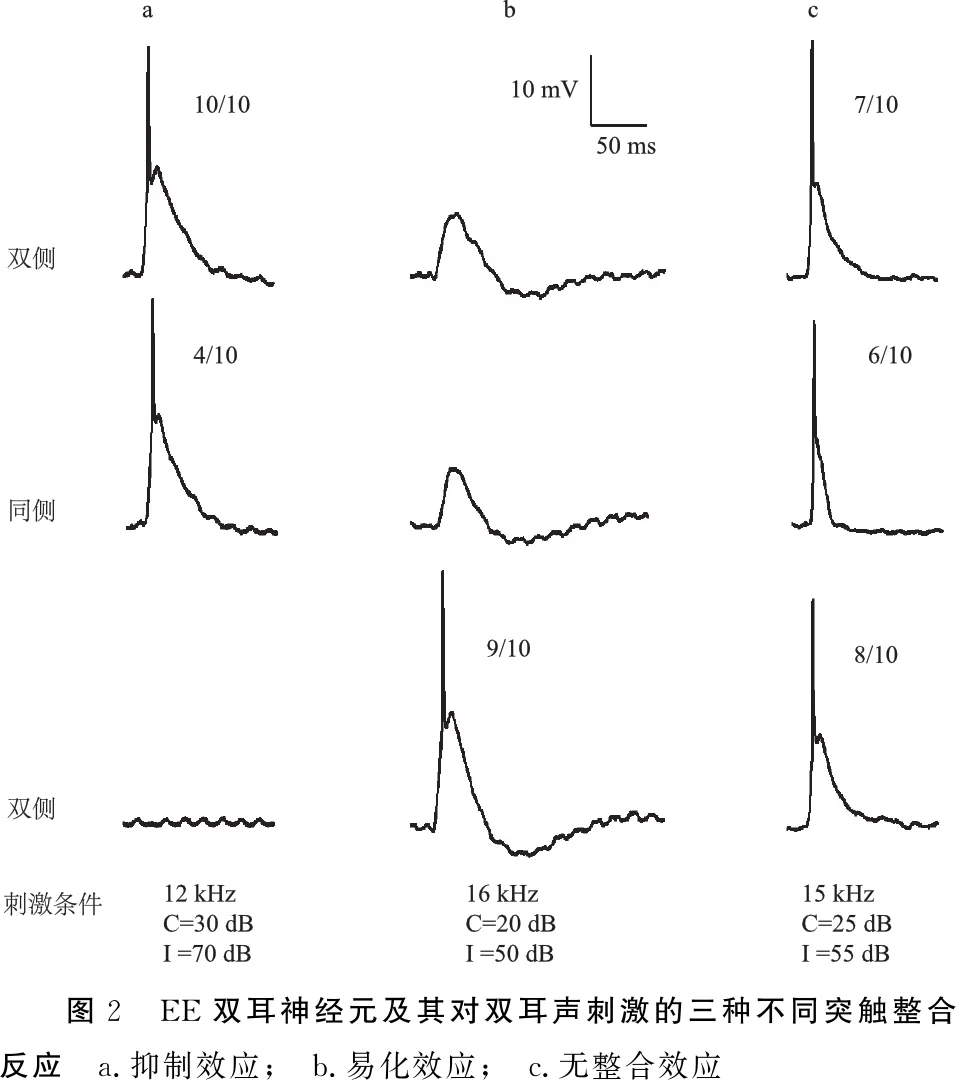
图2 EE双耳神经元及其对双耳声刺激的三种不同突触整合反应 a.抑制效应; b.易化效应; c.无整合效应

图3 EO双耳神经元及其对双耳声刺激的不同突触整合反应 a.抑制效应; b.无整合效应
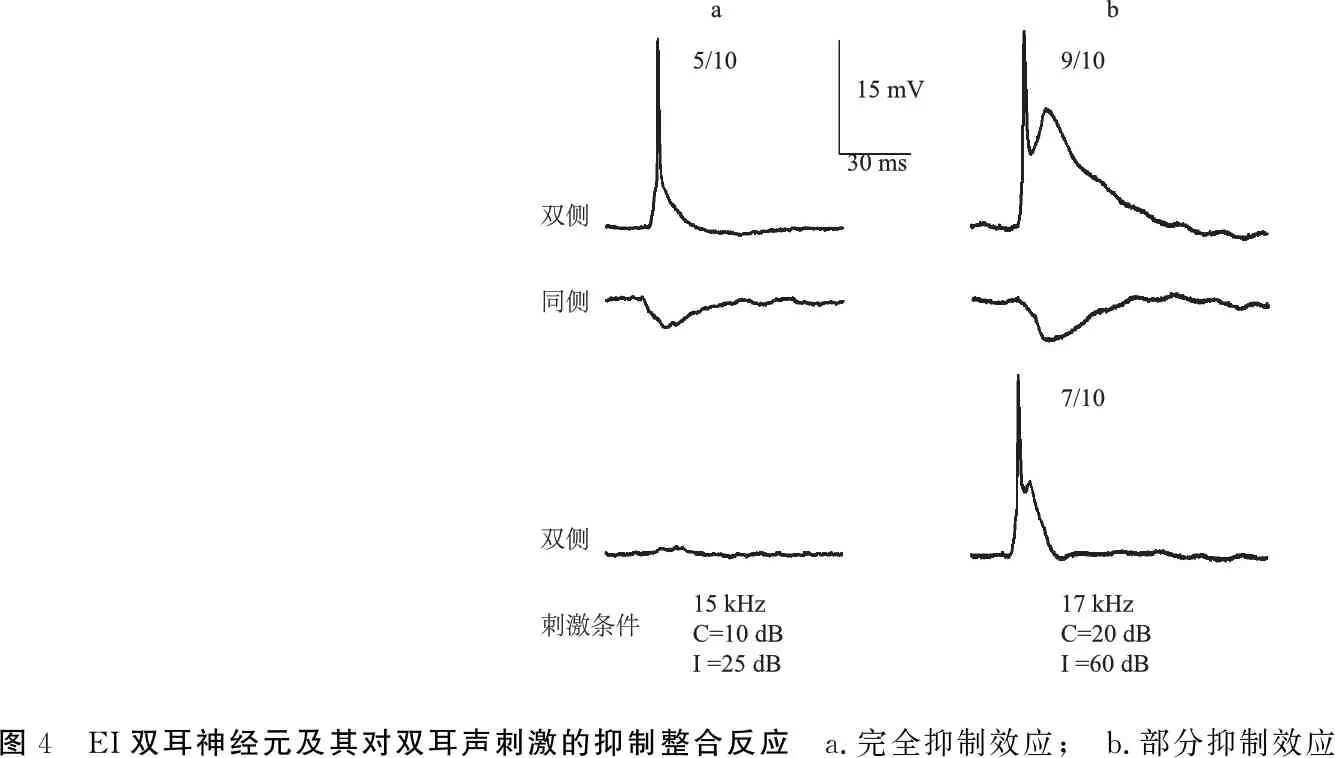
图4 EI双耳神经元及其对双耳声刺激的抑制整合反应 a.完全抑制效应; b.部分抑制效应
这三类神经元对双耳听觉信息几乎均表现出无整合效应,即II/N(inhibition-inhibition/no integration)、IO/N(inhibition-no response/no integration)、IE/N(inhibition-excitation/no integration)(图5b~d),仅有2个II神经元在双耳刺激时呈轻度抑制的整合效应(图5a),即II/I(inhibition-inhibition/inhibition),双侧-IPSP的波幅较单耳对侧-EPSP的波幅分别降低26.7%和23.7%。
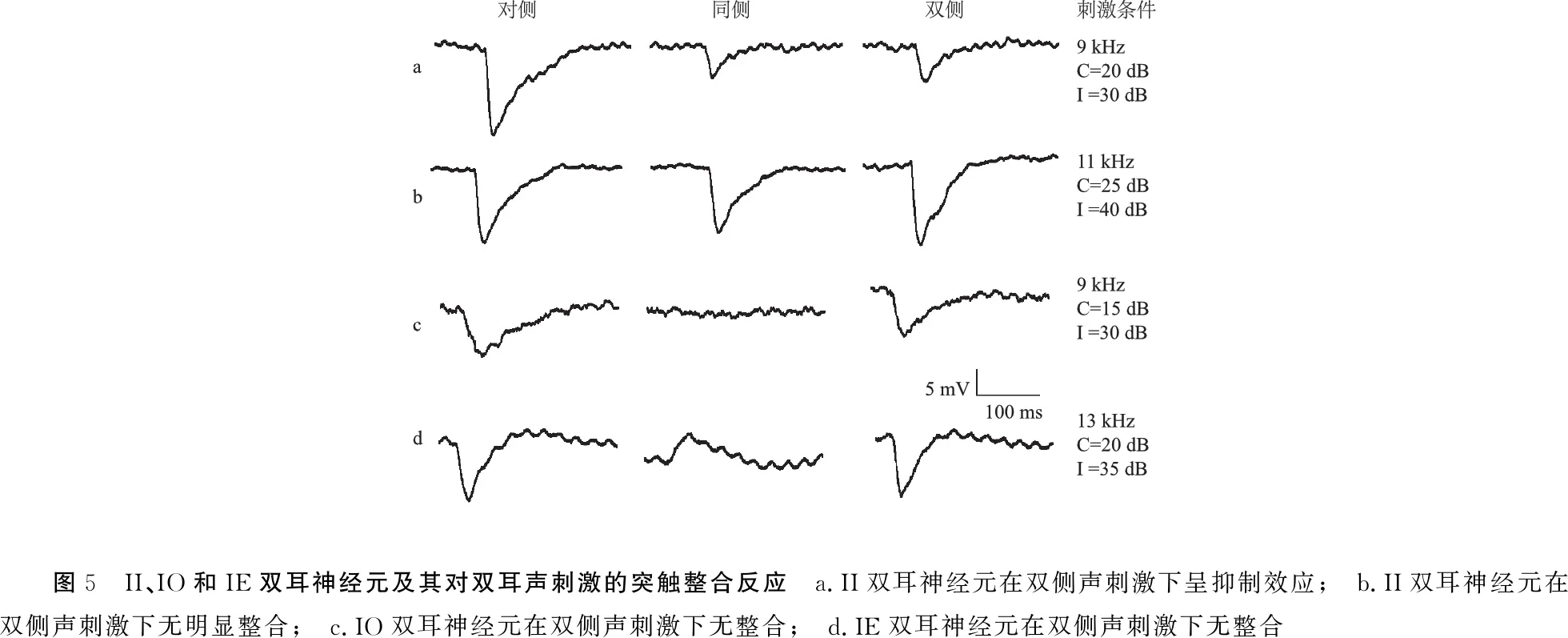
图5 II、IO和IE双耳神经元及其对双耳声刺激的突触整合反应 a.II双耳神经元在双侧声刺激下呈抑制效应; b.II双耳神经元在双侧声刺激下无明显整合; c.IO双耳神经元在双侧声刺激下无整合; d.IE双耳神经元在双侧声刺激下无整合
2.2.4特殊的CM神经元及其双耳信息整合反应 本实验记录到一类非常特殊的CM神经元,这类神经元随着单耳输入的刺激参数不同,可出现不同的听反应,呈现复杂的混合类型。
图6记录的是同一个IC神经元,在高频21 kHz条件下,该神经元对单耳对侧、同侧声刺激均呈抑制性反应(IPSP),类似于II,见图6a;而在低频9 kHz条件下,该神经元对单耳对侧声刺激呈兴奋性反应(EPSP),而对同侧刺激则呈抑制性反应(IPSP),类似于EI,见图6b。因此,这个CM神经元可归为II+EI混合型神经元。
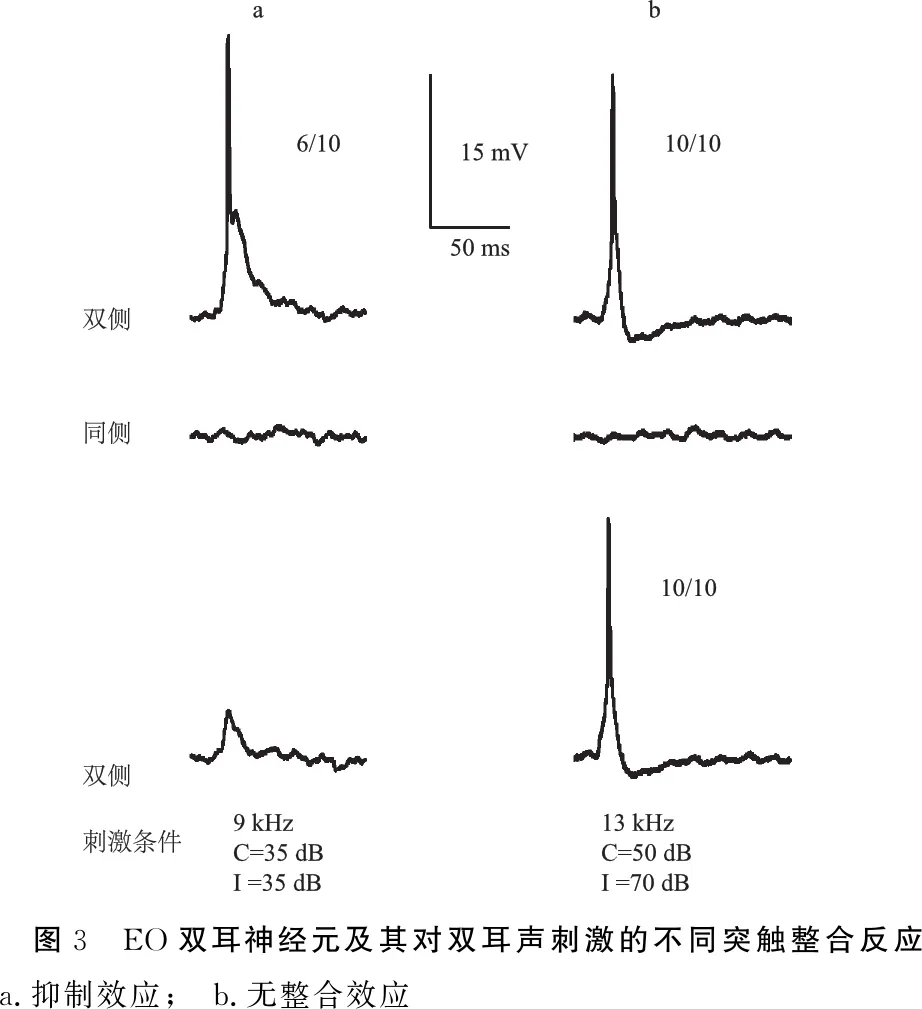
图3 EO双耳神经元及其对双耳声刺激的不同突触整合反应 a.抑制效应; b.无整合效应
这类CM神经元记录到6个,占总数的4.1%。在这6个CM神经元中,1个表现为II+EI,1个为II+IE,2个为II+EE,1个为EE+EI,1个为EE+IE。
目前这类CM神经元对双耳听觉信息的整合反应仅表现为抑制和无整合效应,未观察到有易化效应。表现为II、IE单耳输入特性的神经元,在双耳整合时呈无整合效应(图6a)。表现为EE单耳输入特性的神经元,在双耳整合时75%(3/4)呈抑制效应,25%(1/4)呈无整合。表现为EI单耳输入特性的神经元,在双耳整合时均呈抑制效应(图6b)。
3 讨论
中枢听处理障碍临床常见的症状是在噪声环境中听觉分辨、听力理解障碍,即能听到声音,却不能理解含义及提取感兴趣的声源信号;另一个常见症状是声源定位困难与偏侧障碍[11]。这些均依赖于中枢听处理能力的正常进行,特别是中枢对双耳分听能力、双耳信息的处理能力。位于中脑的下丘是中枢听觉系统中对双耳听觉信息进行提取、加工与整合的重要核团,其在神经解剖位置上处于听觉系统的中心位置,可接受耳蜗核(cochlear nucleus, CN)、外侧和内侧上橄榄核(lateral/medial superior olive, LSO/MSO)、双侧外侧丘系(lateral lemniscus)以及对侧IC的传入,经分析和整合后再投射至内侧膝状体和大脑听皮层[7, 12]。既往多项研究表明[13, 14],下丘不同传入与传出途径的组合,对双耳听觉信息可产生截然不同的整合效应,提示下丘存在复杂且多样的神经环路。
本实验采用全细胞膜片钳技术从单细胞角度研究下丘神经元对双耳听觉信息的处理及整合,探索其潜在的神经解剖基础及神经环路,成功记录到146个IC神经元对单耳对侧、同侧声刺激的突触反应及双侧同时刺激的整合反应。与传统使用双耳整合特性的分类方法不同[15, 16],本实验根据单耳输入特性和双耳整合特性来进行分类[8, 17, 18],且与传统电生理学研究采用细胞外记录不同[16, 19],本实验的全细胞膜片钳技术可记录到抑制性突触后电位(IPSP),突破了传统分类方法的局限性。本实验记录到的146个IC双耳神经元根据单耳输入特性可分成7组不同的输入,即EE、EO、EI、II、IO、IE和CM,每组输入又可产生抑制(I)、无整合(N)和/或易化(F)等不同的双耳整合效应。
EE神经元对来自对侧、同侧的单耳刺激均可产生兴奋性反应EPSP,而对双耳同时输入时可表现出抑制、无整合和易化三种截然不同的整合效应,推测双耳整合可能发生在下丘中央核(CIC)和/或上橄榄核复合体。来自同侧MSO的投射是兴奋性的,来自同侧LSO的投射是抑制性的,而来自对侧LSO的投射既有抑制性亦有兴奋性。对侧、同侧单耳信号共同通过上橄榄核复合体经初步整合后再传输至下丘,而双侧CIC神经元之间通过联络纤维进行相互调制[8, 20],可进一步对传入至下丘的双耳整合信息进行再次整合。
EO神经元对单耳对侧刺激形成EPSP,而对同侧刺激无听反应。这种对同侧单耳刺激无反应可能是EO神经元完全不接收同侧的听觉信息,故在双耳信息整合时,因同侧无听觉信息传入,仅有对侧听觉信息上传,此时双侧-EPSP基本上等同于对侧-EPSP,即无整合效应EO/N。这类EO/N神经元类似于传统研究中的单耳神经元[16, 21]。第二种情况是,同侧单耳信息不上传至下丘,而只是在双耳输入时发挥作用:同侧听觉信息经耳蜗核转斜方体内侧核至上橄榄核复合体,对已传导至上橄榄核复合体的对侧听觉信息进行抑制,故经上橄榄核复合体汇聚整合后双耳输入成抑制效应,即EO/I。
EI神经元表现为单耳对侧EPSP,同侧IPSP,提示这类神经元有两个直接的单耳传入途径:对侧输入经对侧耳蜗核产生兴奋性反应后直接上传至下丘,而同侧输入是经同侧的外侧丘系产生抑制性反应后上传至下丘,二者在下丘直接整合,且二者传入途径均单一,故只产生一种整合结果,即EI/I。
II、IO和IE神经元的共性是单耳对侧IPSP,即对侧的单耳输入经对侧耳蜗核交叉传入至同侧外侧丘系,经外侧丘系上传至下丘。II和IO神经元的单耳同侧输入为IPSP或无听反应,其同侧的单耳输入亦可能是经同侧耳蜗核直接传入同侧外侧丘系后再上传至下丘;因此,推测II和IO神经元对双耳信息的整合发生在外侧丘系。IE神经元和EI神经元类似,有两个直接的单耳传入途径,但途径不同,IE神经元的对侧听觉信息首先经对侧耳蜗核交叉上传至同侧的外侧丘系产生抑制性反应后再上传至下丘,而同侧听觉信息直接由同侧耳蜗核产生的兴奋性反应上传至下丘,双侧信息亦在下丘直接整合。
CM神经元在单耳输入时,根据不同的刺激参数可出现不同的兴奋或抑制性反应,其双耳整合反应亦由此而出现不同的效应,充分说明了下丘神经元对单耳听觉及双耳整合的复杂性和多样性[6],其具体的机制和环路有待进一步研究和探索。
综上所述,本实验利用全细胞膜片钳技术在中脑下丘发现7种不同类型的双耳神经元,各自具有不同的双耳整合效应,提示这7种类型的中脑下丘双耳神经元各自具有不同的双侧突触结构和神经环路;因此,深入了解和研究中脑下丘对听觉信息的处理及整合机制,可为CAPD的病因探寻及精准治疗提供理论依据。

