单核细胞趋化蛋白-1及脂蛋白(a)与梅尼埃病关系的研究△
王娜 李旻 王静 李伟兰 刘汝利 张再兴 周尚清 郭霞
目前,大多数学者认为梅尼埃病的主要病理基础是内耳积水,表现为眩晕、感音神经性聋、耳鸣、耳闷胀感[1]。随着梅尼埃病发病率的升高,其病因引起研究者们的高度重视。有研究发现梅尼埃病的发生可能与一些蛋白和基因相关,单核细胞趋化蛋白-1((monocyte chemotactic protein-1,MCP-1)是一类特异性分泌蛋白,国内曾就其在肝、肾和细菌感染等疾病方面进行探索[2],在耳部疾病方面的研究甚少。最近国外学者通过动物实验发现MCP-1和CC家族趋化因子在耳蜗外侧壁血管纹及螺旋韧带等部位有表达,所以推测这些因素可能诱导内耳部分病变的产生[3]。脂蛋白(a)[LP(a)]主要由肝脏合成,呈球形颗粒状,是具有毒性的新型脂蛋白[4,5]。近来研究表明高脂蛋白血症和动脉硬化是听力下降和毛细胞病变的危险因素[6,7]。LP(a)升高及微循环病变也可能引起迷路组织结构的病变,从而引起或促使听力减退[8]。故本实验借助膜迷路积水大鼠模型研究MCP-1和LP(a)在大鼠耳蜗及血液中的表达变化,分析两者与梅尼埃病的关系。
1 材料与方法
1.1实验动物及分组 SPF级SD大鼠30只(北京华阜康生物科技股份有限公司),雌雄不限,3~6月龄,体重170~200 g,随机分成实验组、对照组、正常组,每组10只。纳入标准:耳廓反射敏锐,鼓膜正常,前庭功能正常。
1.2膜迷路积水动物模型制作 实验组大鼠给予醋酸去氨加压(DDAVP)腹腔注射,起始剂量4 μg·kg-1·d-1,连续注射7 d后调整剂量为6 μg·kg-1·d-1,连续注射3 d[9]。对照组大鼠腹腔注射等量生理盐水。正常组不作任何处理。停药7 d后三组大鼠进行ABR检测。耳蜗取材后,通过中阶横截面积/(中阶+前庭阶横截面积)比值[SM/(SM+SV)]评价膜迷路积水造模情况,如大鼠出现活动减少、步态蹒跚等症状,ABR检测听功能下降、SM/(SM+SV)>1/3提示造模成功。
1.3ABR检测 大鼠深度麻醉后将地极、记录电极和参考电极分别插入相应位置,刺激声为短声(click),在距外耳道孔约1.0 cm处给予声源刺激,每间隔0.1 ms反复给予刺激,刺激频率为100~2 000 Hz,记录持续时间10 ms,叠加1 024次,记录各组大鼠波Ⅱ的阈值以及60 dB nHL声刺激时波Ⅱ、Ⅲ、Ⅴ的潜伏期及Ⅱ-Ⅴ、Ⅲ-Ⅴ波间期变化。
1.4采血及耳蜗取材 大鼠麻醉成功后,仰卧位固定;暴露腹主动脉采血,将备用血置于EP管内-20 ℃保存;固定液固定大鼠:剖开右心房,先后用0.9%NACL溶液及固定液灌流冲洗固定;固定液固定耳蜗:在显微镜下将取出之耳蜗反复灌流固定;浸洗、脱钙;梯度酒精脱水;常规石蜡包埋、切片。
1.5SM/(SM+SV)比值评价膜迷路积水 统计大鼠中阶面积(SM)、中阶加前庭阶面积(SM+SV),将各组SM/SM+SV的平均值进行统计分析。
1.6免疫组织染色检测MCP-1在大鼠耳蜗的表达 ①耳蜗标本脱蜡、水化:切片置于二甲苯中浸泡10 min;无水乙醇、95%乙醇、70%乙醇中各浸泡5 min;3% H2O2滴加在切片上,室温静置10 min;PBS洗2~3次,每次各5 min;②抗原修复:抗原修复溶液(pH 8.0)高压修复3 min。③H2O2孵育15 min,滴加封闭液20 min。滴加一抗50 μl,4 ℃过夜。次日滴加二抗40~50 μl(中杉金桥,HPV-9001),孵育1 h;DAB显色5~10 min,在显微镜下掌握染色程度;苏木精复染2 min,盐酸酒精分化;自来水冲洗10 min;脱水、透明、封片,运用显微成像系统采集各组图像观察分析。MCP-1主要表达在细胞质及细胞间质,呈棕黄色或棕褐色颗粒。
1.7酶联免疫吸附实验(ELISA)检测LP(a)水平 把待测血清从-20 ℃移至-4 ℃中消融,准备LP(a)的试剂盒,同时设置标准孔备用,稀释标准品,待测样品加样,温育箱内孵育,配置浓缩洗涤液,洗涤液洗涤,加酶标试剂 ,显色剂显色,终止液终止,酶标仪检测OD值。
1.8统计学方法 实验结果通过SPSS25.0统计软件进行单因素方差分析、Pearson相关分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1ABR检测结果 由表1可见,实验组大鼠ABR波Ⅱ阈值升高、波Ⅱ、Ⅴ潜伏期及Ⅲ-Ⅴ波间期较正常组和对照组均延长,差异有统计学意义(P<0.05)。

表1 各组大鼠ABR检测结果
2.2各组大鼠SM/(SM+SV)比值结果 由表2可见,实验组SM/(SM+SV)比值大于1/3,且显著大于正常组和对照组,提示膜迷路积水造模成功。

表2 各组大鼠SM与SM+SV及SM/(SM+SV)结果
2.3MCP-1在各组大鼠耳蜗组织的表达 由图1可见,MCP-1在正常组及对照组耳蜗螺旋器、血管纹螺旋韧带及神经节细胞组织中均无表达,而在实验组的上述组织细胞质及细胞间质中表达明显,前庭膜上也有表达。
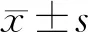
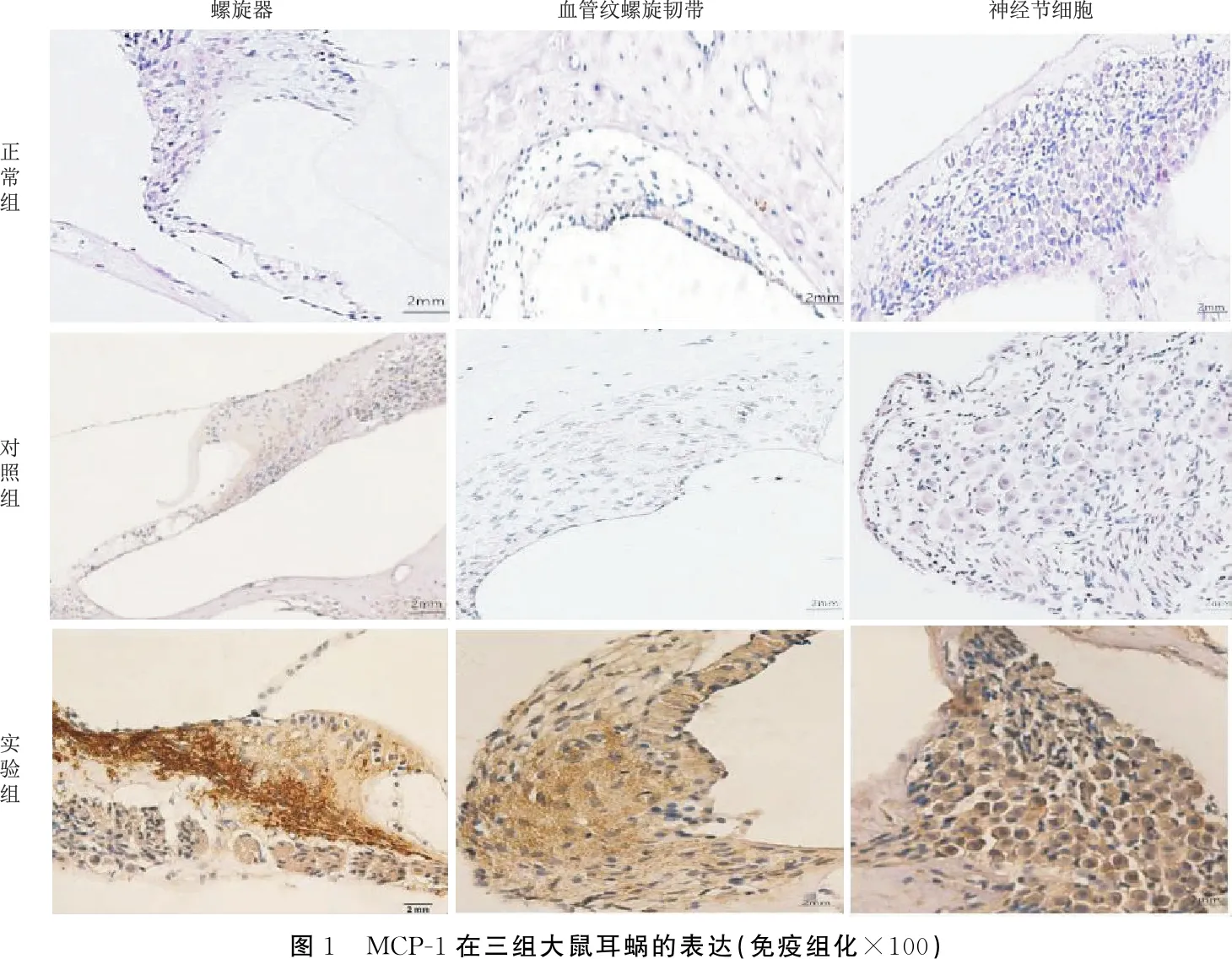
图1 MCP-1在三组大鼠耳蜗的表达(免疫组化×100)
2.5LP(a)水平与SM/(SM+SV)面积比值、ABR各指标的相关性分析 由表3可见,LP(a)水平与SM/(SM+SV)面积比值及ABR波Ⅱ阈值、波Ⅱ、Ⅴ潜伏期及Ⅲ-Ⅴ波间期之间均存在明显的正相关(P<0.05)。
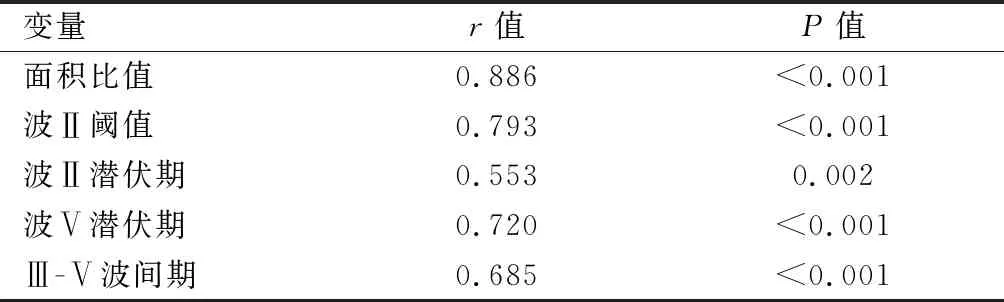
表3 LP(a)水平与SM/(SM+SV)面积比值、ABR波Ⅱ阈值、波Ⅱ、Ⅴ潜伏期及Ⅲ-Ⅴ波间期的相关性分析
3 讨论
梅尼埃病病因不明确,目前研究可能与内淋巴吸收障碍、内淋巴生成过多、内分泌紊乱、免疫反应、自主神经功能紊乱、炎症等因素有关[10]。趋化因子可以操纵细胞按特定方向移动,其受体主要表达于单核细胞、巨噬细胞、中性粒细胞等炎症细胞表面[11]。MCP-1的渗出功能与感染有关,它在激活单核细胞、巨噬细胞、平滑肌细胞、纤维等细胞时渗出,单核炎症细胞体表有融合力很高的MCP-1受体,耳蜗组织中的单核细胞被激发后可以分泌MCP-1,诱发感染,导致听力减退。研究者发现MCP-1诱导感染因子IL-1、IL-6等在迷路病变中发挥作用,而梅尼埃病的发生与IL-1有一定关联[12]。MCP-1在迷路病变中的表达是通过IL-10/Hmox1途径来调控的,学者研究发现人迷路的免疫系统有乳铁蛋白、Toll样受体(TLR)等基因调控[13],而Moon等[14]发现MCP-1在迷路病变中的作用是螺旋韧带细胞通过TLR2介导的NF-κB激活上调引起的。梅尼埃病的发生比较复杂,可能与多种因素有关,通过上述研究发现MCP-1介导迷路病变,推测MCP-1可能与梅尼埃病的发生有一定的关联性。
关于LP(a)在梅尼埃病的发生发展中的作用机制,学者推测有以下两种可能[15]:①LP(a)是同时含有糖-载脂蛋白(a)的特殊物质,血液中的纤溶酶原(PGN)与其存在相似特性,通过减少纤维蛋白原的产生,促进内耳血管内皮下脂质堆积硬化,随着病情进一步进展促使血管痉挛使得血管内血栓形成,导致内耳神经缺血变性,引起相应临床表现。②通过注射DDAVP建立膜迷路积水动物模型,DDAVP对LP(a)有一定的影响:其一,DDAVP加速血友病因子Ⅷ的激活,同时促使释放组织PGN激活物;其二,DDAVP与迷路血管内皮上的受体结合,使内皮细胞间的距离增大,LP(a)等物质通过缝隙渗入内皮内膜下,参与动脉粥样硬化的形成[16,17]。以上两种因素使得LP(a)水平升高,借助介导迷路血管内脂代谢和纤溶机制,使内耳血管痉挛或血栓形成,导致迷路血流量减少,引起感音神经性聋、耳胀满感及前庭功能异常。内耳对缺血改变很敏感,内耳血管血流减少后会导致螺旋器、壶腹嵴、囊斑的功能障碍,进而出现梅尼埃病一系列临床表现[18]。
本实验通过腹腔注射DDAVP建立膜迷路积水动物模型,实验组中阶面积(SM)与中阶加前庭阶面积(SM+SV)的比值大于1/3,而正常组和对照组SM与SM+SV基本等于1/3,提示实验组动物造模成功;ABR检测显示波Ⅱ阈值升高,波Ⅱ、Ⅴ潜伏期及Ⅲ-Ⅴ波间期延长,提示膜迷路积水可以引起大鼠听功能下降;MCP-1在实验组耳蜗螺旋器、血管纹螺旋韧带及神经节细胞组织中表达明显,前庭膜上也有表达,说明MCP-1可能与梅尼埃病之间存在关联,其作用机理可能是MCP-1趋化吸引靶细胞从而诱发膜迷路积水,进而导致梅尼埃病的发生。目前LP(a)水平在膜迷路积水动物模型中有无变化尚无相关研究,本实验通过酶联免疫吸附试验检测三组大鼠的LP(a)水平变化,发现实验组大鼠LP(a)水平升高。将三组LP(a)水平与膜迷路积水程度及ABR各指标进行相关性分析,结果显示LP(a)水平与膜迷路积水程度及ABR各指标均呈明显正相关,提示LP(a)水平升高,与膜迷路积水的形成及听力下降可能存在一定关系,其可能参与梅尼埃病的发生。
但具体MCP-1及LP(a)如何在梅尼埃病中调控引起病变有待进一步探讨。后续通过实验继续研究MCP-1及LP(a)在梅尼埃病发生中的作用机理,为梅尼埃病的诊断及治疗奠定实验基础,开辟新思路。

