镁营养对苦瓜生长发育及生理代谢的影响
尤垂淮 孙青慧 陈晟 柯彦 林新萍 施木田



摘 要:采用砂培的方式,以‘翠玉’苦瓜(Momordica charantia)品種为试验材料,研究不同镁素浓度(0、20、40、80、160 mg/L)处理下对苦瓜生长特性(叶片和根系形态、光合色素含量、碳氮代谢、生物量积累)和生理响应(渗透调节、膜伤害和抗氧化)的影响。结果表明:镁浓度为20~80 mg/L时可以降低苦瓜叶片膜伤害,增加叶片中可溶性糖、可溶性蛋白质、光合色素和谷胱甘肽(GSH)含量,增强叶片抗氧化酶活性,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和单脱氢抗坏血酸还原酶(DHAR),降低叶片丙二醛(MDA)、脯氨酸(Pro)、过氧化氢(H2O2)含量和超氧阴离子(O2−)的产生速率及细胞膜透性,促进根系活力、光合作用和生物量积累。其中,40 mg/L镁处理对苦瓜的生长发育增效最明显,而缺镁(0 mg/L)和过量镁(160 mg/L)胁迫下,苦瓜叶片产生膜脂过氧化伤害、主根变短、侧根减少,苦瓜地上部和地下部生长均受到明显抑制,缺镁比镁过量的抑制作用更强。综上所述,缺镁和过量镁抑制苦瓜生长,而适量增施镁可有效提高苦瓜的生理活性,增强苦瓜抗逆性,促进苦瓜生长,40 mg/L为苦瓜栽培最适宜施镁浓度。
关键词:苦瓜;镁;生长发育;生理生化特性;响应机制
中图分类号:S642.5 文献标识码:A
Abstract: A variety ‘Cuiyu’ of Momordica charantia was planted by sand culture and treated with five magnesium concentrations (0, 20, 40, 80, 160 mg/L). The effects of magnesium nutrition on the growth characteristics (leaf and root morphology, photosynthetic pigment content, carbon and nitrogen metabolism, and biomass accumulation) and physiological response (osmoregulation, membrane damage and antioxidation) of M. charantia were investigated. Application of 20-80 mg/L magnesium reduced leaf membrane damage, increased the contents of soluble sugar, soluble protein, photosynthetic pigment and glutathione (GSH), and enhanced the activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT) and monodehydroascorbate reductase (DHAR). But the contents of M. charantia leaf malondialdehyde (MDA), proline (Pro) and hydrogen peroxide (H2O2), the production rate of superoxide anion (O2−), and cell membrane permeability were all reduced, while their root vitality, photosynthesis and biomass accumulation were promoted. Among them, 40 mg/L magnesium treatment had the most obvious synergistic effect on the growth and development of M. charantia. However, under the stresses of magnesium deficiency (0 mg/L) and excess (160 mg/L), the membrane lipid peroxidation damage occurred in the M. charantia, and the main roots were shortened, the lateral roots decreased, the growth of the above ground and underground parts was significantly inhibited, and magnesium deficiency had a stronger inhibitory effect on M. charantia than excessive magnesium. To sum up, the results indicated that magnesium deficiency and excess inhibited the growth of M. charantia. The appropriate application of magnesium could effectively improve the physiological activity, enhance the stress resistance and promote the growth of M. charantia. And 40 mg/L magnesium was the most suitable concentration of magnesium for the cultivation of M. charantia.
Keywords: Momordica charantia; magnesium; growth and development; physiological and biochemical characteristics; response mechanism
DOI: 10.3969/j.issn.1000-2561.2021.12.022
作物在生长发育过程中因某种必需元素不足或过量时,其生理功能和生长状态会产生相应症状,引起植株生长发育不良、生物量积累不足、产量降低和品质下降等一系列问题。镁(magnesium, Mg)不仅是植物生长和发育过程中所必需的中量营养元素,还是植物体内叶绿素的重要组成成分[1],在植物光合作用、碳水化合物合成、酶的活化、脂肪代谢和蛋白质合成等方面发挥重要作用[2]。目前,农业土壤中镁素营养缺乏现象相对普遍,第一,土壤中镁含量分布不均,部分土壤缺镁严重,有报道显示我国土壤缺镁面积占全国耕地面积6%[3];第二,农业生产上施用的化肥经常缺少镁元素,如农田在增加N、P、K化肥用量的同时大量削减了有机肥的用量,使得土壤镁素大量减少甚至耗竭;第三,作物生产中大量施用的K肥会抑制植物对Mg2+的吸收;第四,工业产业的发展导致酸雨频繁,镁元素在酸性土壤环境中易溶解流失[4],尤其在我国南方酸性土壤中镁元素流失现象更为严重;第五,农作物对镁素的吸收转移,如根部吸收镁离子后转运到各个细胞和器官供作物需要,最后转移到作物种子中,进一步加剧了土壤缺镁现象。
在植物生长发育过程中,镁元素扮演着重要角色,其含量的缺乏和过量均会影响植物的正常生长及产量和品质[5]。Yin等[6]研究发现,镁元素缺失导致植物代谢过程中关键酶活性降低,细胞色素合成受阻。植物幼苗在缺镁处理下叶片细胞膜受损,光合作用变弱,叶绿素含量降低,叶片游离脯氨酸(proline, Pro)含量增加[7]。我国冬油菜主产区土壤缺镁问题严重,镁缺乏已成为限制油菜(Brassica napus)产量的潜在因子[8]。李婷等[9]研究指出,缺镁降低了番茄(Solanum lyco-persicum)光合速率和蒸腾速率,严重影响番茄生长。课题组前期研究发现镁元素显著影响小白菜(Brassica chinensis)生物量的积累,小白菜在缺镁处理下叶绿素含量下降并产生大量活性氧,叶片丙二醛(MDA)含量增加,适量施用镁肥(48 mg/L)可以显著提高小白菜的光合作用及超氧化物歧化酶(superoxide dismutase, SOD)和过氧化物酶(peroxidase, POD)活性[10]。黄东风等[11]研究也发现,适量添施镁肥有利于提高白菜产量。纽荷尔脐橙(Citrus junos)在镁过量胁迫下老叶叶绿素含量的下降被显著抑制,而新叶叶绿素含量下降,最终导致植株叶绿素含量降低[12]。
镁元素是限制植物产量和品质提高的一个重要因素,目前有关镁缺失或过量对苦瓜的生长及生理生化响应的研究尚未见报道。因此,本研究利用砂培试验技术,分析5个不同Mg2+浓度对‘翠玉’苦瓜品种的农艺性状、光合色素、碳氮代谢、活性氧产生、细胞膜透性、抗氧化物质及抗氧化酶活性的影响,旨在为解析苦瓜响应镁胁迫的生长特性和生理机制奠定基础,并明确苦瓜对镁素需求的适宜范围,为指导镁高效利用苦瓜品种的选育及其科学种植提供理论和技术支撑。
1 材料与方法
1.1 材料
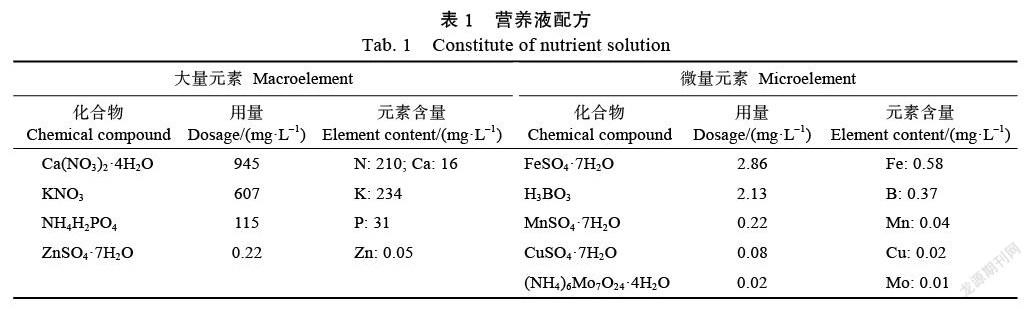
供试苦瓜品种为‘翠玉’苦瓜(简称‘翠玉’)。本试验在福建农林大学甘蔗所大棚开展,采用砂培培养,营养液配方(Hoagland & Arnon配方)如表1所示。选均匀一致且饱满的苦瓜种子,用温汤浸种法进行处理,水冷后连续浸泡10 h,待种子吸水膨胀后,用纱布包好,置30 ℃左右的环境下催芽。待种子大部分露白后,将种子播于预先备好的泡沫箱中育苗,定期浇水以保持一定的湿度[13]。待小苗长至2片真叶时,定植于装有砂子的营养钵中,5 d后处理。
1.2 方法
1.2.1 试验设计 本试验营养液中的镁源为MgSO4·7H2O,镁浓度设为0、20、40、80、160 mg/L等5个处理,0 mg/L处理缺少的SO42–以K2SO4代替。每隔2 d用不同浓度的镁溶液进行浇苗处理,每盆每次浇250 mL,其他均按科学管理措施进行。处理45 d后取样,样品用液氮冷冻后迅速带回实验室,放入超低温冰箱保存。实验设置6个生物学重复。
1.2.2 测定指标 苦瓜农艺性状的测定。株高:用直尺测量植株茎基部到生长点的高度;根长:用直尺测量根基部到根系末端的长度;根系体积:采用排水法测定根系体积;植株干重(包含根、茎、叶总):取长势相似的植株,用蒸馏水冲洗干净,用滤纸吸干植株表面的水分后置于105 ℃烘箱杀青15 min,70 ℃烘干至恒重,用电子天平测量干重。
取植株上部同一位置叶片,测定生理生化指标。测定方法如下:光合色素采用丙酮和无水乙醇混合提取法测定,硝酸还原酶(nitrate reductase, NR)活性采用离体法测定,细胞膜透性采用电导法测定[14];可溶性糖采用蒽酮-硫酸法测定,可溶性蛋白采用考马斯亮兰法测定[15];SOD采用氮蓝四唑(nitro-blue tetrazolium, NBT)光化还原法测定,POD活性采用愈创木酚法测定,过氧化氢酶(catalase, CAT)活性采用紫外吸收法测定,MDA含量采用硫代巴比妥酸(thiobarbituric acid, TBA)比色法测定,游离脯氨酸(proline, Pro)含量用甲苯萃取法测定以及O2?产生速率、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)和脱氢抗坏血酸还原酶(dehydrogenation ascorbic acid reductase, DHAR)活性等的测定参照Nakano等[16]的方法;H2O2含量、谷胱甘肽(glutathione, GSH)含量及谷胱甘肽还原酶(glutathione reductase, GR)的活性测定参照高俊风[17]的方法。
1.3 数据处理
试验数据采用Office 2016和DPS 7.05软件进行统计学分析,采用邓肯氏(Duncan’s)复极差测验显著性水平。
2 结果与分析
2.1 镁对苦瓜生长的影响
从表2中可以看出,当分别利用0、20、40、80、160 mg/L等5个镁浓度处理苦瓜时,随着施镁浓度的增加,苦瓜的株高、根长、根系体积和生物量均呈先增后降趋势,且在40 mg/L鎂处理时达到最大值,在该处理下几乎所有的生长指标都与其他处理达到显著差异,与缺镁(0 mg/L, CK)相比,在40 mg/L处理下苦瓜株高增高57.78%,根长增长92.03%,根系体积增加115.47%,生物量增加90.77%。当镁浓度高于40 mg/L时,苦瓜各项生长指标增加幅度开始下降,但相对于缺镁处理有所提高,缺镁比过量镁对苦瓜的生长影响较大。因此,施镁能促进苦瓜的生长,提高苦瓜生物量,且在40 mg/L镁处理时促进效果最好。
表型观察发现,苦瓜缺镁症状比过量镁的症状早出现,且先出现在下部老叶,叶片少而小,生长发育缓慢;过量镁的症状出现要晚些,叶片比较薄,叶柄比较脆,叶片少而小;40 mg/L镁处理下苦瓜叶片大而浓绿(图1)。进一步观察根系生长状况,苦瓜在40 mg/L镁处理时,根系生长最好,其他浓度处理下苦瓜根系的生长均受到不同程度的抑制,苦瓜的主根系明显变短,并且在主根系尖端有明显的结瘤状,侧根减少,缺镁症状明显(图2)。
2.2 镁对苦瓜光合色素的影响
叶绿素是植物在光合作用时捕获光的主要成分。在40 mg/L镁处理下,苦瓜叶片的叶绿素a、叶绿素b和类胡萝卜素的含量最大(表3),与CK相比,叶绿素(a+b)含量增加了137.30%。进一步分析发现,当镁浓度在80 mg/L以内,苦瓜的叶绿素和类胡萝卜素含量与CK相比均有增加,但当镁浓度高达160 mg/L时,苦瓜叶绿素和类胡萝卜素含量与CK相近。说明在一定范围内,施镁处理均能使苦瓜叶片光合色素含量增加,其中40 mg/L镁处理时苦瓜的光合色素增量最大,更有助于增强苦瓜光合作用。
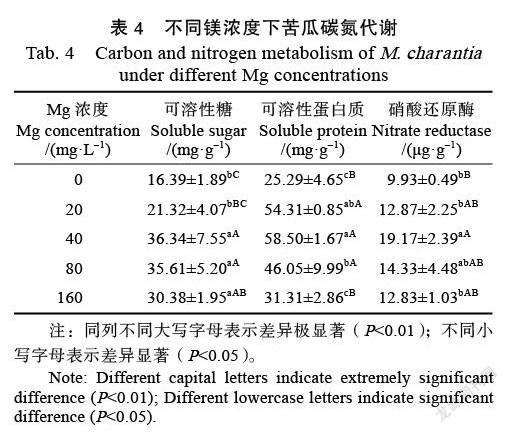
2.3 镁对苦瓜碳氮代谢的影响
表4显示,苦瓜叶片可溶性糖和可溶性蛋白含量及硝酸还原酶(NR)活性均随镁浓度的增加呈先增后降趋势,其中,上述指标在40 mg/L镁处理时均达到最大值,与CK相比,苦瓜叶片可溶性糖与可溶性蛋白质含量分别增加了121.72%、131.32%,NR活性提高了93.05%。当镁浓度超过40 mg/L时,苦瓜叶片的可溶性糖和可溶性蛋白含量及NR活性开始下降,但与CK相比略有增加。推测适量施镁可以提高苦瓜叶片中可溶性糖和可溶性蛋白含量及NR活性,且镁浓度40 mg/L时最有助于提高苦瓜叶片碳氮代谢水平。
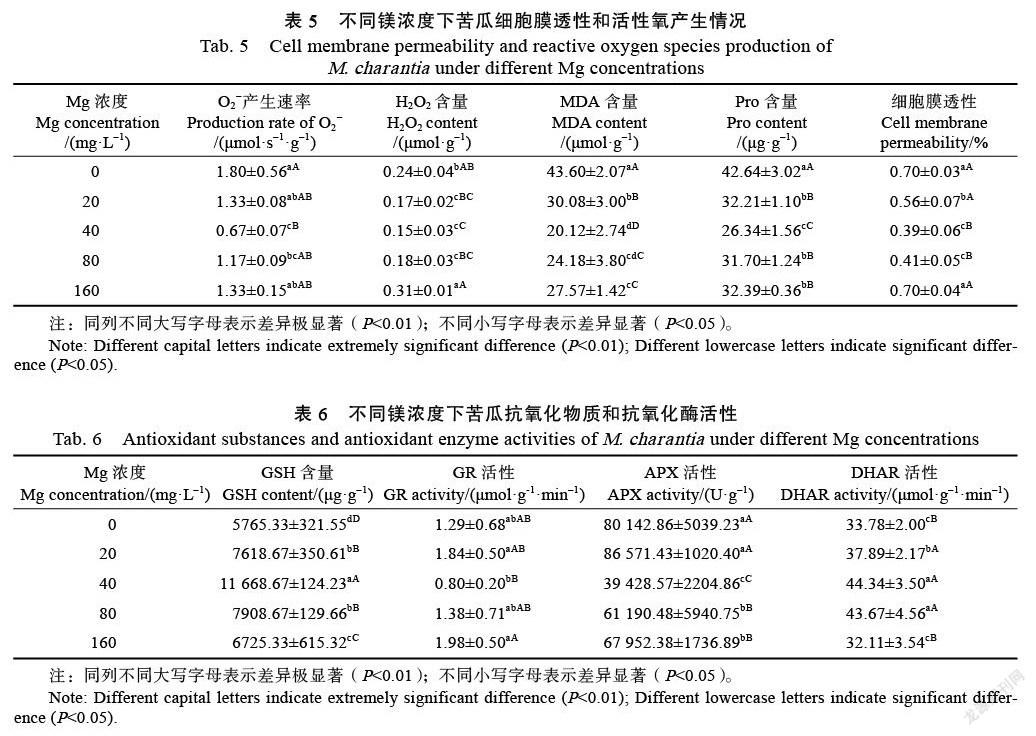
2.4 镁对苦瓜活性氧产生和细胞膜透性的影响
随着施镁浓度的增加,苦瓜叶片的O2−产生速率、细胞膜透性及H2O2、丙二醛(MDA)、游离脯氨酸(Pro)含量均呈先降后增的趋势(表5),其中,40 mg/L镁处理下这些指标均处在最低值,与CK相比,苦瓜叶片的O2−产生速率下降了62.78%,细胞膜透性降低了44.29%,H2O2含量降低了37.50%,MDA和Pro含量分别降低了53.85%、38.23%。当镁浓度超过40 mg/L时,上述指标均有不同程度的增加。以上结果表明,缺镁和过量镁处理下,苦瓜叶片细胞发生膜脂过氧化反应,破坏细胞膜结构,积累较多的O2−,而当施镁量控制在40 mg/L时,苦瓜能很好清除体内有毒物质,保护细胞膜系统。
2.5 镁对苦瓜抗氧化物质及抗氧化酶活性的影响
表6显示,在0~160 mg/L镁处理下,苦瓜叶片的谷胱甘肽(GSH)和脱氢抗坏血酸还原酶(DHAR)活性呈先增后降的趋势,其中,40 mg/L镁处理后的苦瓜叶片谷胱甘肽(GSH)含量和DHAR活性达到最大值,相比此处理,其他镁处理下苦瓜的保护物质GSH含量明显降低。同时,由表6可知,在缺镁胁迫下,苦瓜叶片的谷胱甘肽还原酶(GR)含量和抗坏血酸过氧化物酶(APX)活性最高,且随着施镁浓度的增加,2个指标都开始降低,在40 mg/L镁处理时达最低值;当镁浓度超过40 mg/L时,GR含量和APX活性又开始增加但均低于缺镁处理。以上说明,苦瓜叶片在40 mg/L镁处理下能够很好清除自由基,而镁缺乏及过量胁迫下苦瓜叶片细胞内活性氧含量可能增加,细胞损伤加大。
由表7可知,随着镁浓度的增加,苦瓜叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性呈先增后降的趋势,且在40 mg/L镁处理时3个酶活性均最高,与CK相比,叶片SOD、POD、CAT活性分别提高4.52%、74.93%、152.35%,除了SOD外,其他2个酶有显著性差异。当镁水平超过40 mg/L时,SOD、POD和CAT活性开始下降。这表明适量施镁有利于提高苦瓜叶片保护酶活性,而缺镁和过量镁胁迫均会导致叶片保护酶活性降低,反而不利于清除体内活性氧,进而影响苦瓜生长。
3 讨论
3.1 镁缺乏和过量胁迫对苦瓜生长发育的影响
镁元素是植物生长发育所必需的金属元素之一,是组成叶绿素的重要成分,同时,镁离子参与多种光合酶的合成,对植物的光合作用具有重要意义,因此镁缺乏或过量都会对植物生长产生影响[1]。本研究中,苦瓜的株高、根系长度、根系体积及生物量在40 mg/L镁处理时均达到最大值,当镁浓度超过40 mg/L时,随着镁浓度提高,苦瓜各项生长指标增长幅度有所下降,即缺镁和镁过量会抑制苦瓜的生长,这与田斌等[18]的研究结果类似。叶绿素含量一般和净光合速率呈正相关,镁是叶绿素的重要组成成分,前人研究表明,适量浓度的镁可以增加作物叶片叶绿素含量,而缺镁及高浓度镁会降低叶片叶绿素含量,进而影响光合速率[19]。本研究发现在40 mg/L镁处理时叶片叶绿素含量最大,随着镁浓度的增加,光合色素含量增长的幅度也开始下降,当缺镁或者镁浓度达到160 mg/L时,苦瓜光合色素含量较低,苦瓜叶片光合色素含量在不同镁浓度处理下与各项生长指标呈现出相同的趋势,表明在一定范围内,施镁处理提高了苦瓜叶片光合速率,促进苦瓜生长,但缺镁和过量镁胁迫下叶片光合色素含量降低。以上结果表明,镁浓度在40 mg/L时苦瓜叶片光合色素含量较高,有助于提升叶片光合速率,促进苦瓜生长。
可溶性糖和可溶性蛋白含量是蔬菜的重要品质指标,而可溶性蛋白质含量的下降是植物衰老的标志[20]。硝酸还原酶(NR)是植物体内氮代谢的关键酶,其活性强弱影响着植物体内氮同化能力。镁能稳定合成蛋白质所必需的核糖体构型,因此,植物所需镁含量供应是否及时直接影响蛋白质合成[21]。前人研究发现可溶性蛋白含量与NR活性之间呈极显著相关[21-22],故镁水平可能通过影响NR活性间接影响蛋白质的合成,影响氮素代谢[21]。本研究结果表明,在施镁濃度为40 mg/L处理时,苦瓜叶片的可溶性糖和可溶性蛋白含量最高,NR活性最大,当镁浓度超过40 mg/L时,上述指标增加幅度开始降低,但与缺镁相比略有增加,表明适量施镁肥尤其镁浓度控制在40 mg/L时有助于提高苦瓜碳氮代谢,促进苦瓜生长,提升苦瓜营养水平。
3.2 镁缺乏和过量胁迫对苦瓜抗性生理的影响
植物在正常生长条件下,其体内活性较高的保护酶系统会使活性氧的产生和清除维持在一个动态平衡,而逆境胁迫会打破这种动态平衡,促使植株体内产生破坏植物分子的物质,如O2−、H2O2和丙二醛(MDA)等,严重影响植物的正常生长和发育[23]。MDA作为膜脂过氧化的主要产物,其含量的高低直接反映膜脂被过氧化而受伤害的程度[24]。游离脯氨酸(Pro)是植物细胞内的一类重要渗透调节物,其作用与可溶性糖等相似,可以增加细胞内溶质量,防止细胞过度失水造成渗透胁迫,降低冰点,减轻胁迫对细胞的损害[25]。细胞膜相对透性的变化能反映植物胁迫伤害程度,相对膜透性越大说明胁迫伤害越大[26]。本研究发现,在镁缺乏(0 mg/L)和过量(160 mg/L)处理下,苦瓜叶片中MDA和H2O2含量增加,推测该过程中细胞发生膜脂过氧化反应,积累了大量的O2−,破坏了苦瓜细胞膜系统的结构,使得叶片细胞膜透性增加,作为渗透调节物质的Pro也相应增加,该结果与前人[27]研究一致。此外,本研究还显示缺镁胁迫对苦瓜膜系统的损伤程度高于过量镁胁迫,但当镁浓度控制在40 mg/L处理时,苦瓜叶片的H2O2、MDA、Pro含量及O2−产生速率相对较低,有助于保护细胞膜系统,从而增强植物抵御镁胁迫能力。
POD、SOD和CAT等是植物体内重要的抗氧化酶和细胞保护酶系统[28],在逆境条件下能够清除活性氧和自由基,从而避免膜损伤,以维持植物的代谢平衡。在本研究中,当镁浓度为40 mg/L时,苦瓜叶片的SOD、POD和CAT活性均达到峰值,SOD活性的提高可以促使苦瓜体内O2−发生歧化反应生成H2O2,而POD和CAT作为H2O2的清除酶,其活性的显著提高使得H2O2还原成H2O和O2,有助于减少体内O2−和H2O2的积累,保护叶片细胞膜系统,而镁缺乏和过量均会导致苦瓜叶片保护酶活性降低,体内大量积累O2−和H2O2,细胞膜透性增加,细胞损伤加剧。谢小玉等[27]研究发现,过量镁和缺镁均导致黄瓜(Cucumis sativus)幼苗叶片MDA、H2O2含量及O2−产生速率升高,且缺镁升幅大于镁过量 。
抗坏血酸——谷胱甘肽(AsA-GSH)循环是存在于植物体内的重要H2O2清除系统,能够有效清除过量的H2O2[29]。APX是AsA-GSH循环的第一个酶,该酶能专一性地催化AsA与H2O2反应形成MDHA,在降低H2O2对植物产生的损伤方面起着关键作用[30]。GR是植物体内一种重要的抗氧化酶类,其主要的生理功能是将氧化型GSSG还原成还原型GSH,从而为活性氧的清除提供还原力,保护植物免受伤害[31]。还原型GSH是植物体内重要的抗氧化剂和信号物质,对植物新陈代谢的维持起到很重要的作用,具有清除自由基、抵抗过氧化损伤、保护酶和结构蛋白及膜系统的功能[32]。DHAR是植物体内一种重要的抗氧化酶,也是植物AsA-GSH循环中能够促进AsA再生的关键酶。本研究结果显示,苦瓜叶片GSH含量及DHAR活性在40 mg/L镁处理时达到最大,而缺镁和过量镁胁迫下苦瓜叶片的GSH含量及DHAR活性明显降低;苦瓜叶片APX和GR活性在缺镁处理下最高,随着施镁浓度的增加,活性开始降低,在40 mg/L镁处理时活性最低,当镁浓度超过该水平时,APX和GR活性又开始提高但增加的幅度低于缺镁处理。前人研究表明,POD、SOD和CAT三者协调一致时减少活性氧对细胞膜的伤害,使植物体内活性氧自由基维持在一定的水平,减轻膜质过氧化和稳定膜的透性,使植物能够进行正常的生长和代谢[33]。本研究显示,在40 mg/L镁处理下,苦瓜叶片的SOD、POD和CAT活性提高,该酶系形成的防御系统能够较好地抵抗外界胁迫,且苦瓜体内产生较多的保护类物质GSH,使得细胞膜系统相对完好,确保酶及膜系统的功能正常发挥,维持苦瓜代谢平衡。而缺镁和过量镁胁迫下苦瓜叶片的GSH含量明显降低,缺镁时苦瓜叶片GSH含量最低,苦瓜叶片内部积累了较多的MDA、H2O2和O2−,损害了细胞膜系统,由SOD、POD和CAT形成的防御系统已经无法清除体内的O2−和H2O2,为了降低外界的胁迫,可能启动了AsA-GSH循环系统,促使APX和GR活性提高,但胁迫下苦瓜体内积累了过多有毒物质,细胞内可能已经超过负荷,细胞受到无法复原的损害。
从生长特性(叶片和根系形态、光合色素含量、碳氮代谢、生物量积累)和生理响应(渗透调节、膜伤害和抗氧化)等综合角度看,在40 mg/L镁处理下,苦瓜生长最好,表明该浓度为苦瓜栽培最适宜施镁浓度。
参考文献
[1] 林敏霞, 张晓东, 邱美欢, 等. 植物镁素生理功能及镁素营养诊断和施用[J]. 热带农业科学, 2016, 36(3): 39-43.
[2] Jin X L, Ma C L, Yang L T, et al. Alterations of physiology and gene expression due to long-terrn magnesium-deficiency differ between leaves and roots of Citrus reticulate[J]. Journal of Plant Physiology, 2016, 198: 103-115.
[3] 熊英杰, 陈少风, 李恩香, 等. 植物缺镁研究进展及展望[J]. 安徽农业科学, 2010, 38(15): 7754-7757.
[4] Murphy M R. How mitochondria produce, reactive oxygen species[J]. The Biochemical Journal, 2009, 417(1): 1-13.
[5] Hermans C, Bourgis F, Faucher M, et al. Magnesium defi-ciency in sugar beets alters sugar partitioning and phloem loading in young mature leaves[J]. Planta, 2005, 220(4): 541-549.
[6] Yin S T, Ze Y G, Liu C, et al. Cerium relieves the inhibition of nitrogen metabolism of spinach caused by magnesium deficiency[J]. Biological Trace Element Research, 2009, 132 (1/3): 247-258.
[7] 刘 丽, 费裕翀, 路 锦, 等. 不同供镁水平对杉木幼苗叶片抗氧化酶活性和叶绿素含量的影响[J]. 江西农业大学学报, 2020, 42(3): 578-586.
[8] 陆志峰, 任 涛, 鲁剑巍. 我国冬油菜种植区土壤有效镁状况与油菜施镁效果[J]. 华中农业大学学报, 2021, 40(2): 17-23.
[9] 李 婷, 赵云凤, 黄家权. 两种番茄对缺镁胁迫的光合响应[J/OL]. 分子植物育种: 1-14[2021-11-22]. http://kns.cnki. net/kcms/detail/46.1068.S.20210423.1447.018.html.
[10] 林仁辉. 小白菜镁素营养生理研究[D]. 福州: 福建农林大学, 2009.
[11] 黄东风, 王利民, 李卫华, 等. 镁肥对小白菜产量、矿质元素吸收及土壤肥力的影响[J]. 土壤通报, 2017, 48(2): 427-432.
[12] 凌丽俐, 黄 翼, 彭良志, 等. 镁缺乏和过量胁迫对纽荷尔脐橙叶绿素荧光特性的影响[J]. 生态学报, 2014, 34(7): 1672-1680.
[13] 孙青慧. 苦瓜镁素营养生理的研究[D]. 福州: 福建农林大学, 2010.
[14] 李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000.
[15] Spychalla J P, Desborough S L. Superoxide dismutase, catalase, and α-tocopherol content of stored potato tubers[J]. Plant Physiology, 1990, 94(3): 1214-1218.
[16] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology, 1980, 22(5): 867-880.
[17] 高俊风. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 223-224.
[18] 田 斌, 胡玉洁, 路雪丽, 等. 镁缺乏和过量胁迫对大麦幼苗生长以及生理生化指标的影响[J]. 杭州师范大学学报(自然科学版), 2018, 17(2): 146-152.
[19] 李 泽, 谭晓风, 卢 锟, 等. 供镁水平对油桐幼苗生长及光合特性的影响[J]. 生态学杂志, 2015, 34(9): 2440- 2447.
[20] 王月福, 于振文, 李尚霞, 等. 氮素營养水平对小麦旗叶衰老过程中蛋白质和核酸代谢的影响[J]. 植物营养与肥料学报, 2003, 9(2): 178-183.
[21] 林丽琳, 陈 晟, 施木田, 等. 镁对‘新天玲’西瓜叶片光合色素, 可溶性蛋白含量和硝酸还原酶活性的影响[J]. 热带农业科学, 2015, 35(1): 26-30.
[22] 张 茜. 施氮对不同品种玉米叶片酶活性、根系特征及产量的影响[D]. 长春: 吉林农业大学, 2018.
[23] Kanazawa S, Sano S, Koshiba T, et al. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence: comparison with those during dark-induced senescence[J]. Physiologia Plantarum, 2000, 109(2): 211-216.
[24] 张桂莲, 张顺堂, 萧浪涛, 等. 水稻花药对高温胁迫的生理响应[J]. 植物生理学报, 2013, 49(9): 923-928.
[25] 张永吉, 苏 芃, 祁建波, 等. 外源一氧化氮对低温胁迫下茄子幼苗抗性的影响[J]. 植物生理学报, 2020, 56(1): 66-72.
[26] 巨 伟, 杨彩凤, 张树华, 等. 冬小麦低温处理叶片细胞膜透性的QTL定位[J]. 作物学报, 2012, 38(7): 1247-1252.
[27] 谢小玉, 张 喆. 低温和镁胁迫对黄瓜幼苗生长和生理特性的影响[J]. 中国蔬菜, 2012, 1(22): 54-58.
[28] 王 天, 宋佳承, 闫士朋, 等. 低温胁迫下磷肥施用量对油橄榄生长发育的影响[J]. 植物营养与肥料学报, 2020, 26(5): 879-890.
[29] Pu F, Ren X L. Ascorbate levels and activities of enzymes related to the glutathione-ascorbate cycle in fruits of Chinese persimmon cultivars[J]. Horticulture, Environment and Biotechnology, 2014, 55(4): 315-321.
[30] Imahori Y, Bai J, Baldwin E. Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J]. Scientia Horticulturae, 2016, 198(75): 398-406.
[31] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
[32] Jozefczak M, Remans T, Vangronsveld J, et al. Glutathione is a key player in metal-induced oxidative stress defenses[J]. International Journal of Molecular Sciences, 2012, 13(3): 3145-3175.
[33] 閆永庆, 刘兴亮, 王 崑, 等. 白刺对不同浓度混合盐碱胁迫的生理响应[J]. 植物生态学报, 2010, 34(10): 1213- 1219.
责任编辑:谢龙莲

