油菜素内酯应用于甘蔗组织培养快繁的研究
张娅 顾明华 朱可针 梁琼月 龚银花 何冰 何丽珊



摘 要:为了研究油菜素内酯(brassinolide, BL)对甘蔗组织培养的影响,本研究以“植物器官从头再生”“体细胞胚再生”2种组培快繁体系为基础,通过添加适宜浓度的2,4-表油菜素内酯(2,4-epibrassinolide, 2,4-EBL)于基础培养基中,设计了6套适用于甘蔗快繁的组合培养基方案。并于不同诱导阶段(不定根诱导、愈伤组织诱导、成苗诱导)对接种材料的形态特征及内源植物激素(油菜素内酯、玉米素核苷、生长素、脱落酸)的含量变化进行了统计与测定,探讨了油菜素内酯应用于甘蔗组织培养快繁技术的可行性。结果表明,将不定根培养基MS + 0.2 mg/L 2,4-D + 0.2 mg/L LFS与成苗培养基MS + 0.5 mg/L KT +(0.2 mg/L IBA / 0.2 mg/L 2,4-EBL)+ 300 mg/L Pro进行组合,为甘蔗组培快繁的较优方案,油菜素内酯可应用于甘蔗组织培养快繁技术,且体细胞胚再生成苗优于愈伤组织再生成苗,成苗时间可缩短至32 d。
关键词:甘蔗;组织培养;油菜素内酯;植物激素
中图分类号:S566.1 文献标识码:A
Abstract: Based on two tissue culture and rapid propagation systems of “plant organ de novo regeneration” and “so-matic embryo regeneration”, six combinations of medium were designed by adding appropriate concentration of 2,4-epibrassinolide into the basic medium to explore the effects of brassinolide (BL) on sugarcane tissue culture. The morphological characteristics of different induction stages, including adventitious root induction, callus induction and seedling induction, were analyzed. The content changes of endogenous plant hormones (brassinolide, zeatin riboside, indole 3 acetic acid, abscisic acid) were determined. The feasibility of brassinolide application in sugarcane tissue cul-ture and rapid propagation was discussed. The combination of adventitious root medium MS+0.2 mg/L 2.4-D+0.2 mg/L LFS and seedling medium MS + 0.5 mg/L KT+(0.2 mg/L IBA / 0.2 mg/L 2,4-EBL)+ 300 mg/L Pro was the better scheme for sugarcane tissue culture and rapid propagation. Brassinolide could be used in tissue culture and rapid propagation of sugarcane. The regeneration time of somatic embryo was better than that of callus, which could be shortened to 32 days.
Keywords: sugarcane; tissue culture; brassinolide; phytohormone
DOI: 10.3969/j.issn.1000-2561.2021.12.014
甘蔗(Saccharum officinarum L.)是我國重要的糖料作物,产糖量占我国食糖总产量的90%以上[1],同时,甘蔗作为C4高光效及同源多倍体遗传研究的模式植物,具有重大的科研价值[2]。受限于遗传背景复杂且全基因组测序未完成的阻碍,甘蔗的育种进程缓慢[3]。现今的甘蔗传种方式以农民自留种为主,且多为第三年蔗,因其易携带宿根矮化病、黑穗病、花叶病及黄叶病等病害,导致种苗的质量差,常对后续甘蔗的生产造成严重影响[4]。基于甘蔗幼嫩组织的全能性,利用茎尖生产脱毒苗不失为最有效的繁种方式[5-6]。大田研究数据表明,应用甘蔗脱毒健康种苗可使甘蔗增产15.1%~52.0%,蔗糖糖分提高0.12%~ 1.71%[4]。
油菜素甾醇(brassinosteroids, BRs)是一类在植物中广泛存在、含多羟基的甾醇类化合物的统称,油菜素内酯(brassinolide, BL)是植物体内BRs中生物活性最强的一种[7]。近些年,伴随有关BRs合成途径、信号通路及其与其他激素互作调控机制的研究取得显著进展[8-10],使得BL及其类似物在组培快繁领域的应用成果也快速积累。于中草药(甘肃贝母)[11]、林木(桉树、胡杨)[12-13]、蔬菜(马铃薯)[14]及水果(香蕉、五指毛桃)[15-16]等材料的再生培养试验中均发现,BL及其类似物对不定根诱导和再生培养体系构建的促进效果明显,且当BL的应用剂量小于1 mg/L时效果更佳。有关BL在甘蔗组培中的应用研究,Chavan等[17]将2~7 mg/L浓度梯度的BL添加于培养基中,以探究其对甘蔗Co.86032茎尖繁殖效率的影响。该研究发现:在添加5 mg/L BL培养基上生长的材料获得比对照更强的生命力及更高的成活率。但遗憾的是该研究并未对BL与其他激素的互作关系进行探讨。
目前将BL及其类似物应用于甘蔗组培快繁的研究较少,基于BL具有低量高效的促生长特性,本研究以植物器官从头再生、体细胞胚再生2种组培快繁体系[18]为基础,通过添加适宜浓度的BL于MS培养基中,共设计6套适用于甘蔗快繁的培养基组合方案,旨在为BL应用于甘蔗组培快繁技术提供一定理论研究基础。
1 材料与方法
1.1 材料
实验材料:‘德蔗03-83’,采自广西大学农学院试验田。试验相关激素:灵发素(lingfasu, LFS, PGR-08, 99%)、2,4-表油菜素内酯(2,4-epibras¬si¬n¬o-lide, 2,4-EBL, 99%)、萘乙酸(naphthaleneacetic acid, NAA, 99%)、激动素(kinetin, KT, 99%)、吲哚丁酸(indole butyric acid, IBA, 99%)、脯氨酸(proline, Pro, 99%),上述试剂均购于南宁市科杰生物试剂经营部。激素含量测定试剂盒:油菜素内酯(brassinolide, BL)、玉米素核苷(zeatin riboside, ZR)、生长素(indole 3 acetic acid, IAA)、脱落酸(abscisic acid, ABA)酶联免疫检测试剂盒均购自北京北农天一生物技术有限公司。
1.2 方法
1.2.1 外植体的获取及不定根的诱导 于连续晴朗的艳阳天上午9:00‒10:00,砍下健壮成熟的甘蔗茎尖。剥离大部分外层组织后,在超净工作台中继续剥离剩余外层组织直至获得最幼嫩茎尖。将茎尖置于无菌铝盘上,并用无菌刀截去头尾后切成1~2 cm的小段,随后接入不定根诱导培养基中(表1),每瓶接种4个外植体,以每10瓶为1个重复,设3个重复共计接种30瓶。材料置于恒温培养室(26±2)℃内避光培养11 d后,将光照时间重新设定为12 h光/12 h暗,光照强度设为1000 lx。观察统计外植体存活率及不定根发生率[19]。
1.2.2 愈伤组织的诱导 待不定根诱导完成后,将不定根从外植体上切下,分别转接至方案O1/O2及方案O3/O4对应的愈伤组织诱导培养基中(表1),每瓶接种3条不定根,以每5瓶为1个重复,每处理共接种15瓶。置于(26±2)℃恒温培养室中培养,光照时间设定为12 h光/12 h暗,光照强度为1000 lx,每2周继代1次,定期统计愈伤组织发生率[19]。
1.2.3 成苗诱导 比較“植物器官从头再生”“体细胞胚再生”2种组培快繁体系的成苗效率,即分别将经方案O1、O2、O3、O4诱导生成的愈伤组织(1~2 cm的小团块)转接至各方案对应的成苗培养基,或直接将方案S1、S2诱导的不定根分别转接到各方案对应的成苗培养基中(表1)。每瓶接种4团愈伤组织或4条不定根,以每3瓶为1个重复,每处理共接种9瓶。所有材料均置于(26±2)℃恒温培养室中培养,光照时间为12 h光/12 h暗,光照强度为1000 lx,统计各方案的成苗率[19]。
1.2.4 甘蔗无菌苗的激素测定 分别采集6套培养方案所培育的生根苗鲜样0.5 g,每个处理重复3次,共计12个样品(方案O1、O2处理均无成苗),迅速浸过液氮后置于‒80 ℃冰箱中保存,参照间接竞争酶联免疫吸附分析法(indirect competitive enzyme-linked immunosorbent assay, ic-ELISA)[20]测定样品中植物内源激素BL、ZR、IAA与ABA的含量。
1.3 数据处理
采用2019版Excel软件整理数据,SPSS 19.0软件进行单因素方差分析(anova),Origin 2019软件作图。
2 结果与分析
2.1 不定根诱导情况(初代培养)
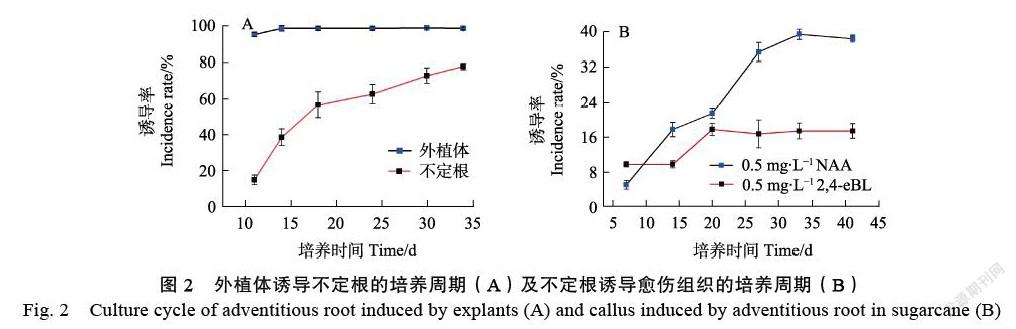
接种甘蔗茎尖于不定根诱导培养基MS+ 0.2 mg/L 2,4-D+0.2 mg/L LFS上,7 d左右外植体膨大,由白色转为微浅褐色(图1A),11 d后结束暗室培养,膨大组织上长出嫩白短须的根状物,即为不定根(图1B),待不定根长约3~5 cm时可转入下一阶段进行愈伤组织诱导。除个别外植体发生污染及褐化坏死外,在结束初代培养时,外植体存活率为99%,不定根发生率为77%(图2A)。
2.2 愈伤组织诱导情况
将初代培养阶段诱导的不定根切下,分别接种到方案O1/O2(MS+0.2 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA),方案O3/O4(MS+0.2 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L 2,4-EBL)的2种愈伤组织诱导培养基中。培养的第19 天,2种培养基中均观察到不定根诱导出了愈伤组织(图1C)。接种20 d后,添加激素2,4-EBL的培养基其愈伤组织诱导发生率达到最大,发生率为17%;接种37 d后,添加激素NAA的培养基其愈伤组织诱导发生率达到最大,发生率为39%(图2B)。
2.3 成苗诱导情况
将方案O1、O2、O3、O4中由不定根诱导产生的愈伤组织,及方案S1、S2初代培养诱导产生的不定根分别接种于各方案所对应的成苗培养基中。培养21 d后,观察6种培养基组合方案的成苗诱导情况。
方案O1、O2诱导产生的愈伤组织接种于成苗培养基后不能诱导成苗,方案O3、O4诱导产生的愈伤组织均能诱导成苗,其生长表现为:苗株单丛、茎部纤弱嫩白、无叶展开(图1D)。方案O3成苗培养基(含0.2 mg/L IBA)的诱导出苗率为58.3%,方案O4成苗培养基(含0.2 mg/L 2,4-EBL)的诱导出苗率为24.7%,方案O3较O4的诱导成苗率增加了33.6%(表2)。
方案S1、S2初代培养阶段诱导的不定根分别接种于成苗培养基后皆能诱导成苗(图1E,图1F),方案S1成苗培养基(含0.2 mg/L IBA)诱导的苗株其茎部粗壮浓绿、叶展开,苗株单丛;方案S2成苗培养基(含0.2 mg/L 2,4-EBL)诱导的苗株其茎部纤细淡绿、叶呈蜷曲状;培养的第7天,方案S1、S2相应的出苗率分别为97.3%、87%,S1诱导出苗率较S2增加10.3%。培养的第14天,方案S1、S2的出苗率均可達100%(表2)。
可见,方案S1、S2(甘蔗体细胞胚再生成苗体系)的成苗率优于方案O3、O4(器官从头再生成苗体系)(表2)。同为添加0.2 mg/L IBA的成苗培养基处理,方案S1的诱导成苗率较方案O3提高41.7%,同为添加0.2 mg/L 2,4-EBL成苗培养基处理,方案S2较方案O4的诱导成苗率提高75.2%。
2.4 诱导苗株的内源BL、ZR、IAA与ABA含量分析
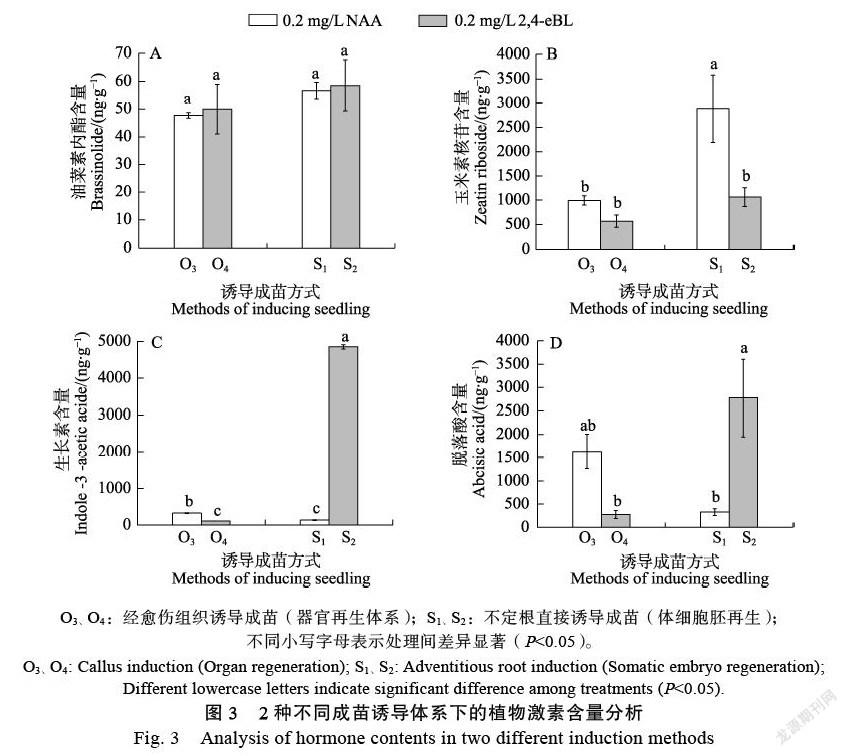
分别测定方案O3、O4(经愈伤组织诱导)、方案S1、S2(不定根直接诱导)苗株内源激素BL、ZR、IAA及ABA的含量变化。在外源IBA或2,4-EBL的处理下,激素BL的含量在2种再生成苗体系中的表现基本相同(图3A)。而经愈伤组织诱导成苗时,与0.2 mg/L IBA处理相比,添加0.2 mg/L 2,4-EBL可将内源ZR、IAA与ABA的含量水平分别降低65.2%、42.8%、83.1%。通过不定根直接诱导成苗时,与0.2 mg/L IBA处理相比,添加0.2 mg/L 2,4-EBL可将内源ZR的含量水平显著降低63.2%;但IAA、ABA含量水平显著上升,分别提高97.2%、88.2%(图3B、图3C、图3D)。
3 讨论
通过将6套组合培养基方案对甘蔗茎尖的快繁效果进行比较,体细胞胚再生成苗快繁体系(方案S1、S2)优于器官再生成苗快繁体系(方案O3、O4),而方案S的IBA处理又优于2,4-EBL处理,即快繁方案的比较结果应为:S1> S2> O3 > O4。
植物的离体器官再生,是IAA以类似于侧根发生的方式,即通过诱导中柱鞘类细胞分化产生愈伤组织[21-23]。侧根发生时,高浓度的BL可激活IAA阻遏基因表达从而负调控IAA信号,抑制侧根发生;低浓度的BL则调控IAA的运输与再分配,促进侧根形成[24]。由此猜测,2,4-EBL对不定根所起的作用,可能是以类似方式对IAA实现负调控,进而影响愈伤组织的发生及分化。在本研究的愈伤组织诱导阶段,考虑到材料对所添加的0.5 mg/L 2,4-EBL并未完全代谢,导致转接至方案O4所对应的成苗培养基(添加0.2 mg/L 2,4-EBL)后,造成材料中2,4-EBL的作用效应高度累积,抑制了IAA的分泌,致使愈伤组织不能正常分化,方案O4的成苗效率弱于方案O3(添加0.2 mg/L IBA)。
体细胞胚的再生过程受到IAA、ZR及ABA等3种植物激素的协同调控。其中,IAA以其在愈伤组织中的浓度梯度为信号,诱导并维持茎端分生组织干细胞的产生[18];ZR作为细胞分裂素的主要活性成分,其响应因子能直接激活干细胞维持基因的表达,从而调控茎尖干细胞的活性[25]。IAA与ZR对分生组织的产生及活性起着直接作用。而ABA则通过负反馈调节于IAA,从而实现对体细胞胚发生的调控[26]。本研究中,方案S2通过低量0.2 mg/L 2,4-EBL的添加,IAA的含量水平大幅升高,虽生根苗的ZR含量稍有下降,ABA水平上升,但并未影响分生组织干细胞的正常产生,苗株得以生长;方案S1通过添加0.2 mg/L IBA,生根苗内源IAA、ABA含量水平下降,虽分生组织干细胞发生受阻,但ZR含量升高,仍能激活干细胞维持基因的表达,细胞得以分裂,苗株实现正常生长。
4 结论
通过筛选比较6套甘蔗快繁成苗方案,证明油菜素内酯可应用于甘蔗组织培养快繁过程,且选择体细胞胚再生成苗培养体系优于愈伤组织再生成苗培养体系,即通过甘蔗茎尖诱导不定根,再由不定根直接诱导成苗,经32 d连续培养可得到甘蔗无菌苗植株。同时,较优的培养基组合方案为,不定根培养基:MS+0.2 mg/L 2,4-D+0.2 mg/L 08,成苗培养基:MS+0.5 mg/L KT+0.2 mg/L IBA(0.2 mg/L 2,4-EBL)+300 mg/L Pro。
参考文献
[1] 李杨瑞. 关于广西的甘蔗育种[J]. 广西糖业, 2019(3): 3-9.
[2] Zhang J S, Zhang X T, Tang H B, et al. Allele-defined ge-nome of the autopolyploid sugarcane Saccharum sponta-neum L[J]. Nature Genetics, 2018, 50(9): 1565-1573.
[3] Ithape D M, Maharana M, Tripathy S K. Scope of genetic transformation in sugarcane: a review[J]. Genomics and Applied Biology, 2017, 8(1): 1-7
[4] 李杨瑞. 广西甘蔗生产中的主要问题及几点建议[J]. 广西糖业, 2020, (4): 3-7.
[5] Tiwari A K, Bharti Y P, Tripathi S, et al. Review article: biotechnological approaches to improve sugarcane crop with special reference to disease resistance[J]. Acta Phytopathologica et Entomologica Hungarica, 2010 45(2): 235-249.
[6] 唐红琴, 方锋学, 韦金菊, 等. 甘蔗茎尖脱毒组织培养技术研究进展[J]. 南方农业学报, 2011, 42(8): 860-865.
[7] 黎 家, 李传友. 新中国成立70年来植物激素研究进展[J]. 中国科学: 生命科学, 2019, 49(10): 1227-1281.
[8] Tong H N, Chu C C. Functional specificities of brassinoste-roid and potential utilization for crop improvement[J]. Trends in Plant Science, 2018, 8(7): 1-13
[9] Choudhary S P, Yu J Q, Yamaguchi-Shinozaki K, et al. Benefits of brassinosteroid crosstalk[J]. Trends in Plant Science, 2012, 17(10): 594-605.
[10] Li T T, Kang X K, Lei W, et al. SHY2 as a node in the regu-lation of root meristem development by auxin, brassinoste-roids, and cytokinin[J]. Journal of Integrative Plant Biology, 2020, 62(10): 1500-1517.
[11] 楊 涛, 王沛雅, 张 军, 等. 濒危药材甘肃贝母试管小鳞茎再生的研究[J]. 中药材, 2016, 39(5): 971-974.
[12] 闫慧芳, 曾炳山, 范春节, 等. 油菜素内酯对巨桉组培中不定根诱导、苗木生长和茎基部细胞结构的影响[J]. 广西植物, 2016, 36(7): 763-767.
[13] Cai Z P, Jing X, Tian X G, et al. Direct and indirect in vitro plant regeneration and the effect of brassinolide on callus differentiation of Populus euphratica oliv[J]. South African Journal of Botany, 2015, 97: 143-148.
[14] 张紫娟, 侯雷平, 薛红卫, 等. 马铃薯不同起始外植体不定根快速诱导体系的建立[J]. 山西农业科学, 2019, 47(1): 1-5.
[15] 刘转霞. 油菜素内酯在香蕉离体快繁体系中的应用[D]. 福建农林大学, 2018.
[16] 陶 瑜, 劳景莉, 于旭东, 等. 不同激素对五指毛桃离体再生的影响[J]. 华中师范大学学报(自然科学版), 2019, 53(4): 528-533.
[17] Chavan C S, Chavan S S, Velhal R S, et al. Effect of brassi-nolide on in vitro growth of sugarcane Co86032 (Saccharum spp.). American Institute of Physics, 2018, 3(4): 1-6
[18] 许智宏, 张宪省, 苏英华, 等. 植物细胞全能性和再生[J]. 中国科学: 生命科学, 2019, 49(10): 1282-1300.
[19] 刘红坚, 李 松, 游建华, 等. 甘蔗新品种桂糖48号的组织培养技术研究[J]. 甘蔗糖业, 2017, (1): 9-13.
[20] 朱立平, 陈学清. 免疫学常用实验方法[M]. 北京: 人民军医出版社, 2000: 52-55.
[21] Atta R, Laurens L, Boucher- Dubission E, et al. Pluripotency of Arabidopsis xylem pericycle underlies shoot regeneration from root and hypocotyl explants grown in vitro[J]. The Plant journal, 2009, 57(4): 626-644.
[22] Che P, Lall S, Howell S H, et al. Developmental steps in acquiring competence for shoot development in Arabidopsis tissue culture[J]. Planta, 2007, 226(5): 1183-1194.
[23] Chaiwanon J, Wang Z Y. Spatiotemporal brassinosteroid signaling and antagonism with auxin pattern stem cell dy-namics in Arabidopsis roots[J]. Current Biology, 2015, 25(8): 1031-1042.
[24] 兰 雪, 王 玮, 张少英. 油菜素内酯对植物根发育调控机制研究进展[J]. 分子植物育种, 2020, 18(4): 1162-1169.
[25] Wang J, Caihuan Tian C T, Zhang C, et al. Cytokinin sig-naling activates wuschel expression during axillary meristem initiation[J]. The Plant Cell, 2017, 29(6): 1373-1387
[26] Su Y H, Su Y X , Liu Y G, et al. Abscisic acid is required for somatic embryo initiation through mediating spatial auxin response in Arabidopsis[J]. Plant Growth Regulation, 2013, 69(2): 167-176.
责任编辑:沈德发

