PD-1/PD-L1抗体治疗胃肠道癌症的研究进展
沈奥林,胡世莲,沈国栋
[1.中国科学技术大学附属第一医院(安徽省立医院)老年医学科,合肥 230001;2.肿瘤免疫与营养治疗安徽省重点实验室]
在中国、亚洲乃至全球,胃癌与结直肠癌都是发病率与致死率很高的恶性肿瘤。虽然近年来多个靶向治疗药物获批用于治疗中、晚期胃肠癌,但患者总体生存期没有得到明显改善,有效的治疗技术仍然缺乏[1-2]。因此,探究新的治疗手段,帮助晚期胃癌和结直肠癌患者改善预后十分必要。
程序性死亡受体-1(PD-1)与其配体(PD-L1)是目前免疫治疗研究中的焦点。PD-1是一个主要表达于活化T细胞的负面共刺激受体[3],与其配体PD-L1和 PD-L2结合后可抑制效应T细胞的功能[4]。许多类型的肿瘤细胞通过上调PD-L1的表达,以达到免疫逃逸的目的。对抗这样的负性调节机制,PD-1/PD-L1 免疫检查点抑制剂可阻止PD-L1/PD-1 结合,使效应 T 细胞的功能重新被激活,从而解除对免疫系统的抑制,阻断肿瘤转移并减轻肿瘤负荷。目前靶向PD-1/PD-L1的单克隆抗体药物被美国FDA批准上市的有五个,分别是纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、阿朱特单抗(atezolizumab)、德瓦鲁单抗(Durvalumab)和阿维单抗(Avelumab),在恶性黑色素瘤、肺癌、膀胱癌、胃癌、霍奇金淋巴瘤、乳腺癌等多种恶性肿瘤的治疗中取得了显著效果。在这些药物中,派姆单抗和纳武单抗是最先获得批准的两种免疫检查点抑制剂,它们在胃肠道恶性肿瘤的治疗研究中也显示出了良好的疗效。本文将对其单药的安全性、有效性及联合治疗效果等方面进行综述。
1 胃癌治疗
1.1 纳武单抗单药治疗 2017年欧洲肿瘤内科学大会ESMO报道了纳武单抗的三期临床试验 ATTRACTION-02[5]的研究结果,这项研究纳入了日本、韩国、台湾等地49个临床基地的符合晚期不可切除的、复发的胃腺癌或胃-食管结合部腺癌的患者,并且既往接受2种以上治疗方案,分为纳武单抗组(3 mg/kg,每2周用药1次)和安慰剂组,主要研究终点(指标) 为总生存期(OS)。最终两组入组患者数分别为330和163。实验结果显示,纳武单抗组的客观缓解率(ORR)为11%,而安慰剂组未见缓解患者。中位总生存时间分别为5.3个月和4.1个月;24个月时的OS分别为12%和5%,两组间差异有统计学意义。不良反应(AE)方面,虽然纳武单抗组总体AE可达到43%,但3~4级AE发生率为11%,主要是瘙痒、腹泻、乏力、皮疹、食欲减退和恶心;其中免疫治疗相关的严重AE时间与既往报道的数据相似,发生率低于5%,多出现于接受 纳武单抗治疗的前3个月内。此实验体现的生存优势表明了纳武单抗对于治疗晚期胃癌患者是一种安全有效的方案。值得一提的是,对于PD-L1阴性的患者(PD-L1<1%)使用纳武单抗与安慰剂相比,平均OS为6.1:4.2(HR=0.72,95%CI:0.49~1.05),在PD-L1阳性患者中(192例中的26例),OS报告的中位数分别为5.2个月和3.8个月(HR=0.51,95%CI:0.21~1.25),这说明了纳武单抗的作用可能与肿瘤表达PD-L1的阳性率无关[6]。基于临床试验ATTRACTION-02的研究结果,2017年9月,日本批准了纳武单抗用于化疗后进展的、不可切除的晚期或复发性胃癌的治疗,这也是是全球第一个被批准用于胃癌治疗的免疫检查点抑制剂。
1.2 纳武单抗联合治疗 2018年JCO发表的一篇论文报道了纳武单抗和纳武单抗联合易普利姆玛治疗化疗耐药的食管胃癌西方患者的安全性和有效性[7],临床试验纳入了来自欧洲或美国临床研究中心的晚期或转移性化疗耐药的胃癌、食管癌与胃食管交界处肿瘤患者160例(59例纳武单抗3 mg/kg,49例纳武单抗1 mg/kg联合易普利姆玛3 mg/kg,52例纳武单抗3 mg/kg联合易普利姆玛1 mg/kg),其中79%的患者之前接受过两或三种治疗,主要的研究终点是客观缓解率,并评估了肿瘤PD-L1状态与治疗反应和患者生存之间的关系。结果显示三组治疗的客观缓解率分别为12%、24%和8%,其中疾病缓解情况与肿瘤PD-L1表达强弱无关;三个组中位随访时间分别为28、24和22个月,12个月无进展生存率分别为8%、17%和10%,12个月总生存率分别为39%、35%和24%;治疗相关3~4级不良反应率分别为17%、47%和27%。该项研究首先验证了亚洲ATTRACTION-2实验中纳武单抗单药治疗的临床活性,同时研究人员发现在纳武单抗中增加易普利姆玛药物剂量会延长患者的生存期,他们推测这可能与易普利姆玛加强了PD-L1介导的免疫反应有关,并且认为纳武单抗联合易普利姆玛治疗化疗耐药的食管胃癌患者更好。在ATTRACTION-2之后,纳武单抗被批准作为治疗晚期胃/胃食管交界处(G/GEJ)癌症的新选择。为了进一步提高一线治疗的疗效,在ATTRACTION-4的临床试验中,研究者们评价了纳武单抗联合S-1加奥沙利铂(SOX)或卡培他滨(CAPE)加奥沙利铂(CapoX)的在晚期胃癌中的疗效[8]。21例接受纳武单抗联合S-1加SOX,18例接受纳武单抗联合卡培他滨的治疗,纳武单抗+SOX的客观有效率为57.1%(95%CI:34.0~78.2),纳武单抗+CapoX的客观有效率为76.5%,且不良反应较少,研究结果表明:纳武单抗与奥沙利铂或卡培他滨联合使用对于未经治疗不能切除的晚期或复发性G/GEJ癌症患者来说可能是一种有效治疗方案。
1.3 派姆单抗单药治疗 关于派姆单抗对于胃癌的治疗也有相应的临床研究,在 KEYNOTE-059 队列研究中[9],纳入了259例晚期不可切除的、复发的胃腺癌或胃-食管结合部腺癌的病人接受派姆单抗单药治疗(200 mg,每3周用药1次),治疗时间为24个月,或直到出现疾病进展以及患者出现不可耐受的毒性。结果显示,ORR为12%,其中3例患者达到了完全缓解;中位无进展生存时间(PFS)为2个月,中位OS为5.5个月,6个月的无进展生存率和总生存率分别为14.6%和45.7%。有效率及中位生存时间在数值上与ATTARCTION-02研究相当。不良反应方面,3~5级药物相关的AE发生率为18%,无4~5级免疫相关反应或输液反应。最常见的不良反应是疲劳、肌肉骨骼疼痛、食欲下降、瘙痒、腹泻、恶心、皮疹、发热、咳嗽、呼吸困难和便秘。还有很少一些患者产生的反应是与派姆单抗免疫介导的副作用有关,包括肺炎、结肠炎、肝炎、内分泌病和肾炎。因此,对于非选择性的胃癌,二线或后线化疗后免疫治疗是新的选择。基于KEYNOTE-059(临床注册号:NCT02335411)的试验结果,2017年9月22日,美国FDA批准派姆单抗用于复发性局部晚期或转移性胃癌或胃食管连接腺癌的患者。
1.4 派姆单抗联合治疗 在KEYNOTE-059的第2阶段研究中,研究者们将派姆单抗与5-FU/顺铂化疗对患者进行联合治疗,有25例HER2晚期患者GC/GEJC联合派姆单抗与5-FU/顺铂化疗[10]。其ORR是60%,明显高于派姆单抗的单药治疗(ORR为25.8%),这是迄今为止派姆单抗在晚期胃癌治疗中报道最高的ORR;虽然派姆单抗加顺铂和5-氟尿嘧啶在研究中显示出作为晚期G/GEJ腺癌一线治疗良好的抗肿瘤活性,但是联合治疗的不良反应明显,3~4级的AE为76%,免疫治疗相关的AE也达到了16%,特别是与化疗相关的中性粒细胞减少的发生率略有升高,因此如何在治疗过程中减少毒性反应非常重要,这仍需要大规模的临床实验来进一步探索。
2 结直肠癌治疗
2.1 纳武单抗单药治疗 Topalian等[11]用纳武单抗治疗的19例结直肠癌患者中,均没有产生临床反应,推测可能与CRC肿瘤细胞表面PD-L1表达为阴性有关。进一步对结直肠癌患者基因测序显示MSI-H的CRC患者比MSI-L的CRC患者的肿瘤细胞表面表达更多的PD-L1,提示了MSI的高低与抗PD-1/PD-L1单克隆抗体治疗效果有关。在纳武单抗在checkMate142的临床实验中,治疗dMMR/MSI-H型CRCⅡ期临床试验结果则显示出优异的临床效果[ORR为31.1%,疾病控制率(DCR)为69%][12]。
2.2 纳武单抗联合其他药物治疗 2016年ASCO年会上研究者公布 评估纳武单抗联合易普利姆玛方案在 MSI-H及非MSI-H结直肠癌患者中疗效的Ⅱ期临床试验(CheckMate142)中期结果[13]。该试验将患者分为单药组(33例MSI-H患者)和联合用药组(26例MSI-H患者+23例非MSI-H患者),结果表明,在MSI-H患者中,单药组和联合组中研究者评估的客观缓解率分别为27%、15%。单药组4个月无进展生存率及5个月生存率分别为55%、75%,联合用药组则分别为80%、100%,较单药组高。在2017年美国胃肠肿瘤研讨会中,研究者发布了新的试验结果[12]:晚期复发或证实为dMMR/MSI-H 的转移性结直肠癌患者接受纳武单抗联合易普利姆玛和纳武单抗单药治疗,结果显示,在119名患者中,在中位随访13.4个月时,研究者评估ORR为55%(95%CI:45.2~63.8),12周的疾病控制率为80%,94%的患者出现病情缓解,无进展生存率分别为76%和71%。总生存率分别为87%和85%,只有32%的患者发生3~4级治疗相关不良事件,治疗具有很好的安全性和实用性,同时可以看出纳武单抗联合治疗优于单药治疗。在2017年ASCO年会中,Andre更新了联合用药组27例MSI-H患者的试验结果[14]研究者评估的客观缓解率为41%,疾病控制率为78%,中位缓解时间为2.7个月;11例有效患者中,9例患者持续缓解大于6个月,10例患者出现3~4级治疗相关的不良反应,6例患者因严重不良反应终止试验,无治疗相关性死亡。以上研究均表明联合治疗安全性可控,疾病控制率高,患者生存获益明显。
2.3 派姆单抗单药治疗 派姆单抗的Ⅱ期临床试验中,Ⅳ期错配修复缺陷(dMMR)的结肠癌患者的客观反应率和疾病控制率分别达到了40%和78%,与纳武单抗相似,远好于DNA错配修复系统完整型(pMMR)的CRC患者(ORR和DCR分别为0%和11%)[15],基于这些临床数据,FDA也于2017年5月和8月分别批准了派姆单抗和纳武单抗在dMMR型结肠癌患者的临床应用,2017年的NCCN指南也将派姆单抗和纳武单抗,推荐作为二线或三线治疗转移dMMR结直肠癌的治疗方案[16]。
2.4 派姆单抗联合其他药物治疗 2014年在美国进行的一项一期临床试验,将派姆单抗联合mFOLFOX6方案治疗7例晚期结肠癌患者,发现这种联合治疗具有较好的安全性,最常见的3~4级不良反应事件仅为中性粒细胞减少(40%)和低钠血症(30%)[17],随后进行了第二阶段队列研究[18],30名未治疗的晚期结直肠癌患者使用派姆单抗与mFOLFOX6方案联合治疗,在不区分MMR状态的情况下,其ORR为43%,8周时疾病控制率达到了100%,说明mFOLFOX6化疗方案和派姆单抗联合应用可增强结直肠癌患者的免疫原性细胞死亡和改善预后。在副作用方面,初始治疗时2名患者出现G3发热性中性粒细胞减少症(FN)和1名G4中性粒细胞减少症,研究人员将mfolfox6方案的剂量减少至奥沙利铂68 mg/m2,四氢叶酸400 mg/m2,五氟尿嘧啶为320 mg/m2,五氟尿嘧啶输注1920 mg/m2超过46 h,同时派姆单抗每3周使用200 mg直到试验结束,3~4级的不良反应仅为36.7%,也体现了派姆单抗联合治疗结直肠癌可控的安全性。
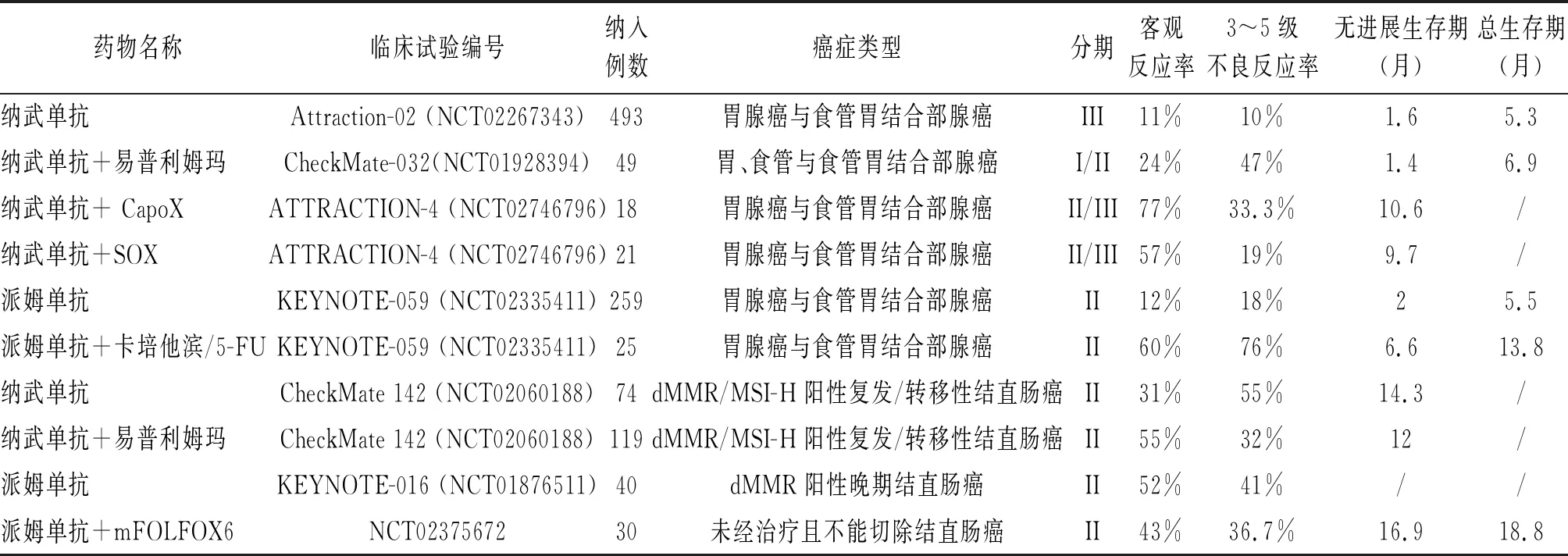
表1 PD-1/PD-L1抗体治疗胃肠道癌症的临床试验结果
此外,在最新公布的涉及包括结直肠癌在内的12种肿瘤的临床试验结果中,dMMR型实体瘤对派姆单抗的ORR和CR分别达到了53%和21%[19]。该项研究也促使FDA通过了派姆单抗治疗所有dMMR/MSIH型实体瘤的上市许可,使其成为历史上第一个依靠通用标志物,而非肿瘤发生位置来划分治疗范围的癌症药物。从现有的临床试验结果可以看出,dMMR/MSI-H型结直肠癌可高效应答PD-1/PD-L1抑制剂的治疗,但占85%的MSS型CRC则对免疫检查点抑制剂的治疗并不敏感,因此大部分的结直肠癌患者仍然缺少有效的免疫治疗方法。为解决MSS型结直肠癌对免疫检查点抑制剂的免疫耐受问题,现有临床试验开始尝试将多种免疫检查点抑制剂联合应用,或辅以放疗、化疗等方法进行联合治疗[12,16,19-20](表1),或许会有更好的疗效出现。
3 结语与展望
除了派姆单抗和纳武单抗,经FDA批准上市的其他PD-1/PD-L1免疫检查点抑制剂阿朱特单抗(atezolizumab)、阿维单抗(avelumab)和德瓦鲁单抗(durvalumab)也已开始运用于非小细胞肺癌、默克尔细胞癌(Merkel cell carcinoma)和膀胱癌等的临床治疗[21],免疫检查点抑制剂相关的药物和临床试验进入了空前的发展阶段,但仍存在一定局限性,即免疫检查点抑制剂在大部分患者中无响应。同时,作为基因组与表观遗传组综合的长期病变产物,肿瘤组织本身就具有一整套复杂的免疫调控网络,来规避机体的免疫杀伤,再加上肿瘤在患者之间存在着高度的异质性,单一的治疗方法在临床应用中往往很难产生满意的效果。将免疫检查点抑制剂、免疫抑制因子阻断剂和抗血管生成药物等多种药物有机组合起来,同时针对肿瘤微环境(TME)中肿瘤细胞和非肿瘤细胞进行联合治疗,多管齐下,或许能够取长补短,实现抗肿瘤作用的最大协同。多种联合疗法已经在胃肠道恶性肿瘤的临床治疗上开始了相关试验,如PD-1/PD-L1抑制剂与免疫因子IDO和LAG-3抑制剂的合用、PD-1抑制剂与激活KIR和CD137药物的合用,以及免疫检查点抑制剂与靶向EGFR、VEGFR和FGFR等抗血管生成药物的合用等[2]。PD-1/PD-L1免疫检查点抑制剂在晚期胃肠道中延长及改善生存方面的疗效也不断得到多项临床试验的证实。寻找预测疗效的指标可以使免疫治疗个体化,选择合适的肿瘤免疫治疗方案或制定有效的新方案,优化联合方案,免疫检查点抑制剂联合传统的放疗和化疗等方法尽量降低不良反应的发生率,为肿瘤患者提供更多的临床获益。

