呼出气冷凝液、血清和组织中miRNA34a检测对非小细胞肺癌患者的价值探讨
陶国华 孙苹苹 陈金亮 陈建荣★
肺癌是人类危害最大的恶性肿瘤,其发病率和死亡率在世界上高居榜首。2019年国家癌症中心报告:2015年数据统计结果肺癌位居我国恶性肿瘤发病首位,占城市和农村恶性肿瘤死亡第一位[1]。肺癌根据病理类型可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)两大类,肺癌中80%~85%是非小细胞肺癌[2-3]。微小核糖核酸(MicroRNA,miRNA)是一类非编码小分子RNA,miRNA 作为一类重要的参与基因表达调控的分子,代表了一种新的基因表达调控模式,它在细胞中调节约30%的蛋白编码基因,在致病过程中起着重要作用[4]。迄今为止,活检是肺癌患者诊断参考标准。不幸的是组织活检是一个有限制的过程,如难以进入不同的肿瘤部位,具有侵袭性和患者依从性低等缺陷[5]。呼出气冷凝液(exhaled breath condensates,EBC)是一种检测呼吸道生化成分的新技术。EBC 来自几乎所有的呼吸细胞类型,包括结构细胞和免疫细胞。EBC 作为呼吸道气道内衬液体含有多种生物分子,如DNA,RNA,蛋白质,代谢物和挥发性化合物。它作为一种新的非侵入性采集的样品,正逐渐受重视。目前为止,对于肿瘤组织和血液中miRNAs 的研究报道较多,而EBC 中的相关研究较少。本研究将探讨NSCLC 患者EBC中miRNA34a 的相对表达水平和血清中CEA、CYFRA21-1 的含量,其表达量与临床的相关性,并评价其在NSCLC 中的应用价值。
1 资料与方法
1.1 一般资料
选取2016年6月至2017年12月在本院呼吸科和胸外科接受治疗并经病理证实为非小细胞肺癌的50 例患者为研究对象,男性27 例,女性23例,年龄42~83 岁。纳入标准:①所有患者均符合《原发性肺癌诊疗规范(2018年版)》NSCLC 诊断标准[6];②所有患者手术前均未进行过放疗、化疗、免疫治疗及靶向治疗③所有患者知情同意本研究并签署知情同意书。排除标准:①存在手术禁忌症者;②除NSCLC 外存在其他恶性肿瘤者;③存在原发性肝肾、功能障碍者;④临床病例资料不完整或缺乏准确性者。对照组为到本院体检的健康人群50 例,其中男性28 例,女性22 例,年龄34~78岁,纳入标准:①无家族肿瘤史;②无脑心肝肾和消化系统等重要脏器疾病。③体检者知情同意本研究并签署知情同意书。排除标准:①存在肺部结节者;②有高血压、糖尿病史者。肺癌组和对照组在年龄、性别及吸烟史方面比较差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较(±s)Table 1 Comparison of general data between 2 groups(±s)

表1 两组一般资料比较(±s)Table 1 Comparison of general data between 2 groups(±s)
资料年龄(岁)性别(男/女)吸烟史(有/无)NSCLC 组(n=50)63.46±10.96 27/23 18/32对照组(n=50)62.36±7.57 28/22 15/35 t/χ2值0.584 0.199 1.489 P 值0.551 0.837 0.236
1.2 主要仪器和试剂
采用miRNA 提取分离试剂盒(批号:R6529)、增强型miRNA cDNA 第一链合成试剂盒(批号:R6519)、增强型miRNA 荧光定量检测试剂盒(批号R6510),试剂均购于北京天根生化科技有限公司。使用的主要仪器有荧光定量PCR 仪(ABI,StepOne Plus)、微量分光光度计OneDrop 1000+(松下电器中国有限公司上海分公司)、EcoScreen 冷凝器和Master Screen 简易冷凝器(德国EricJaeger Company)。德国罗氏602全自动化学发光分析仪。
1.3 方法
1.3.1 标本采集
使用真空管采集各研究对象静脉全血5 mL,1 000×g 离心10 min,分离血清样本(≥500 μL),使用无核酸酶(RNase)离心管进行分离,置于-70℃保存备用。NSCLC 患者在入院的第一天行外周血标本采集。对照组则在体检期间进行外周血标本采集。抽取患者和健康人群术前静脉血5 mL 于促凝管内,1 000 ×g 离心5 min 后取上清放入无RNase 离心管,保存于-70℃冰箱备用。用EcoScreen 冷凝器或者Master Screen 简易冷凝器预冷15 min,嘱受试者漱口、戴鼻夹,经咬嘴平静呼吸20 min 后取出收集管,待标本融化后可得到2~4 mL 液体即EBC,随即放入无RNase 的离心管中,保存于-70℃冰箱备用。
1.3.2 总RNA 的提取
采用北京天根生化科技有限公司生产的组织、血液miRNA 提取分离试剂盒对组织、血液和EBC 样本进行RNA 的提取。
1.3.3 RNA 含量和纯度测定
按照微量分光光度计OneDrop 1000+操作手册,对提取的miRNAs 进行浓度及纯度进行测定。RNA 样品浓度采用郎伯比尔定律进行计算,采用OD260/OD280比值评价RNA 样品纯度。
1.3.4 参照基因的选择
本研究选择在组织细胞中稳定表达、且应用最多的U6 作为NSCLC 患者组织中的参照基因,选cel-miR-39 作为血清和EBC 中目的基因检测时的参照基因。反应体系:cDNA 2 μL,miRNA 荧光定量检测试剂10 μL,引物终浓度200 mM,反应体积为20 μL。反应条件:预变性:94℃,2 min,94℃,20 s;64℃,34 s,40 个循环。引物序列见表2。
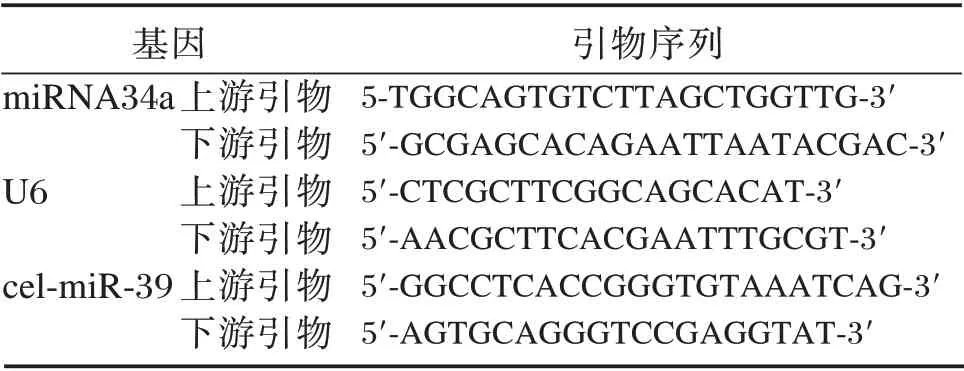
表2 miRNA34a 和参照基因引物序列Table 2 miRNA34 and reference gene primer sequence
1.3.5 CEA、CYFRA21-1 的检测
采用化学发光法,按照罗氏602 全自动化学发光分析仪测定试剂盒说明书检测,CEA 参考范围:<5 μg/L。CYFRA211 参考范围:<3.5 μg/L。
1.4 统计学处理
采用SPSS Statistics 20.0 软件进行数据统计处理。计量资料以(±s)表示,计量资料先做正态性检验(K-S 检验),若数据符合正态分布,组间比较采用t检验;若不符合正态分布,采用两独立样本的非参数检验(Mann-Whitney 法)。计数资料用n(%)表示,两组比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 组织、血清和EBC 中miRNA34a 的表达水平情况
肺癌组织中miRNA34a 的相对表达水平低于癌旁组织,差异有统计学意义(P<0.05)。非小细胞肺癌组血清和EBC 中miRNA34a 的相对表达水平均低于健康对照组,差异有统计学意义(P<0.05)。见表3。
表3 组织、血清和EBC 中miRNA34a 的表达水平(±s)Table 3 Expression levels of miRNA34a in tissue,serum and EBC(±s)

表3 组织、血清和EBC 中miRNA34a 的表达水平(±s)Table 3 Expression levels of miRNA34a in tissue,serum and EBC(±s)
样本类型肺癌组织癌旁组织血清EBC n 健康对照组t 值P 值30 30 50 50 miRNA34a 相对表达水平NSCLC 组0.898±0.957 1.527±1.282 0.795±1.179 0.724±1.157 1.477±1.262 1.355±1.042 5.312 6.496 6.222 0.00 0.00 0.00
2.2 不同病理类型和不同TNM 分期miRNA34a 表达水平
Ⅲ~Ⅳ期NSCLC 患者组织、血清、EBC 中miRNA34a 表达水平均低于Ⅰ~Ⅱ期患者,差异有统计学意义(P<0.05);鳞癌患者EBC 和血清中miRNA34a 相对表达量虽低于腺癌患者,差异无统计学意义(P>0.05)。见表4。
2.3 两组血清miR34a、CEA、CYFRA21-1 水平比较
K-S 检验结果显示,各组的miRNA34a、CEA、CYFRA21-1 的数据均呈偏态分布(P<0.05)。Mann-Whitney U 检验结果显示,与对照组比较,NSCLC组的血清miRNA34a 表达水平明显降低,差异有统计学意义(P<0.05),而CEA、CYFRA21-1 水平明显升高,差异有统计学意义(P<0.05)。见表5。
表4 不同病理类型和不同TNM 分期miRNA34a 表达水平(±s)Table 4 Expression levels of miRNA34a in different pathological types and TNM stages(±s)
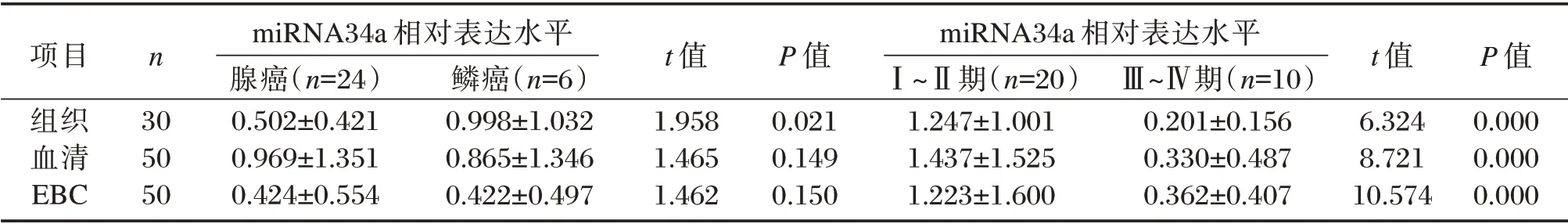
表4 不同病理类型和不同TNM 分期miRNA34a 表达水平(±s)Table 4 Expression levels of miRNA34a in different pathological types and TNM stages(±s)
项目组织血清EBC n 30 50 50 miRNA34a 相对表达水平腺癌(n=24)0.502±0.421 0.969±1.351 0.424±0.554鳞癌(n=6)0.998±1.032 0.865±1.346 0.422±0.497 t 值1.958 1.465 1.462 P 值0.021 0.149 0.150 miRNA34a 相对表达水平Ⅰ~Ⅱ期(n=20)1.247±1.001 1.437±1.525 1.223±1.600Ⅲ~Ⅳ期(n=10)0.201±0.156 0.330±0.487 0.362±0.407 t 值6.324 8.721 10.574 P 值0.000 0.000 0.000
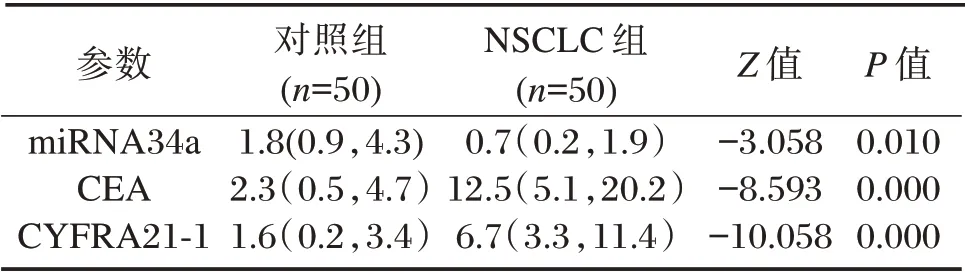
表5 两组的血清miRNA34a、CEA、CYFRA211 含量比较[M(P25,P75)]Table 5 Content of miRNA34a,CEA and CYFRA21-1 in serum between 2 groups[M(P25,P75)]
2.4 EBC miRNA34a、CYFRA21-1 和CEA 诊断肺癌的敏感性和特异性
EBC miRNA34a、CYFRA21-1 和CEA 三者联合诊断敏感度和特异度均高于单一诊断值,差异有统计学意义(P<0.05)。见表6。

表6 EBC miRNA34a、CYFRA21-1 和CEA 诊断肺癌敏感度、特异度Table 6 Sensitivity and specificity of EBC miRNA34a、CYFRA21-1 and CEA in diagnosis of lung cancer
3 讨论
2016年世界卫生组织公布的全球死亡病因统计分析结果,其中气管癌、支气管癌和肺癌排名第6[7]。2019年国家癌症中心报告肺癌位居我国恶性肿瘤发病首位,在城市和农村均占恶性肿瘤死亡第一位[1]。有研究表明对于早期非小细胞肺癌患者中位生存期远远长于晚期患者,因此提高早期非小细胞肺癌患者的检出率至关重要。
miRNA 是一类非编码小分子RNA,在基因表达中发挥“交通警察”的作用,调控基因表达[2]。Hu[4]等人研究发现有14 种miRNA 在非小细胞肺癌中显著失调,miRNA 在转录后水平负调控基因表达。miRNA34a 是miRNA34 家族的一员,是一类高度保守的miRNA,miRNA34 家族与多种疾病相关。miRNA34a 有多个作用位点,与细胞的生长、肿瘤的转移都有关系[4-5]。研究表明,miRNA34 在多种肿瘤中,如肺癌、大肠癌、胰腺癌、乳腺癌、卵巢癌、尿路上皮癌和肾癌中都会有不同程度的表达下降。Kasinski[8]等人在小鼠肺癌模型中发现p53 基因和miRNA34a 基因的相关性,并由此推断miRNA34a 在肺癌发生中发挥预防剂和静止剂的作用。miRNA34a 属于抑癌基因,可通过与癌基因(如c-myc、BCL-2、E2F3、Cyclin D1 及Cyclin E2 等)相结合,促进肿瘤细胞周期停滞于G1 期,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。有研究认为,miRNA-34a 不仅是治疗NSCLC 的有前途的分子靶点,而且还是一种有用的、新的NSCLC 的预后标志物[9]。本研究结果显示NSCLC 患者癌组织中miRNA34a 表达与TNM 分期相关,与其它学者的研究结果相一致[10]。单一的肿瘤标志物检测没有足够的灵敏度和特异性,因此,需要敏感、特异的标志物组合来提高肿瘤诊断的敏感性和特异性[11]。本研究对EBC 中miRNA34a、血 清CEA 和CYFRA21-1 对NSCLC 诊断价值进行了分析,联合检测可有效提高其诊断的敏感性和特异性。由于本研究样本量较小,在将其应用于临床作为筛查试验之前,还需要进行大规模的多中心临床研究来验证其有效性。
总之,随着对非小细胞肺癌分子生物学研究的深入,基于肿瘤标志物的诊断及预后研究将会有着越来越多的发现,EBC 中的miRNA34a 检测对NSCLC 的诊断价值值得进一步深入研究。

