电化学的“膜”力在高考试题中的展现
◇ 安徽 吕旭东 廖程和
电化学是每年高考必考的核心理论知识之一,特别是对离子交换膜的考查真可谓是常考常新.离子交换膜是膜状的离子交换树脂,可以选择性透过溶液中的阳离子或阴离子,以达到使离子选择性定向移动的目的,在提升电池性能、物质的制备和分离提纯等方面有着广泛的应用.按照透过离子的电性,高中阶段将离子交换膜分为阳离子交换膜(简称“阳膜”)和阴离子交换膜(简称“阴膜”).阳膜可以选择性透过阳离子而阻挡阴离子,阴膜可以选择性透过阴离子而阻挡阳离子,此外,还有一种只允许氢离子透过的质子交换膜.本文将离子交换膜在近年高考试题中的考查情况进行梳理,以期对大家高考复习起到借鉴作用.
1 离子交换膜在提升电池性能方面的应用
例1(2020年全国卷Ⅲ)一种高性能的碱性硼化钒(VB2)—空气电池如图1,其中在VB2电极发生反应:VB2+16OH--11e-=VO3-4+2B(OH)-4+4H2O.该电池工作时,下列说法错误的是( ).
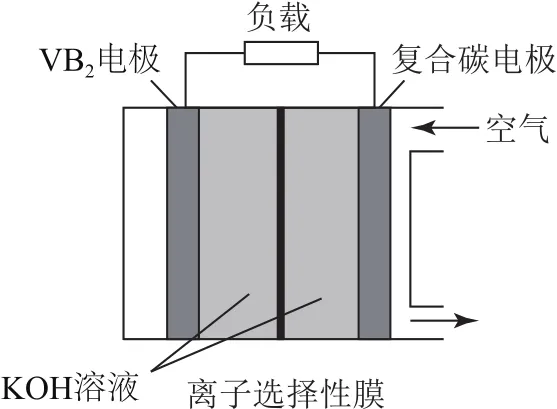
图1
A.负载通过0.04mol电子时,有0.224L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
4VB2+11O2+20OH-+6H2O=8B(OH)-4+4VO3-4
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
由图1所示的电池结构和题干信息可知,VB2电极为
解析负极,复合碳电极为正极.正极的电极反应为O2+4e-+2H2O=4OH-,每转移0.04mol电子时,消耗0.01molO2,在标准状况下为0.224L.由电极反应式可知,负极消耗OH-使负极区OH-浓度减小,pH降低,而正极生成大量的OH-使正极区pH升高,同时OH-透过离子选择性膜从正极区移向负极区.电池中,电子由VB2电极经负载流向复合碳电极,电流流向与电子流向相反,由复合碳电极→负载→VB2电极→KOH溶液→复合碳电极.答案为B.
点评
本题考查了在碱性条件下O2得电子的电极反应,放电过程中正、负极区离子浓度的变化以及电池工作时电流的方向.学生需熟练掌握原电池的基本原理,答题时才能轻松应对.
例2(2019年全国卷Ⅲ)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn—NiOOH二次电池,电池结构如图2所示.电池反应为
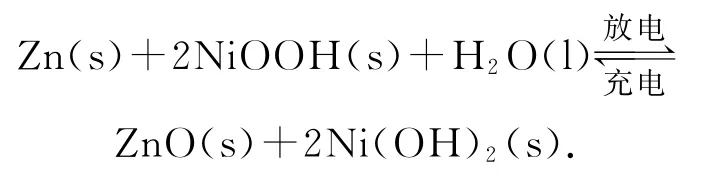
下列说法错误的是( ).
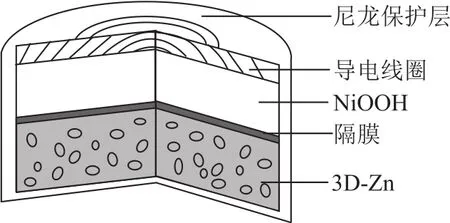
图2
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为
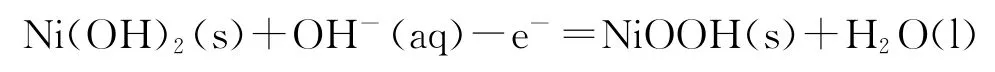
C.放电时负极反应为
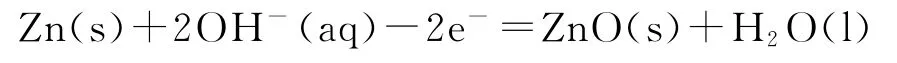
D.放电过程中OH-通过隔膜从负极区移向正极区
解析
由题干知电解质溶液为碱性,放电时,原电池的负极反应:
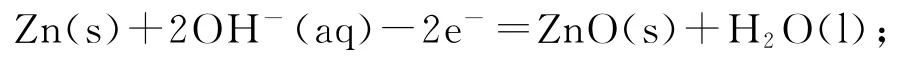
正极反应:
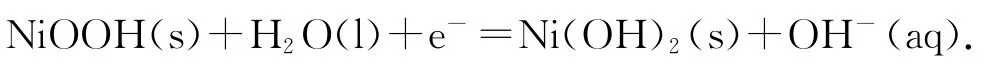
充电时,电解池的阳极反应:
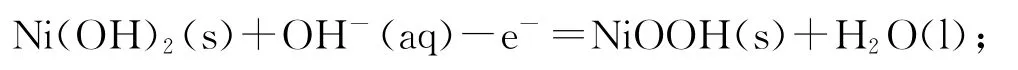
阴极反应:
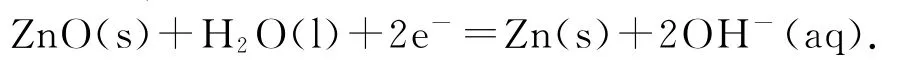
放电时,由于正极区生成OH-,而负极区OH-被消耗,所以,内电路中OH-通过隔膜由正极区移向负极区.答案为D.
点评
本题以新型二次电池的充、放电过程为情境,具体从电池性能、电极反应式、内电路中离子的移动方向方面设置选项,意在同时考查原电池和电解池的原理知识.图示虽然没有指明隔膜的类型,但学生通过仔细分析可以判断它能透过阴离子.
例3(2016年浙江卷)金属(M)—空气电池(如图3)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源.该类电池放电的总反应方程式为4M+nO2+2nH2O=4M(OH)n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能.下列说法不正确的是( ).
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较 Mg、Al、Zn三种金属—空气电池,Al—空气电池的理论比能量最高
C.M—空气电池放电过程的正极反应式:
4Mn++nO2+2nH2O+4ne-=4M(OH)n
D.在 Mg—空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
解析
增大反应的接触面积,可以使氧气充分反应,加快化学反应速率,提高电池效率.单位质量,失去电子数由多到少依次为Al、Mg、Zn,根据“理论比能量”的概念,Al—空气电池的理论比能量最高.氧气在正极得电子,由于有阴离子交换膜,正极反应式为 O2+2H2O+4e-=4OH-,负极反应式为M-ne-+nOH-=M(OH)n,OH-由正极区透过阴离子交换膜移向负极区.负极是金属失去电子生成金属阳离子,由于 Mg2+、Al3+、Zn2+都可以和OH-反应生成M(OH)n沉淀,说明宜采用中性电解质和阳离子交换膜,防止负极区产生沉淀.
点评
本题以金属(M)—空气燃料电池应用为载体,考查学生对原电池基本原理的掌握情况及获取新信息的能力.题目难度适中,难点是“理论比能量”的概念和离子交换膜的应用.
2 离子交换膜在物质制备方面的应用
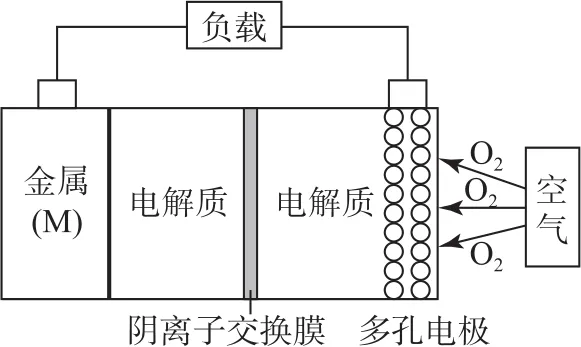
例4(2019年全国卷Ⅰ)利用生物燃料电池原理研究室温下氨的合成,电池工作时 MV2+/MV+在电极与酶之间传递电子,如图4所示.下列说法错误的是( ).
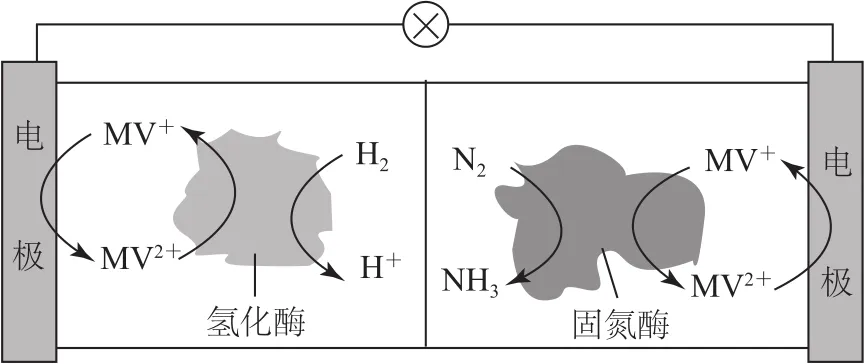
图4
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应 H2+2MV2+=2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
解析
与工业合成氨相比,此法采用酶作催化剂,在室温下就可以实现合成氨,故条件温和.由于合成氨反应放出能量,设计原电池可以把化学能转化成电能.由图4可知:左室电极反应式为 MV+-e-=MV2+,发生了氧化反应,所以左边电极为电池负极(阳极).放电生成的MV2+在氢化酶的作用下与H2发生反应:H2+2MV2+=2H++2MV+;MV2+在正极(阴极)上的电极反应式为 MV2++e-=MV+,放电生成的MV+与N2在固氮酶的作用下发生反应:N2+6H++6MV+=6MV2++2NH3.在电池的内电路中,由于阳离子移向正极方向,所以H+透过离子交换膜从左向右移动.
点评
本题利用原电池的原理合成氨,情境新颖,知识点考查全面,明确酶的作用是解题的关键.
例5(2019年江苏卷,节选)CO2的资源化利用能有效减少CO2排放,充分利用碳资源.电解法转化CO2可实现CO2的资源化利用,电解CO2制HCOOH的原理如图5所示.
(1)写出阴极CO2还原为HCOO-的电极反应式:_______.
(2)电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________.
图5
解析
(1)CO2转化为HCOO-发生了还原反应,碳元素化合价从+4降到+2,得到2个电子,再根据H元素守恒和电荷守恒可得电极反应式:.
(2)由(1)可知:Sn电极为阴极,Pt电极为阳极.阳极为惰性电极,根据放电顺序,电极反应式为:2H2O-4e-=4H++O2↑,产生的H+消耗生成CO2,与此同时阳离子K+透过阳离子交换膜移向右侧,故阳极区KHCO3溶液浓度降低.
点评
本题重点考查了电解池的活性电极和惰性电极、电极反应式的书写、微观离子的定向移动等.学生需熟练掌握活性电极作阳极材料时,电极本身失去电子发生氧化反应,而本题具有迷惑性,电极材料不参与反应.
例6(2018全国卷Ⅰ,节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛.制备Na2S2O5也可采用三室膜电解技术,装置如图6所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3.阳极的电极反应式为________.电解后,________室的NaHSO3浓度增加.将该室溶液进行结晶脱水,可得到Na2S2O5.
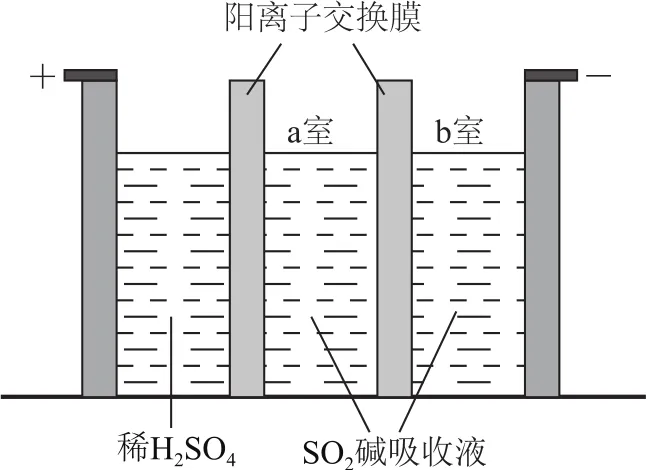
图6
解析
由图6可知,左边电极为电解池的阳极,因为放电顺序:OH->,所以阳极电极反应式为4OH--4e-=2H2O+O2↑(或2H2O-4e-=4H++O2↑),产生的H+透过阳离子交换膜移向a室,并结合生成.阴极电极反应式为+2e-=+H2↑,同时,a室中的部分Na+透过阳离子交换膜移向b室.最终导致a室中NaHSO3浓度增大,b室中Na2SO3浓度增大.
点评
本题以焦亚硫酸钠的制备为载体,考查了学生利用电解原理知识解决实际问题的能力,难点是电极反应、交换膜的作用、离子的移动方向,易错点是亚硫酸氢钠浓度的变化.
3 离子交换膜在分离提纯方面的应用
例7(2020年山东卷)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化.现以NaCl溶液模拟海水,采用惰性电极,用图7装置处理有机废水(以含CH3COO-的溶液为例).下列说法错误的是( ).
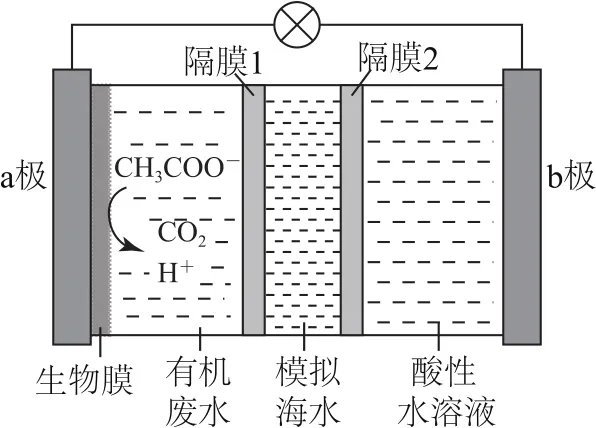
图7
A.负极反应为
CH3COO-+2H2O-8e-=2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
解析
根据图7可知,a电极:CH3COO-→CO2,碳元素化合价升高,失去电子发生氧化反应,是负极,电极反应式为CH3COO-+2H2O-8e-=2CO2↑+7H+.由于是酸性环境,正极(b电极)反应式为2H++2e-=H2↑.随着放电的进行,a极区阴离子减少,同时阳离子增多,b极区阳离子减少,根据电荷守恒,Cl-透过隔膜1(阴膜)向左移动,Na+透过隔膜2(阳膜)向右移动,从而实现海水的淡化.根据电极反应式,每转移1mol电子,透过隔膜的Na+和Cl-分别为1mol,因此消耗NaCl的质量为58.5g.正、负极电子得失始终相等,假若转移4mol电子,正极生成2molH2,而负极生成1molCO2,气体物质的量之比为2∶1.
点评
本题是定性和定量、宏观和微观的有机结合,重点考查了电极反应式和电池内电路离子定向移动的方向和数目,体现了能力立意和学科素养.
例8(2018年全国卷Ⅰ)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除.如图8所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
① EDTA-Fe2+-e-=EDTA-Fe3+;
②2EDTA-Fe3++H2S=2EDTA-Fe2++2H++S.该装置工作时,下列叙述错误的是( ).
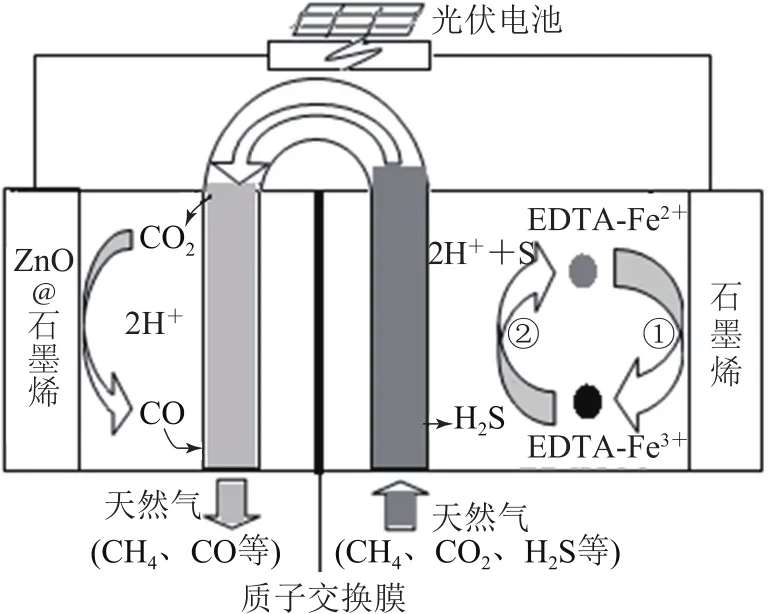
图8
A.阴极的电极反应:
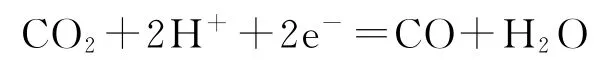
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用 Fe3+/Fe2+取代 EDTA-Fe3+/EDTAFe2+,溶液需为酸性
解析
由图8可知此为电解装置,题给石墨烯电极区发生①和②反应,两者相加得:H2S-2e-=2H++S,石墨烯电极发生氧化反应则为阳极,而ZnO@石墨烯电极为阴极,由于阳极的电势高于阴极的电势,故选项C错误.阳极区产生的H+透过质子交换膜移到阴极区发生反应:CO2+2H++2e-=CO+H2O.阳极区消除 H2S,阴极区消除CO2,协同转化生成了CO、H2O和S.Fe3+和Fe2+均会水解,在碱性和中性条件下易产生沉淀,所以溶液需为酸性.
点评
本题以科研热点石墨烯材料为电极,实现天然气除杂,起点高,立意新.在考查学生电解基础知识的同时,意在考查学生的识图能力及获取新信息的能力.
例9(2017年天津卷,节选)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图9),使浆液分离成固体混合物和含铬元素溶液,并回收利用.
采用惰性电极电解时,CrO24-能从浆液中分离出来的原因是________,分离后含铬元素的粒子是________;阴极室生成的物质为________(写化学式).

图9
解析
在直流电场作用下,阳极电极反应式为2H2O-4e-=4H++O2↑,由于阳极区阳离子增多,根据电荷守恒,浆液中的阴离子透过阴离子交换膜向阳极室移动,脱离浆液.人教版《选修4》教材中介绍了的可逆反应,所以阳极区含铬元素的离子是和.阴极电极反应式为2H2O+2e-=2OH-+H2↑,浆液中的阳离子Na+透过阳离子交换膜到阴极室形成NaOH.
点评
本题重点考查了溶液中相关离子浓度变化及移动方向,体现了离子交换膜在物质分离提纯方面的重要应用.易错点是含铬微粒除了还有.亮点是把电化学内容和化学平衡知识有机结合.
高考真题是高三复习备考的重要参考和导向.由以上内容分析可知,电化学试题呈现出一定的规律性:1)试题立意源于真实情境;2)试题设问形式灵活多样;3)试题内容重视基本原理和基础知识;4)试题评价目标指向核心素养.
基于此,复习时建议教师重点强调以下原理知识及答题技巧:1)增强识图、析图、判别装置类型的能力;2)熟练掌握:阳(或负)极→元素化合价升高→失去电子→发生氧化反应,阴(或正)极→元素化合价降低→得到电子→发生还原反应;3)根据电极材料、放电顺序、电解质溶液的酸碱性等条件,准确书写电极反应式;4)根据交换膜的类型,判断电解质溶液中离子定向移动的方向;5)构建知识模型,建立思维框架,提升运用模型解决问题的能力.

