甲状腺乳头状癌合并甲状腺良性疾病的临床病理分析
黄沛丹,甘枭雄,沈飞,叶潍,冯键华,蔡文松,徐波
(广州医科大学附属广州市第一人民医院 甲状腺外科,广东 广州 510000)
0 引言
近20年,世界各地的甲状腺癌(Thyroid carcinoma,TC)的发生率均呈持续升高趋势发展。在分化型TC中,PTC此亚型的预后最佳,此型TC发病率的上升速度也最高,其中微小乳头状癌的发生率增速更快。现已在此病发病率上调的确切原因与机制方面依然未达成共识。现今通常认为是,甲状腺超声以及细针穿刺活检技术(FNAB)的出现与应用,使得较小肿瘤(直径在2cm以下)的测定率有所提升。另一原因则为,所切除的甲状腺良性病灶标本内偶发直径在1cm以下的微小癌被发现的概率提高。[1]尸检报告显示,人群内10%-30%者机体内含偶发微小癌,此数据对于上述理论也给予了证实。通过更为深入地分析TC发病率可知,自1983年到2006年此阶段内,微小癌发病率虽然每 年升高19.3%,但1~2cm、2~5cm、大于5cm这3类肿瘤直径的TC同期发病率的每年增幅依次是12.3%、10.3%与12.0%。如此可见,对于PTC的快速增长,微小癌肿瘤的检出率无充分解释价值[2]。此外,PTC合并诸如NG、HT与格雷夫斯病(GD)等其它良性甲状腺疾病的现象也明显增加,表明TC的发生同其它甲状腺疾病可能有着某种相关性。所以,此次研究围绕PTC、PTCNG、PTC-HT的临床病理与预后,展开对比分析,以此促进认知PTC水平的提升,进而在理论层面上给予实验研究、临床诊治以借鉴。
1 资料与方法
1.1 一般资料
本研究回顾2016年4月到2019年6月广州医科大学附属广州市第一人民医院甲状腺外科诊治过396例PTC患者。病例收集的全部流程都符合广州市第一人民医院伦理委员会的标准,并且所有的患者都签署研究知情同意书。纳入标准:(1)年龄在18~80岁;(2)初次行甲状腺切除+中央淋巴结清扫,并且经病理明确诊断为PTC、PTC-HT及PTC-NG病例;(3)所有患者术后常规应用左旋甲状腺素抑制治疗。排除标准:(1)术后经病理证实合并有其他恶性肿瘤的患者;(2)排除未行手术治疗,因肿瘤再次复发术后的患者;(3)有放射线接触史和其他恶性肿瘤家族史的患者;(4)有原发性甲状腺功能亢进、免疫缺陷性疾病、慢性感染性疾病的患者。纳入符合条件的病例396例(PTC:264例,PTC-HT:66例,PTC-NG:66例)做一步分析。
1.2 数据分析
采用SPSS 22.0版(SPSS Inc,Chicago,IL,USA)进行统计分析。计量资料以Mean±SD表示,频数用于描述分类数值变量。采用卡方检验和Fisher精确检验比较组间差异。采用回顾性分析的研究方法,比较3组在临床病理特点(流行病学、病理分期、淋巴结转移、包膜侵犯、多病灶发生率、肿瘤直径、实验室检查等)、临床分期以及分化型甲状腺癌(Differentiated thyroid carcinoma,DTC)预后复发危险度的等多方面的区别。
2 研究结果
2.1 性别与年龄特点
PTC合并HT组较PTC组女性患病率较高。PTC合并NG组较PTC组发病年龄偏大,统计结果见表1。

表1 PTC与PTC合并良性疾病流行病学的比较
2.2 实验室检查
术前甲功水平:PTC-HT组对比PTC组,TSH(4.04±3.17)uIU/mL VS(2.76±1.76)uIU/mL,TPOAb(94.31±112.63)IU/mL VS(33.65±53.88)IU/mL,PTC-HT组的甲状腺相关激素表达水平显著高于PTC组,见表2。
2.3 临床病理特征比较
PTC合 并HT组 较PTC组(1.10±0.59cm vs 1.31±1.04cm)肿瘤直径更小,组间差异有统计学意义(P<0.05),见表3。PTC合并NG组较PTC组(13/64对比100/263)多灶癌占比低,组间差异有统计学意义(P<0.05),见表4。
2.4 TNM分期比较
对比单纯PTC组,PTC-HT组肿瘤直径更小,微小癌占比高。PTC-NG组较单纯PTC组中多灶癌占比更低,详见表5。
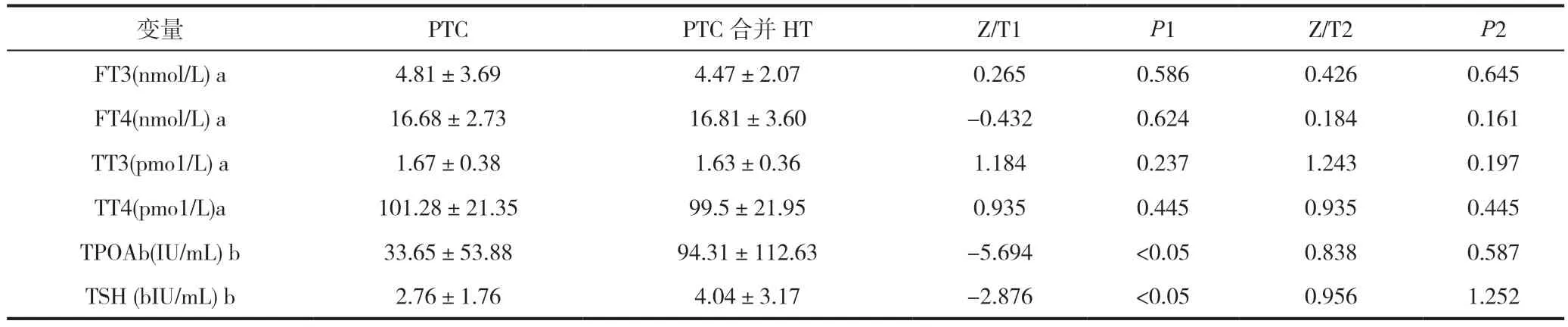
表2 PTC与PTC合并良性疾病实验室数据比较

表3 PTC与PTC合并HT的临床病理特征比较

表4 PTC与PTC合并NG临床病理特征比较表

表5 PTC与PTC合并良性疾病TNM分期比较
2.5 AJCC分期
对比单纯PTC组、PTC合并HT组在AJCC分期中早期(1、2期)占比高,但组间差异无统计学意义(t=1.013,P>0.05),PTC合并NG组在AJCC分期上对比单纯PTC组无统计学差异。3组PTC在AJCC分期中无明显统计学差异,见表6。
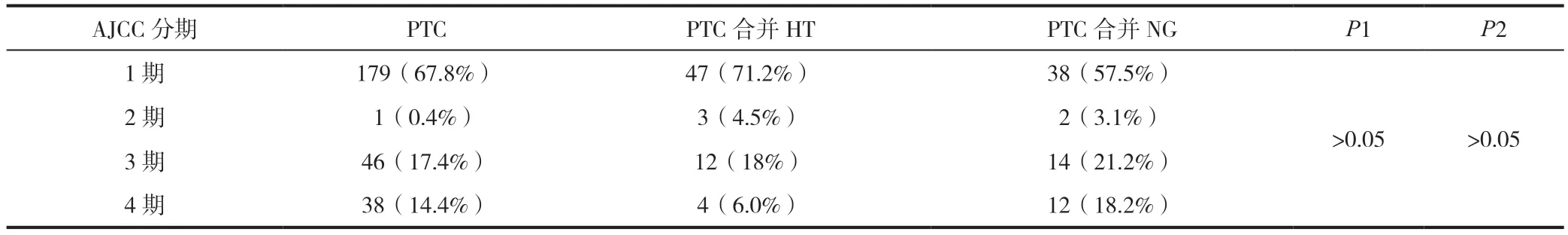
表6 PTC与PTC合并良性疾病AJCC分期比较
2.6 预后、危险分层评估
在基于DTC危险分层(Recurrence risk staging)对 PTC 患者进行风险分级及预后评估中,PTC合并HT组患者(65例)在低风险组30例(46.1%)。中度风险33例(50%),高风险组2例(3.0%)。复发5例(7.6%)。单纯PTC组患者(252例)在低风险组69例(27.4%))。中度风险133例(52.7%)高风险组50例(19.8%),复发19例(18.9%)。PTC合并NG组患者(60例)在 低风险组28例(46.6%)。中度风险22例(36%)高风险组10例(16.0%)。复发3例(5%)。在基于DTC危险分层对 PTC 患者进行风险分级及预后评估中,对比PTC组,PTCHT、PTC-NG组预后及风险评估更好,两组间差异有统计学意义。详见表7、表8。

表7 PTC与PTC合并良性疾病(HT)预后、危险分层评估比较

表8 PTC与PTC合并良性疾病(NG)预后、危险分层评估比较
3 讨论
3.1 PTC的现况分析
PTC是TC存在最为广泛的一类肿瘤,在TC中的占比约50%~90%。这些年,因体检与临床领域中甲状腺超声检查技术的大量推行,相比20世纪80年代,PTC的检出率与发病率皆大幅提升。通过某项针对美国9个区域所开展的多中心RCT(随机对照临床试验),Davies等[3]发现,1975年,PTC的发病率为3.4/10万,待发展至2009年,此数值升高至14.3/10万,历经从1975年至2009年这30多年,此病发生率提高了约3倍。此外,在某项于墨西哥开展的临床研究中,Albores-Saavedra 等[4]发现,在PTC发病率方面,相比20世纪80年代,现今提高了约2倍。
甲状腺滤泡细胞为PTC的分化来源,其临床症状主要有:甲状腺淋巴结肿大以及无痛性甲状腺肿块,肿块质地较硬,通常呈圆状,同时仅会发生于单侧甲状腺组织。在TC的4类病理分型中,PTC的恶性程度最低,病程发展速度比较慢,能够获得相对较好的预后。有研究结果表明,在10年生存率方面,PTC超过了90%。此病通常被发现于体检时,同时受到甲状腺超声的进步与此项技术在体检中的普遍推行,这些年PTC检出率大幅提升。然而,因此病在临床症状方面缺乏典型性,一些病人确诊时就已经出现了淋巴结转移现象。国内研究人员发现,年份增加的同时,合并NG以及合并HT的TC数量均大幅提升,而合并其它类型TC则表现为一定程度的降低[5]。相关研究发现,在同期TC患者总量中,TC-NG的占比是11.11%~36.9%,TC-HT的占比是7.4%~28.57%。因此,围绕PTC、PTC-NG与PTCHT三者的临床病理表现、流行病学、预后因素开展回顾性分析,对外科医生更为充分地认知3类乳头状癌的特征有所帮助,由此利于科学诊疗措施与手术方案的制定,从而促进病人疗效的提升。
3.2 PTC对比PTC合并HT的临床病理特征分析
现今认为HT同遗传变异导致的易感性与环境因素相关。Daiiey 等研究者率先提出了TC-HT,然而这两类疾病间的关联性始终未达成共识。有研究发现,TC-HT 的发病率达8.49%,同时表现为逐年递增式发展,在TC-HT中,PTC-HT为94.33%占比[6]。HT和PTC病人的无病生存率(DFS)与总体生存率(OS)存在正向相关性[7],PTC-HT,相较于单纯PTC,大多存在以下表现:多发生于女性群体中,癌灶直径均值偏小,不易复发,较少出现淋巴结转移、甲状腺外转移与包膜侵犯,且临床分期较早等特点[8],然而也有研究结果显示,HT不影响PTC 癌灶的组织病理学结果、FNAB结果、超声特征,如甲状腺外转移发生率、包膜侵犯发生率不存在差异[9-10]。有研究人员认为通过对甲状腺外科手术病例进行回顾分析,来对双方的相关性进行求证存在选择偏倚,双方间的相关性,依然应通过大量的前瞻性随访研究提供证据[11]。此次研究中,PTC-HT在乳头状癌中占比为16.6%,接近于国外报道(23.2%)[11]。此次研究中,PTC-HT病人中,女性与男性之比为2.7:1左右,在单纯PTC中,这两性之比为1.4:1,前者明显高于后者,差异具备统计学价值,相符于既往研究[12],这可能同女性更易患HT有关。两者相比,PTC-HT平均发病年龄小、多灶癌比例高、包膜侵犯率低、淋巴结转移率低,同大部分研究结果相同,然而差异不具备统计学价值。判断同此次研究初期肿瘤病人占比较高存在一定联系。由此提示,临床工作中需加大多对HT病人的随访力度,特别是女性病人,做到对TSH的及时抑制。PTC-HT的病机可能为[6,13-15]:1)HT是TC的癌前病变。在高水平的TSH长期刺激下,滤泡上皮增殖,引发癌变;2)双方的病因相同,主要包括免疫缺陷、基因过表达或表达异常、内分泌功能紊乱、高碘、辐射;3)TC会导致甲状腺实质发生淋巴细胞周围浸润,从而促发HT。此次研究结果显示,在血TSH水平方面,PTC、PTC-HT分别是2.76±1.76 uIU/mL、4.04±3.17 uIU/mL,后者较高,且表现出显著差异。对癌前病变学说给予了证实,此结果相符于文献报道的研究结果[16]。在血 TPO-Ab水平方面,单纯PTC、PTC-HT分别为2.76±1.76 IU/mL、4.04±3.17 IU/mL,后者明显较高,TPO-Ab水平上调同自身免疫机能失衡存在联系,所以,此次研究同样证实了共同病因学说,相符于文献报道结果。
3.3 PTC对比PTC合并NG的临床病理特征分析
有研究人员提出,NG为TC的癌前病变。因TSH分泌提升,导致甲状腺中多处滤泡上皮的增殖,新生滤泡上皮不同于复旧上皮由此慢慢导致NG的产生。基于此,如果甲状腺滤泡上皮增殖的同时产生新生血管与乳头状增生[17],那么乳头状增生存在发展为乳头状癌的几率。但是,是否能够将NG当做TC发生的风险因子,依然需要更进一步的研究来证实。大部分研究人员提出,NG同PTC存在一定相关性,当NG 中TSH信号途径发生突变时,不同的滤泡细胞对TSH 反应存在差异性,由此造成增殖率方面的不同,引发NG的恶变[18-19],对于NG与分化型TC的发病,TSH长期刺激发挥着关键性作用。近些年,NG发生恶变或者合并TC的发病率不断升高,研究证实,年龄偏大与病史较长的NG病人合并TC的几率更高,其主要病理类型是PTC,此类型的占比达92.2%~95.7%。国内相关研究发现,NG合并TC具备PTC多见、不易淋巴结转移、癌灶小的特征[20-21]。此次研究中,在平均发病年龄方面,单纯PTC、PTCNG分别为(45.80±16.1)、(53.45±18.5),后者较高;在多灶癌方面,单纯PTC、PTC-NG分别是100(41%)、13(20%),后者较低,差异具备统计学价值。对比单纯PTC,PTC-NG淋巴结转移率低(24%vs 18%)、肿瘤最大直径较小(1.31±1.04cm vs 1.22±0.59cm),然而差异不具备统计学价值,考虑同此次研究中多数研究对象为PTC早期病人有关。针对年龄较大,以及TG-Ab、TPO-Ab水平较高的NG病人,临床领域需增强警惕性,严密关注,降低漏诊、误诊概率,实现诊断、治疗的及时进行,使病人预后得到改善。由于大多是单灶癌,进行手术时,需重视此类疾病的特殊性,对术式做出合理选择,防止过度手术的发生。
当前仅有少量研究涉及PTC-HT和PTC-NG临床表现对比分析。此次研究获得以下结果:在女性发病率方面,PTC-HT(72.7%)高于PTC-NG(62.1%);在平均发病年龄方面,PTC-HT(45.23±15.3岁)低于PTC-NG(53.45±18.5岁);在AJCC方面,PTC-HT偏早,其Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ的例数与占比依次是47(71.2%)、3(4.5%)、12(18%)、4(6.0%);PTC-NG组上述4期的例数与占比则依次是38(57.5%)、2(3.1%)、14(21.2%)、12(18.2%)。在多灶癌所占比例方面,PTC-HT[21(31.8%)]高于PTC-NG[19(28.8%)];在血中TSH水平方面,PTC-HT(4.04±3.17 uIU/mL)高于PTC-NG(2.58±1.58 uIU/mL);在血内TPO-Ab水平上,PTC-HT(94.31±112.63 IU/mL)高于PTC-NG(34.65±47.65 IU/mL),差异具备统计学价值。临床中,针对HT病人,尤其年轻女性,需增大随访力度,尽早开展TSH抑制干预,发现癌变,采取手术干预时,需认识到相较于PTC-NG病人,此类病人更易发生多灶癌、双侧癌,对术式进行合理选择,通常可得到较好预后。针对年龄稍高的 NG病人,需增大随访力度,若疑似癌变,应尽早采取根治性手术干预。
3.4 PTC对比PTC合并其他良性疾病的复发风险分析
在DTC复发率风险等级评估方面,其参考术中病理特征如肿瘤数量和大小、病灶残留、病理亚型、淋巴结外侵和转移、包膜血管侵犯、分子病理特征、术后刺激性Tg水平等因素,可把患者复发风险划分成3层,分别为低危型、中危型与高危型。针对高危型DTC,极力提倡术后行辅助治疗;针对中危型,可采取辅助干预;对于低危型,通常无需清甲干预,然而应采取内分泌干预。PTC此恶性肿瘤分化良好,恶性程度不高,存在较高10年生存率,然而疾病初期可合并颈部淋巴结转移,通常认为中央区淋巴结为甲状腺恶性肿瘤转移的首个场所[20]。然而临床方面大多认为PTC可实现较好预后,因此,在手术进行时需采取中央区淋巴结清扫处理与否尚未达成共识。一些研究人员提出,术中实施中央区淋巴结清扫处理,可导致阴性病人术后并发症发生率提高。现今针对PTC的术式,临床领域尚缺乏统一标准,全球大部分研究人员基本形成下述共识:(1)不能应用小于一叶的术式;(2)存在高危因素、两侧肿瘤病人,应采取近全切术或者全切术治疗[22]。大部分研究人员对预防性颈部淋巴结廓清除的实施持否定意见[23]。然而对于临床淋巴结阴性病人,需采取淋巴结清扫术治疗与否有不同意见[24]。近些年,基于前哨淋巴结和淋巴结转移特征的研究结果,一些研究人员也提出,手术进行时,可对中央组淋巴结实施冰冻病理检查,若显示阴性,那么无需清扫,若显示阳性,应实施清扫术。基于此次研究复发风险分析结果,在PTC-HT组65例病人中,高、中、度低风险的例数依次是2例(3.0%)、33例(50%)、30例(46.1%)。另有5例复发,为7.6%占比。在单纯PTC 组的252例病人中,高、中、度低风险的例数依次是50例(19.8%)、133例(52.7%)、69例(27.4%),另有19例复发,为18.9%占比。前者的风险分级较低,表现出显著差别。在PTC-NG组60例病人中,高、中、度低风险的例数依次是10例(16.0%)、22例(36%)、28例(46.6%),另有3例复发,为5%占比,相较上述单纯PTC 组的252例病人,表现出较低的风险分级,且存在显著差别。此次研究表明,在PTC-NG组中,84.8%的病人颈部淋巴结转移在5个以下,预后风险等级中,低风险型为较高占比,达46.6%。对于PTC-HT病人而言,78.7%者的颈部淋巴结转移在5个以下,预后风险等级方面,低风险型为较高占比,达46.1%。预防性中央区淋巴结清扫处理的盲目实施,有过度治疗可能。在对PTC手术区域进行明确方面,应谨慎面对,基于此次研究相关经验认为,合并不同良性疾病的PTC各有其特点,针对不同PTC病人,应基于其高危因素,术前FNAB结果、颈部高频彩超或CT强化薄层扫描结果、侧颈部位淋巴结活检与冰冻结果、术中纳米炭淋巴结示踪表现等进行全面分析,对颈部淋巴结清扫区域进行初步设定。为患者实施个性化的治疗方案。
综上所述,相较于单纯PTC,PTC合并不同良性病变在临床特征上有所区别。PTC-HT更多发于女性,且TPOAb、TSH水平较高,肿瘤直径较小;PTC-NG发病年龄偏大,好发于55岁以上人群,且此群体不易出现多灶癌,癌灶大多出现在单侧叶腺体内。对比单纯PTC,上述两者复发率相对较低。

