CRISPR-Cas13a抑制RNA病毒的多靶标基因编辑技术构建
解屹 徐翔 葛明 张万红 黄坤 江连强 赵世民 王玉洁 彭子忠 廖成 杨金广 王凤龙







摘 要:CRISPR-Cas适应性免疫系统为细菌和古细菌免受外来核酸和噬菌体的侵害提供了保护。其中2类VI-A型CRISPR-Cas效应子Cas13a(之前称为C2c2),可受CRISPR RNA的引导,靶向切割与原始间隔区反向互补的单链RNA。本研究利用CRISPR-Lsh-Cas13a系统,多靶标编辑烟草花叶病毒(TMV)RdRP、MP和CP基因,以抑制病毒在寄主烟草体内的侵染与扩散,从而达到保护寄主的作用。该系统在瞬时表达测定中表现出对野生型TMV-U1和表达绿色荧光蛋白的TMV-30b的干扰以及对病毒累积和病毒病症状的抑制。靶向TMV RdRP基因的CRISPR RNA表现出比靶向MP和CP基因更好的编辑效能。经过适当设计的CRISPR-Lsh-Cas13a系统被赋予了广谱抗性,可以特异性编辑多种TMV菌株。研究表明,CRISPR-Cas13a系统可以用于针对RNA病毒的抑制干扰。
关键词:基因编辑;CRISPR-Cas13a;烟草花叶病毒;病毒防控;多靶标编辑
Abstract: The CRISPR-Cas adaptive immune system provides protection for bacteria and archaea from foreign nucleic acids and bacteriophages. In the CRISPR-Cas adaptive immune system, two classes of the VI-A CRISPR-Cas effector Cas13a (previously called C2c2) can be guided by CRISPR RNA to target and then cut the single-stranded RNA that is reversely complementary to the protospacers. In this study, the CRISPR-Lsh-Cas13a system was used for the multi-target editing of RdRP, MP, and CP genes of Tobacco mosaic virus (TMV) to protect the host from infection and spread of the virus. This system showed interference with wild-type TMV-U1 and TMV-30b expressing green fluorescent proteins in transient expression assays, as well as suppression of virus accumulation and viral disease symptoms. The CRISPR RNA targeting TMV RdRP gene showed better editing efficiency than that targeting MP and CP genes. The appropriately designed CRISPR-Lsh-Cas13a system was endowed with broad-spectrum resistance and can specifically edit a variety of TMV strains. This study showed that the CRISPR-Cas13a system can be used for the suppression and interference against RNA viruses.
Keywords: gene editing; CRISPR-Cas13a; tobacco mosaic virus; virus prevention and control; multi-target editing
植物RNA病毒种类繁多,其中最具代表性的烟草花叶病毒TMV(Tobacco mosaic virus)富有极强的侵染性、抗逆性和危害性,寄主范围十分广泛,可侵染150余属350余种植物[1],包括烟草、番茄、马铃薯、菠菜等多种作物。一旦发病会造成大规模扩散感染,导致作物产量、品质严重下降,从而造成严重的经济损失[2]。据报道,世界各地每年因TMV侵染作物造成的经济损失超过1亿美元[3]。TMV可从微伤口处侵染寄主。发病初期,寄主新叶叶脉及周围叶肉组织出现半透明明脉症状;进而病毒持续复制增殖,严重干扰寄主自身细胞分裂,导致叶片厚薄不均、畸形、皱缩,并呈现典型的花叶症状,植株也随之生长迟缓,呈现矮化、节间缩短等症状,侵染严重的植株逐渐坏死凋亡。TMV基因组为一条线性正义ssRNA,全长约6395个核苷酸,病毒质粒为大小约300 nm×18 nm的杆状体,拥有4个开放式阅读框(ORF)[4],分别编码相对分子质量为126、183 kDa的复制酶,17.5 kDa的外壳蛋白以及30 kDa的运动蛋白[5]。
针对TMV的常规防治措施常存在见效慢、防治效果低、经济成本高、不具广谱抗性等弊端,且化学药剂的使用极易引起农残超标、病毒变异加速等问题。因此,亟需开发高效、环保、具备广谱抗性的病毒防治技术以应对这一世界农业难题。近年来随着基因编辑技术的兴起与发展,人们发现利用基因编辑技术可以针对植物病毒基因组特定基因进行高效修饰与改造,抑制植物病毒在寄主體内的扩繁与侵害,从而达到高效、经济、环保防控病毒病的目的。随着对于各项基因编辑技术的筛选与淘汰,CRISPR-Cas系统逐渐被人们熟知与接受。
簇状规则间隔的短回文重复序列与相关联的Cas蛋白组成的CRISPR-Cas适应性免疫系统可在分子水平上为细菌和古细菌抵抗核酸和噬菌体等外来遗传因素的侵害,提供自身免疫保护能力。建立这种适应性免疫反应需要3个步骤:1.适应,CRISPR阵列会摄取入侵遗传因素基因组并整合至自身,形成间隔区;2. CRISPR RNA(crRNA)的加工和生物发生,在转录CRISPR阵列后生成的前crRNA可被Cas核酸内切酶加工形成成熟的crRNA,成熟crRNA可与Cas蛋白结合形成“效应子”复合物,组成完整的CRISPR-Cas适应性免疫系统;3.对入侵遗传因素的干扰,入侵者基因组一旦与crRNA间隔区存在足够的碱基对互补性,互补区域就被视为靶标区域,crRNA牵引Cas蛋白至靶标区域,利用Cas蛋白的核酸酶性质,对目的核酸进行裂解,从而完成对细菌或古细菌的免疫保护工作。已有大量研究发现,通过人为适当地设计crRNA,CRISPR-Cas9系统可以切割病毒基因组的双链DNA,并赋予植物对该病毒的高效抗性。关于CRISPR-Cas系统新领域开发方向更多地转向RNA编辑,以期为植物RNA病毒的防治研究提供更多的实验依据。二类VI型CRISPR-Cas13系统是迄今为止于CRISPR家族中发现的仅靶向于ssRNA的系统[6],根据自身结构差异可分为Type VI-A、Type VI-B、Type VI-C和Type VI-D 4个亚型,其中以A亚型CRISPR-Cas13a研究居多。
CRISPR-Cas13a系统自发现、提出至今,已在植物分子抗病虫害领域得到广泛应用。但在烟草防控植物病毒方面,关于该系统定向降解侵染病毒基因组以抑制病毒侵染危害的研究尚且较少。AMAN[7]和SHARMA[8]等分别于2018年和2021年,通过在本氏烟中表达CRISPR-Cas13a系统以验证其对外侵芜菁花叶病毒(Turnip mosaic virus,TuMV)的干扰效果。两项试验结果均表明,CRISPR-Cas13a系统可以通过靶向降解病毒基因组,抑制病毒在寄主体内的侵染与繁殖,一定程度实现对病毒积累的负调控作用。本研究基于明确CRISPR-Cas13a系统定向编辑RNA机制,构建了可用于多靶标编辑TMV基因组的新型CRISPR-Lsh-Cas13a表達载体,验证该系统针对TMV的基因编辑效能与抑制成效,以期为植物RNA病毒的防治提供科学、可靠的科学理论依据。
1 材料与方法
1.1 试验材料
供试烟草品种为本氏烟草(Nicotiana benthamiana)和枯斑三生烟(Nicotiana tabacum var. Samsun NN)。播种发芽后移栽至盛有营养基质土的一次性塑料杯中,培养于昼夜周期为16 h/8 h、相对湿度60%、光合有效辐射为100 μmol/(m2·s)的人工气候室中。TMV-U1、TMV 30b毒源由本实验室保存并提供,Lsh-Cas13a表达载体由湖北大学生命科学学院提供[9]。
1.2 CRISPR-Cas13a新型表达载体构建
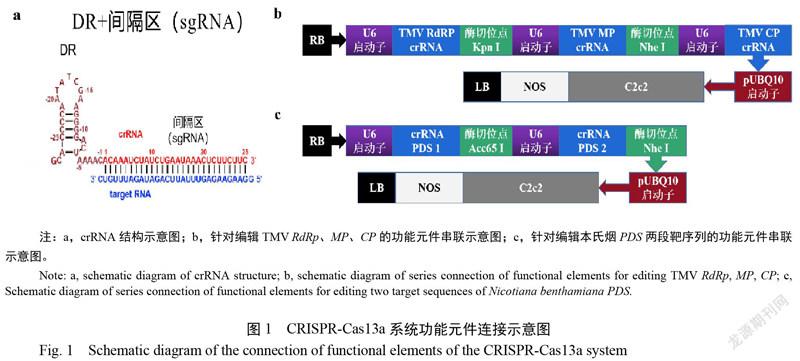
NCBI Genbank搜集38种不同株系TMV RdRP、MP、CP基因,利用DNAMAN软件筛选各基因保守序列,结合原始间隔区核苷酸识别偏好性原则(sgRNA对于靶位点3'相邻的首个核苷酸表现出对A,U或C的严格偏好而不是G,靶位点侧翼存在G核苷酸时会显著降低HEPN核酸酶活性,而A,U和C会导致HEPN核酸酶发挥最大活性),于筛选的保守序列区域选取28 nt靶基因序列,将其反向互补得到sgRNA。crRNA DR区域茎环结构,选择9-nt为其环,序列设计为AATATCGAA;5个Watson-Crick碱基对为其茎,序列设计为ACCCC/GGGGU。茎上的2-nt凸起选择AC,插于茎的3'核苷酸GU之间;茎环结构上游5'单链区只设置一个胞嘧啶(C),下游设置5 nt 3'单链区,序列设计为AAAAC;在间隔区3'添加oligo (A) rich tails作为核出口的信号,以及RNA pol III终止子TTTTTT。综上,将序列按照茎环5'侧翼单链、茎环结构、茎环3'侧翼单链、sgRNA的先后顺序依次组装成完整的crRNA,选用U6启动子启动转录。将3个“U6+crRNA”序列串联,基于Cas13a表达载体pLsh-Cas13a酶切位点Sac II于串联序列两端添加相应“同源臂”序列,送往山东赛恩斯科技有限公司合成。合成序列采用一步克隆法连接至pLsh-Cas13a载体,得到基因编辑重组载体pLsh-Cas13a-TMV。重组载体转化至大肠杆菌感受态细胞DH5α(TransGen Biotech)。挑取单克隆,测序,阳性克隆转化至农杆菌感受态细胞 LBA4404(TransGen Biotech)。本试验引物合成及测序均由派森诺生物科技有限公司完成。阳性对照试验所用载体pLsh-Cas13a-PDS(针对编辑本氏烟PDS基因)构建方法同上。本方法所用引物详见表1。
1.3 试验设计
1.3.1 本氏烟、枯斑三生烟重组载体瞬时表达 挑取农杆菌单克隆接种至含有kana、利福平的液体LB培养基,28 ℃ 200 r/min恒温振荡培养箱培养48~72 h。农杆菌菌液1500 g离心5 min,弃去上清。重悬沉淀菌体至OD600=0.8,黑暗静置3 h。利用无菌注射器将pLsh-Cas13a-TMV重悬菌液缓慢注入4周龄的本氏烟、枯斑三生烟背面,作为处理组叶片,并设置4个技术重复;将pLsh-Cas13a(质粒载体上无crRNA)重悬菌液缓慢注入本氏烟、枯斑三生烟处理组叶片下方第一片叶片中,作为阴性对照组叶片,并设置4个技术重复;将pLsh-Cas13a-PDS、pLsh-Cas13a重悬菌液缓慢注入4周龄本氏烟叶片,作为阳性对照组叶片,设置3个技术重复。试验组所有材料均培养于人工气候室中。
1.3.2 机械摩擦接毒 农杆菌转化后第3天,取1 g野生型TMV-U1毒源叶片,1 g TMV-30b毒源叶片,置于灭菌的研钵中,加入80 mL PBS缓冲液(pH 6.8)研磨成浆,纱布过滤除去叶片残渣获得悬浮液进行病毒机械摩擦接种。利用棉棒将TMV-30b悬浮液轻轻涂抹于撒有石英砂的本氏烟处理组、阴性对照组叶片正面,将野生型TMV-U1悬浮液轻轻涂抹于撒有石英砂的枯斑三生烟正面,接毒植株置于人工气候室光照培养。
1.3.3 病毒生物学测定 本氏烟试验组机械摩擦接毒后第5天,紫外(UV)光下统计处理组、阴性对照组接毒叶片中绿色荧光蛋白信号强度(点数或面积),对比数据估测CRISPR-Lsh-Cas13a系统基因编辑效能。枯斑三生烟机械摩擦接毒后第3天,统计处理组、阴性对照组接毒叶片枯斑数量,对比数据估测CRISPR-Lsh-Cas13a系统基因编辑效能。
1.3.4 相对荧光定量PCR(qRT-PCR)检测分析 采用TRIzol法提取处理组、阴性对照组叶片总RNA,HiScriptII Q Select RT SuperMix for qPCR(Vazyme)反转录,合成cDNA。以各样品cDNA为模板,本氏烟actin为内参基因,参照AceQ qPCR SYBR® Green Master Mix(Vazyme)试剂盒说明配置反应体系,置于Applied Biosystems 7500 Real-Time PCR system进行qRT-PCR反应,反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 30 s,60 ℃ 1 min,95 ℃ 15 s。采用2-ΔΔCt法计算基因相对表达量,独立样本T检验法进行数据差异性检验分析。本方法所用定量检测引物详见表1。
1.3.5 蛋白质印迹法(Western Blot)分析 采集枯斑三生烟处理组、阴性对照组叶片,液氮速冻后置于液氮预冷的研钵研磨至粉末。取1 g研磨物装于液氮预冷的洁净离心管中,加入1 mL事先预冷的蛋白裂解液(北京康为世纪生物科技有限公司),上下翻转混匀,冰面静置30 min,低温离心15 min,吸取上清液至另一液氮预冷离心管,得到植物总蛋白。通过SDS-PAGE电泳和100 V湿法转膜90 min,将聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)先置于含5%牛血清蛋白的TBST中封闭1 h,再置于含有TMV抗体和actin抗体缓冲液中,4 ℃孵育过夜。次日将PVDF膜置于二抗缓冲液中室温孵育1 h,放入凝胶成像仪载物台,加入化学发光液,发光成像。
2 結 果
2.1 CRISPR-Cas13a表达载体构建与功能验证
2.1.1 靶序列选取、串联序列及重组载体获得 本研究选取TMV基因组序列第941位至968位碱基(28个)、第5227位至5254位碱基(28个)、第5991至6018位碱基(28个)分别作为编辑TMV RdRp、MP、CP的靶序列,选取本氏烟PDS表达基因序列第356位至383位碱基(28个)、第557位至第584位碱基(28个)作为编辑PDS的靶序列。按照设计方案完成crRNA组装与crRNA序列串联(图1 a-c),pLsh-Cas13a-TMV和pLsh-Cas13a-PDS质粒图谱(图2 a-b)如下。本载体选用可以加强基因表达的pUBQ 10启动子高效表达Lsh-Cas13a蛋白,载体抗性基因为卡那霉素抗性基因。
2.1.2 重组载体构建验证与分析 对两个重组载体crRNA进行PCR测序分析。结果如下图(图3 a-e),5个crRNA碱基测序结果与设计一致,峰图未出现双峰情况,证明两段串联序列准确连接至pLsh-Cas13a,pLsh-Cas13a-TMV与pLsh-Cas13a-PDS构建成功。对将pLsh-Cas13a-TMV、pLsh-Cas13a-PDS、pLsh-Cas13a导入的大肠杆菌菌液进行菌液PCR测试,琼脂糖凝胶电泳条带(图3 f)与预期大小一致,分别为1320、1037和4953 bp,表明3种质粒均已成功导入,可用于后续试验。
2.1.3 重组载体功能验证与分析 本试验设置阳性对照组,选择本氏烟基因组中PDS表达基因作为CRISPR-Lsh-Cas13a基因编辑系统的目的基因进行编辑,观察是否有白化或类白化现象发生,作为载体功能正常性依据。阳性对照组叶片瞬时表达pLsh-Cas13a-PDS、pLsh-Cas13a后第7天观察处理叶片的形态变化,如图4所示,瞬时表达pLsh-Cas13a-PDS的处理叶片不同程度出现类白化现象,而瞬时表达pLsh-Cas13a的对照叶片未出现白化或类白化现象。上述试验结果证明重组载体功能正常。
2.2 本氏烟、枯斑三生烟试验组病毒生物学测定
如图5 a-b所示,本氏烟处理组样品接毒叶片中的绿色荧光蛋白信号强度远远小于阴性对照组样品接毒叶片。据统计,处理组4个接毒叶片与阴性对照组4个接毒叶片的绿色荧光蛋白信号比值约为1:10.44,差异显著(p<0.05)。如图5 c-f所示,枯斑三生烟处理组样品接毒叶片正、背两面枯斑数量远远小于阴性对照组样品接毒叶片正、背两面的枯斑数量。据统计,处理组4个接毒叶片与阴性对照组4个接毒叶片的枯斑数量比值约为1∶11,差异显著(p<0.05)。
上述结果表明,在叶片中瞬时表达CRISPR-Lsh-Cas13a基因编辑系统的处理组样品对于TMV的抑制效率远远高于仅表达Lsh-Cas13a蛋白的阴性对照组样品,证明CRISPR-Lsh-Cas13a基因编辑系统能够起到良好的TMV抑制效率,也说明Cas13a蛋白只有依赖于crRNA才能发挥其核酸内切酶活性。
2.3 qRT-PCR病毒基因水平检测及分析
为进一步证实CRISPR-Lsh-Cas13a基因编辑系统可以有效抑制TMV在寄主体内的侵染,利用qRT-PCR对本氏烟、枯斑三生烟两试验组接毒叶片中的病毒基因相对表达量进行测定。结果如图6-7所示。本氏烟试验组,相比于阴性对照组4个接毒叶片中TMV-30b CP基因的表达量(阴性对照值设为1),处理组4个接毒叶片中TMV-30b CP相对表达量约为0.134 4,差异极显著(p<0.01),可见CRISPR-Lsh-Cas13a系统针对TMV-30b抑制效率为86.56%。枯斑三生烟试验组,相比于阴性对照组4个接毒叶片中TMV-U1 RdRp基因、MP基因和CP基因的表达量(阴性对照值均设为1),处理组4个接毒叶片中TMV-U1 RdRp、MP和CP基因的相对表达量分别约为0.049 6、0.097 1和0.136 2,差异分别为极显著(p<0.01)、显著(p<0.05)和显著(p<0.05),可见CRISPR-Lsh-Cas13a系统针对TMV-U1抑制效率为86.38%。
上述数据可明显体现CRISPR-Lsh-Cas13a系统对于病毒的抑制趋势,在叶片中瞬时表达CRISPR-Lsh-Cas13a系统的处理组样品可对TMV产生高效抑制作用,对TMV基因组的积累起到了显著负调控作用,从而实现自身针对TMV侵染与复制的抑制,保护自身免受病毒侵害。
2.4 Western Bolt蛋白水平验证与分析
Western Blot检测结果(图8)显示,接毒3 d后,枯斑三生烟处理组叶片与阴性对照组叶片中均检测到TMV,但处理组叶片TMV蛋白含量明显少于阴性对照组叶片。此数据可辅证2.2、2.3结果。
3 讨 论
自适应免疫CRISPR-Cas系统已被用作包括植物在内各种系统的强大基因组编程工具[10]。其中,CRISPR-Cas13系统初步应用于针对RNA病毒基因组的编辑工作。CRISPR-Cas13系统可以利用其sgRNA与病毒基因组目的基因具有同源性的特点与其特异性结合成为双链,crRNA引导具有核酸酶属性的Cas13蛋白移动至目的基因处,进行特异性切割、降解,从而达到针对病毒基因组进行编辑的目的,抑制其对于寄主的复制与侵染。与传统基因编辑技术(如ZFNs、TALENs等)相比,CRISPR-Cas13基因编辑技术操作性更简便,对于目的基因的编辑更为精准高效,脱靶率低,试验周期短且无物种限制,因此备受科学界的关注与认可。
本研究利用CRISPR-Lsh-Cas13a基因编辑系统针对TMV基因组的编辑效能及病毒抑制效果进行验证试验,结果表明,CRISPR-Lsh-Cas13a可以介导对TMV的分子干扰。靶向编辑、降解侵染本氏烟的TMV 30 b(携带GFP标签) CP基因可以导致GFP水平降低,从而在受侵叶片中检测到GFP信号减少;靶向编辑、降解侵染枯斑三生烟的野生型TMV不同基因组区域可以有效减少病毒含量,从而降低形成的枯斑数量。病毒生物学测定试验表明CRISPR-Lsh-Cas13a基因编辑系统具有编辑、降解和抑制植物寄主植物中TMV的作用。
在基因水平和蛋白水平上进一步验证了该系统对于TMV的编辑效能及抑制作用。两试验组中,处理组相较于阴性对照组,TMV各蛋白基因相对表达量均减少86%以上。Western Blot TMV蛋白检测结果显示,处理组叶片TMV蛋白含量明显少于阴性对照组叶片。基因相对定量及病毒蛋白含量测定数据表明,CRISPR-Lsh-Cas13a基因编辑系统可以高效编辑TMV基因组不同蛋白表达基因,有效抑制TMV在寄主中的复制与传播,这为工程化创制天然抗TMV转基因植株和抗性发挥提供了实验依据。
在验证试验中发现,靶向TMV RdRp基因的编辑效能最好,MP基因的编辑效能次之,对于CP基因的编辑效能相对最差。这表明,排除其他未被研究发现的因素外,靶标RNA内的二级结构或者RNA结合蛋白的存在或许会影响编辑系统的可及性,从而影响Lsh-Cas13a在靶标RNA上的活性,降低编辑效能。这一观察结果与Abudayyeh等[11]的研究结果相一致,他们在天然环境中表征了Lsh-Cas13a的活性,并发现最有效的crRNA位于强干扰区域,成簇状存在,且最靠近靶标RNA,这表明crRNA接近靶标RNA的难易程度确实会对Lsh-Cas13a的活性产生影响。此外,来自Cas13a家族的其他Cas13a同系物,例如Lwa-Cas13a,也表现出相同的现象[12]。这些研究表明,RNA靶位点的筛选和crRNA效率的研究探索可能对于Cas13a活性最大化以及CRISPR-Cas13a系统的编辑效能至关重要。此外,或存在其他机制制约CRISPR-Cas13a系统接近靶标及其效率发挥,仍需更多研究揭示这些潜在机制。目前可以通过不同方法来提升CRISPR-Cas13a系统对于植物病毒基因组的编辑效能,从而实现更高效的病毒防控力。例如本研究创新的病毒基因组多重靶标联合编辑方法,在更多区域内对植物病毒基因组实施干扰编辑,更大程度上抑制病毒在寄主体内的复制与传播;再者可以使用某些蛋白质稳定性融合物(例如msfGFP),其可与Cas13蛋白融合以增强稳定性和催化活性;也可以使用具有更强大的RNA引导核糖核酸酶活性的Cas13变体,降低靶标可及性带来的负面影响。
4 结 论
本研究利用CRISPR-Lsh-Cas13a基因編辑系统的作用机制,构建了可在烟草中稳定表达的CRISPR-Lsh-Cas13a功能载体,并于本氏烟和枯斑三生烟中实现了针对TMV的高水平抗性。其次利用多靶标编辑的概念,强化植物病毒的基因组编辑效能和抑制作用。此结果为更好地防控植物RNA病毒提供了理论支撑和科学依据。
参考文献
[1]许清孝. 烟草花叶病毒的检测方法研究进展[J]. 现代农业科技,2013(11):128-129.
XU Q X. Research progress on tobacco mosaic virus detection methods[J]. Modern Agricultural Science and Technology, 2013(11): 128-129.
[2]黄永山,谭海文. 烟草花叶病毒病的生物防治研究进展[J].中国农业信息,2013(14):25-27.
HUANG Y S, TAN H W. Research progress on the biological control of tobacco mosaic virus disease[J]. China Agricultural Information, 2013(14): 25-27.
[3]吴云峰,曹让,魏宁生,等. 生物病毒农药筛选及应用[J]. 世界农业,1995(5):35-36.
WU Y F, CAO R, WEI N S, et al. Screening and application of biological virus pesticides[J]. World Agriculture, 1995(5): 35-36.
[4]邵碧英,吴祖建,林奇英. 烟草花叶病毒复制酶介导抗性的研究进展[J]. 生物技术通讯,2003(5):416-418.
SHAO B Y, WU Z J, LIN Q Y. Research Progress in Tobacco Mosaic Virus Replicase Mediated Resistance[J]. Biotechnology Communications, 2003(5): 416-418.
[5]侯红琴,谭志琼,张振臣. 烟草花叶病毒属研究新进展[J]. 中国农学通报,2008(5):304-307.
HOU H Q, TAN Z Q, ZHANG Z C. New progress in tobacco mosaic virus genus[J]. Chinese Agricultural Science Bulletin, 2008(5):304-307.
[6]陈敏洁,唐桂月,洪香娜,等. 基于CRISPR-Cas13家族的RNA编辑系统及其最新进展[J]. 生物技术通报,2020,36(3):1-8.
CHEN M J, TANG G Y, HONG X N, et al. RNA editing system based on CRISPR-Cas13 family and its latest development[J]. Biotechnology Bulletin, 2020, 36(3): 1-8.
[7]AMAN R, MAHAS A, BUTT H, et al. Engineering RNA Virus Interference via the CRISPR/Cas13 Machinery in Arabidopsis[J]. Viruses. 2018, 10(12): 732.
[8]SHARMA V, ZHENG W G, HUANG J, et al. CRISPR-Cas RNA Targeting Using Transient Cas13a Expression in Nicotiana benthamiana[J]. Methods in molecular biology, 2021, 2170: 1-18.
[9]ZHAN X H, ZHANG F J, ZHONG Z Y, et al. Generation of virus-resistant potato plants by RNA genome targeting[J]. Plant Biotechnology Journal, 2019, 17(9): 1814-1822.
[10]SVITASHEV S, SCHWARTZ C, LENDERTS B, et al. Genome editing in maize directed by CRISPR-Cas9 ribonucleoprotein complexes[J]. Nature Communications, 2016, 7: 13274.
[11]ABUDAYYEH O O, GOOTENBERG J S, KONERMANN S, et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector[J]. Science, 2016, 353(6299): aaf5573.
[12]ABUDAYYEH O O, GOOTENBERG J S, ESSLETZBICHLER P, et al. RNA targeting with CRISPR-Cas13[J]. Nature: International weekly journal of science, 2017, 550(7675): 280-284.

