SA,ETH和IAA处理对破除赖草种子休眠的影响
刘 伟, 畅宝花, 许庆方, 王凯鑫, 赵凯玥, 杜利霞
(山西农业大学草业学院,山西 太谷 030801)
赖草(Leymussecalinus(Georgi)Tzvel.)是禾本科(Poaceae)小麦族(Triticeae)赖草属(LeymusHochst.)的一种植物[1],赖草具有发达的地下根状茎,适应性较强,生存环境广泛[2],具有较强的耐寒、耐旱、耐涝、耐碱、耐风沙及抗病虫害等能力[3-4],对生态保护及恢复具有重大意义[5]。赖草属植物中优良的基因也是牧草和麦类作物育种的重要基因资源[6-7]。赖草经过长期的自然选择,其野生性强,驯化时间短,无性繁殖力强,有性繁殖力弱,雄花大部分不育,结实率、发芽率都很低[8],种子存在严重休眠,萌发不整齐,萌发后幼苗生长发育缓慢,大大降低了其生物学和生态应用价值[9-10]。
种子休眠是决定植物种子萌发和幼苗建立的重要基础[11]。Christina研究表明植物生长调节剂有助于破除种子休眠[12]。Khan指出植物激素有助于缓解亚热带草种在盐胁迫和光照下时的种子休眠[13],激素对破除种子休眠具有很大的作用,一般表现为低浓度促进,高浓度抑制[14]。水杨酸(Salicylic acid,SA)对于打破黑麦草[15]、燕麦(AvenasativaL.)[16]、大豆(Glycinemax(Linn.)Merr.)[17]、蕹菜(IpomoeaaquaticaForsk.)[18]等种子休眠都具有很大的作用。乙烯利(Ethephon,ETH)对于玉米[19-20]、黄瓜(CucumissativusL.)[21]、黑麦草(LoliumperenneL.)[22]、纳罗克非洲狗尾草(Setariasphacelata‘Narok’)[23]等种子发芽具有促进作用。吲哚乙酸(Indoleacetic acid,IAA)能够有效打破大豆[24]、绣线菊(SpiraeasalicifoliaL.)[25]、菜瓜(CucumismeloL. var.flexuosusNaud.)[26]、玉米(ZeamaysL.)[27]等种子休眠。但SA、ETH和IAA这3种物质在破除赖草种子休眠的应用上鲜有报道,本试验分别通过不同浓度的SA,ETH,IAA在不同时间段内处理赖草种子,以期打破种子休眠,提高种子发芽势、发芽率等,为赖草种子在生产利用中提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为成熟的赖草种子,该种子收获于2019年7月15日山西农业大学草业科学赖草驯化试验田(37°25′ N,112°23′ E,海拔799 m),风干脱粒,筛选籽粒饱满的赖草种子低温贮藏备用,千粒重为2.61 g。供试试剂为水杨酸(含量≥99.5%,天津市北辰方正试剂厂)、乙烯利(含量>85%,上海蓝季科技发展有限公司)、吲哚乙酸(北京索莱宝科技有限公司)。
1.2 试验方法
赖草种子贮藏9个月后于2020年5月4日开始试验,挑选籽粒饱满、大小均匀的赖草种子放到烧杯中,使用5%的次氯酸钠消毒10 min,再用蒸馏水冲洗3次,待滤纸吸干种子表面水分后备用。
将赖草种子分别用浓度为0.01,0.05,0.09,0.13,0.17 mmol·L-1水杨酸(SA),200,300,400,500,600 μL·L-1乙烯利(ETH),20,30,40,50,60 mg·L-1吲哚乙酸(IAA)分别处理12 h,24 h,36 h[26],对照(CK)用蒸馏水处理相同时间。取各处理的25粒赖草种子用蒸馏水冲洗干净,放入置有双层滤纸的培养皿中,每组3个重复,贴上标签。将所有处理材料放入25℃恒温人工气候培养箱[26]。培养周期为20 d,以胚根突破种皮作为发芽标准,每天观察统计发芽个数,测量记录幼苗苗长。
1.3 测定指标
参照国际种子检验协会(ISTA)的种子检验规程(2015)[28]规定的发芽条件。处理后的种子直接进行发芽试验,7 d计算种子发芽势,20 d发芽结束进行统计,并测量所有正常种苗的苗长,计算活力指数。
发芽势=第7天发芽种子数/供试种子数×100%;
发芽率=第20天发芽种子数/供试种子数×100%;
发芽指数(GI)= ∑(Gt/ Dt);
活力指数(VI)= GI × S。
上述式中,Gt代表某日的发芽数,Dt为与Gt对应的发芽天数,S为平均苗长。
发芽结束后使用游标卡尺测量赖草幼苗苗长。
1.4 数据处理
所有数据使用Microsoft Excel 2010录入并作图,采用SPSS25.0软件进行统计分析,使用Duncan’s法检验各组处理之间的差异显著性。
2 结果与分析
2.1 SA浓度及浸种时间对赖草发芽指标的影响
由图1可知,不同浓度的SA及浸种时间对赖草种子发芽指标影响不同。由图1A可知,0.05 mmol·L-1SA浸种36 h和0.09 mmol·L-1SA浸种24 h后的赖草种子发芽势分别为28%和25%,均显著高于对照(P<0.05)。低浓度(0.01 mmol·L-1)SA处理对种子发芽势有促进作用,而在0.09 mmol·L-1,0.13 mmol·L-1和0.17 mmol·L-1SA浸种12 h后,赖草种子发芽势显著低于对照(P<0.05)。
由图1B可知,赖草种子发芽率表现为先升高后降低的趋势。0.01 mmol·L-1和0.05 mmol·L-1SA浸种12 h后的赖草种子发芽率较高,分别为52%和64%,且最高为对照的2倍随着SA浓度及浸种时间的增加,与对照相比,赖草发芽率无显著差异,且在0.13 mmol·L-1SA浸种12 h发芽率最低为17%。
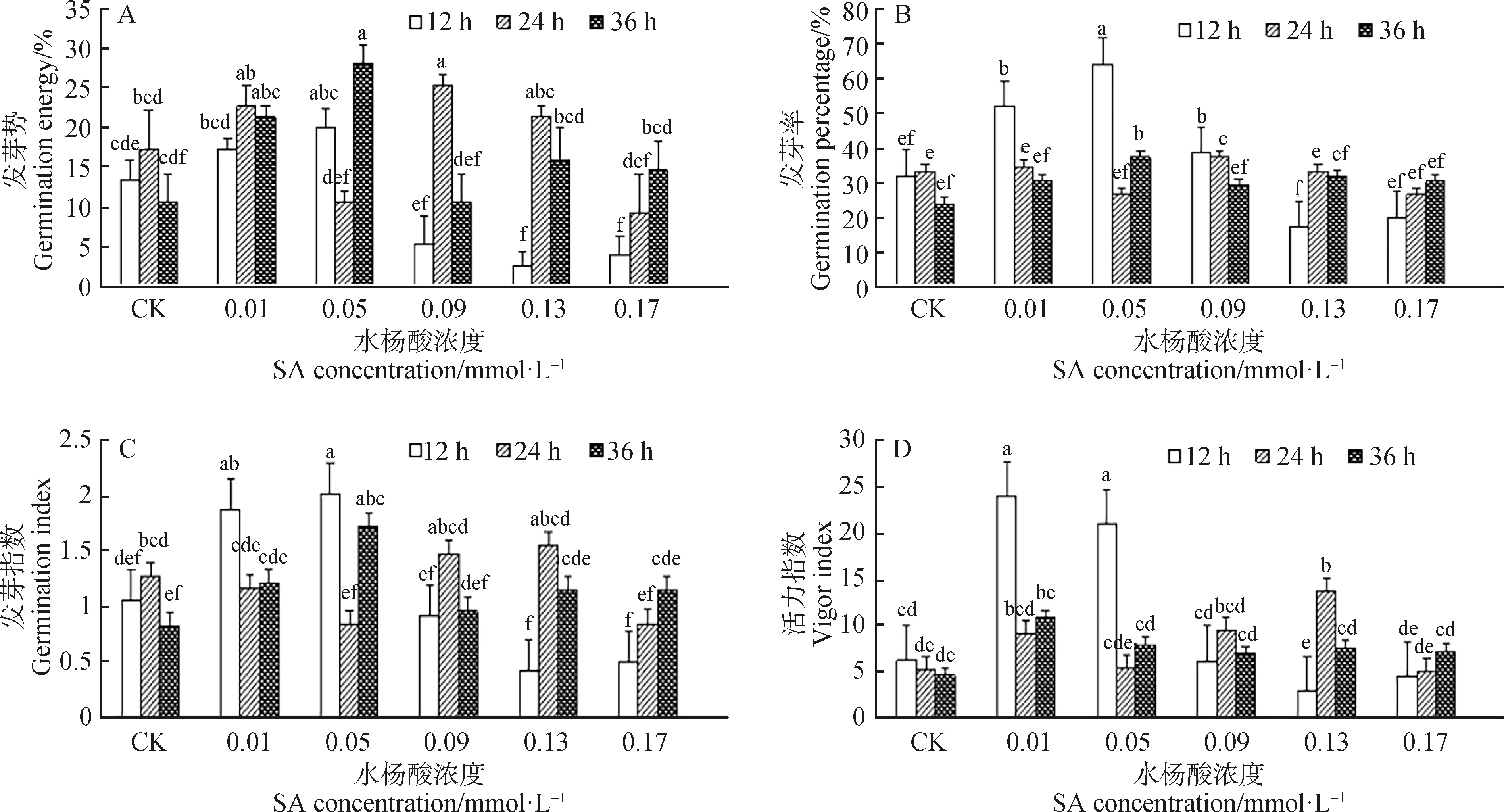
图1 SA浸种浓度及处理时间对赖草发芽指标的影响Fig.1 Effect of SA concentrations and treatment time on seed germination of Leymus secalinus注:图中不同小写字母表示差异显著(P<0.05),下同Note:Different lowercase letters indicate significant difference at the 0.05 level,the same as below
由图1C可知,0.01 mmol·L-1和0.05 mmol·L-1(低浓度)SA浸种12 h赖草发芽指数显著高于对照(P<0.05),分别为1.89和2.02。随着浸种浓度和时间的增加,赖草发芽指数大多与对照差异不显著,0.13 mmol·L-1和0.17 mmol·L-1SA溶液浸种12 h后,与对照相比,赖草发芽指数有所降低,但无显著差异。
由图1D可知,不同浓度SA在不同浸种时间下对赖草种子的活力指数影响不同。0.01 mmol·L-1和0.05 mmol·L-1SA浸种12 h后活力指数均显著高于对照(P<0.05),分别为23.96和20.93。随着SA浓度及浸种时间的增加,与对照相比,赖草种子的活力指数多数无显著差异,而0.13 mmol·L-1SA浸种12 h后活力指数降低。
2.2 ETH浓度及浸种时间对赖草种子发芽指标的影响
由图2A可知,随着ETH浓度和浸种时间的增加,赖草发芽势表现为先增高后降低的趋势。浓度为200 μL·L-1ETH浸种24 h后发芽势最高为25%。在500 μL·L-1ETH浸种36 h,600 μL·L-1ETH浸种24 h后赖草发芽势显著低于对照(P<0.05),赖草发芽势显著降低。
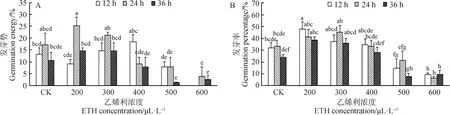
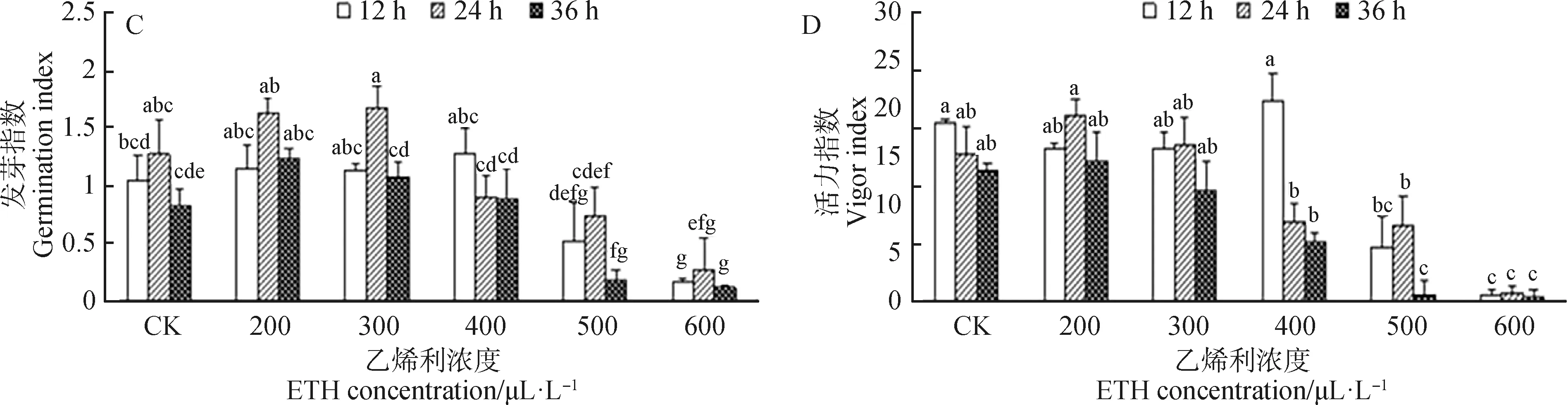
图2 ETH浸种浓度及处理时间对赖草发芽指标的影响Fig.2 Effect of ETH concentrations and treatment time on seed germination of Leymus secalinus
由图2B可知,随着ETH浸种浓度及处理时间的增加,种子发芽率出现先增高后降低的趋势。200 μL·L-1ETH浸种12 h后发芽率达到最大为48%,显著高于对照(P<0.05)。ETH浓度为300 μL·L-1和400 μL·L-1(低浓度)时,与对照相比,发芽率小幅增高,但差异不显著。600 μL·L-1ETH浸种对种子发芽率产生了严重抑制作用,种子发芽率显著低于对照(P<0.05)。
由图2C可知,随着ETH浸种浓度及处理时间的增加,种子发芽指数出现先增高后降低的趋势。300 μL·L-1ETH浸种24 h发芽指数达到最大为1.69,但与对照相比无显著差异。500 μL·L-1ETH浸种36 h与600 μL·L-1(高浓度)ETH浸种均显著降低种子发芽指数(P<0.05)。
由图2D可知,高浓度与低浓度ETH对赖草种子活力指数影响不同。400 μL·L-1ETH浸种12 h后种子活力指数达到最大,之后随着ETH浓度及处理时间的增加,种子活力指数逐渐降低。与对照相比,500 mL·L-1ETH浸种12 h,36 h和600 μL·L-1ETH浸种处理后活力指数显著降低(P<0.05)。
2.3 IAA对赖草种子发芽指标的影响
由图3A可知,不同IAA浸种浓度及处理时间对种子发芽势多数表现为促进作用,少数情况下作用不明显。20 mg·L-1IAA浸种12 h后种子发芽势最高为33%,显著高于对照处理(P<0.05)。
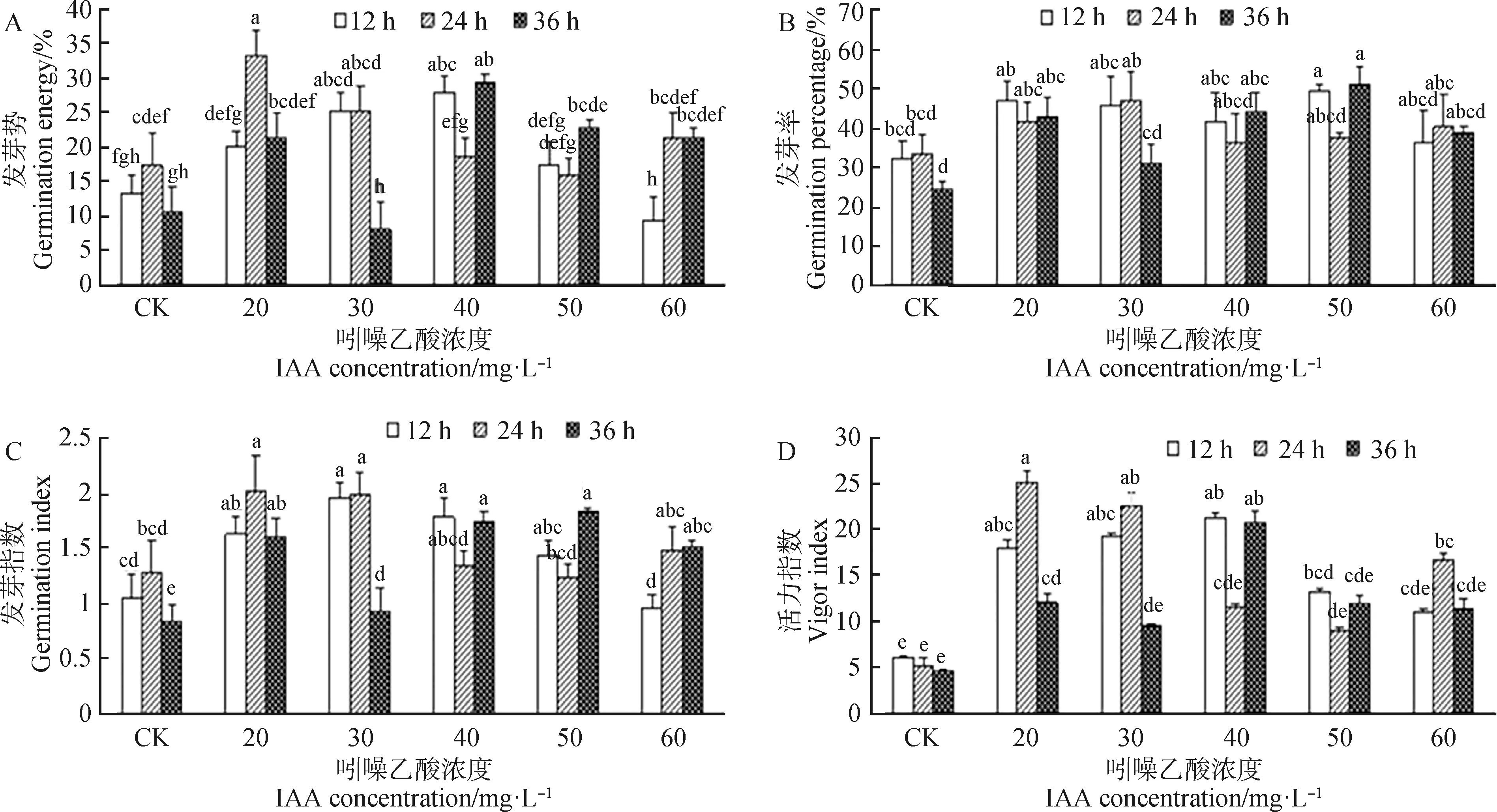
图3 IAA浸种浓度及处理时间对赖草发芽指标的影响Fig.3 Effect of IAA concentrations and treatment time on seed germination of Leymus secalinus
由图3B可知,与对照相比,不同IAA浸种浓度及处理时间后,种子发芽率均有所升高,50 mg·L-1IAA浸种12 h和36 h后发芽率较高且显著高于对照(P<0.05)分别达到49%和51%,IAA浓度及浸种时间的增加对种子发芽率作用不显著。
由图3C可知,与对照相比,20 mg·L-1IAA与30 mg·L-1IAA浸种12 h,24 h,40 mg·L-1IAA浸种12 h,36 h与50 mg·L-1IAA浸种36 h,60 mg·L-1IAA浸种36 h种子发芽指数均都显著提高(P<0.05),其他IAA浓度及浸种处理时间下赖草发芽指数差异不显著。
由图3D可知,与对照相比,不同IAA浸种浓度及处理时间后,种子活力指数均有所提高,种子活力指数多数表现为显著升高,少数无显著差异。20 mg·L-1IAA浸种24 h后种子活力指数达到最大为25.16,显著高于对照处理(P<0.05)。
2.4 SA,ETH,IAA浸种浓度及时间对赖草种子发芽指标的影响
由表1可知,除SA浸种时间对赖草种子发芽率、发芽指数作用不显著,SA浸种浓度、时间及其交互作用对于赖草种子发芽指标均有显著影响(P<0.05)。ETH浸种浓度对赖草种子发芽指标作用显著(P<0.05),浸种时间对赖草种子发芽势与活力指数作用显著(P<0.05),浸种浓度及时间的交互作用对赖草发芽指标作用不显著。IAA浸种浓度对赖草发芽指标作用显著(P<0.05),而浸种时间对其则没有产生显著影响。IAA浓度及时间交互作用下,除对其发芽率作用不显著,对赖草种子其他发芽指标作用显著(P<0.05)。
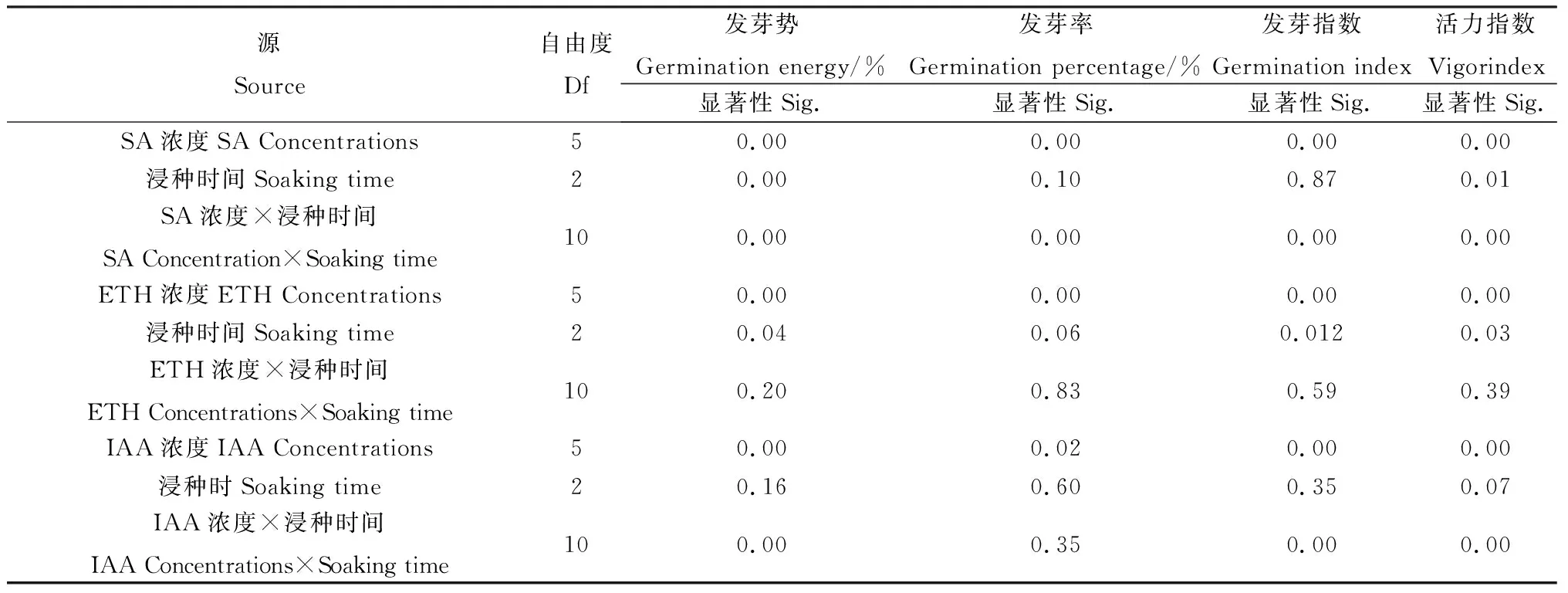
表1 SA,ETH,IAA浸种浓度及处理时间对赖草种子发芽指标的双因素分析Table 1 Analysis of the effect of SA,ETH,IAA concentrations and treatment time on seed germination of Leymus secalinus
3 讨论
3.1 SA对破除赖草种子休眠的影响
SA是农作物体内普遍存在的一种小分子酚类化合物,对于破除种子休眠具有很大的作用[29],适宜浓度的SA浸种可以缩短蚕豆发芽时间,提高发芽指数[30]。0.05 mmol·L-1SA浸种36 h后赖草种子发芽势达到最大为28%,0.13 mmol·L-1,0.17 mmol·L-1(高浓度)SA浸种12 h后发芽势明显出现抑制作用,这与马丽[28]、朱利君[31]、王英[32]等研究结果一致。0.05 mmol·L-1SA浸种处理12 h后赖草发芽率达到最大为64%,均高于IAA,ETH浸种处理。SA对赖草种子的发芽指数与活力指数影响相似,分别在0.05 mmol·L-1,0.01 mmol·L-1(低浓度)SA浸种12 h后达到最大,随着浸种浓度及时间的增加,发芽指数与活力指数均出现抑制现象。闫艳华[16]指出低浓度SA下促进燕麦种子萌发,高浓度下抑制燕麦种子萌发,SA浓度在0.05 mmol·L-1浸种24 h时燕麦的发芽势、发芽率、发芽指数和活力指数最高。低浓度下SA能提高植物的发芽势、发芽率,高浓度则会出现抑制现象,可能是由于高浓度的SA破坏了种子内部的生理代谢过程,致使种子活性不但未能大幅度地增加,反而有所下降[33]。因此,0.05 mmol·L-1SA浸种处理12 h后可有效打破赖草种子休眠,且与ETH,IAA浸种处理相比效果更佳。
3.2 ETH对破除赖草种子休眠的影响
ETH是外源植物生长调节剂的一种,具有打破种子休眠、调节植物生长发育、增强抗逆性和提高果实品质等作用[34]。ABA等抑制物的存在,很大程度限制了赖草种子萌发[9]。研究表明ETH浸种能够促进美女樱(VerbenahybridaVoss)种子的萌发[35-36]、增加甘蔗(Saccharumofficinarum)花芽切片的出苗率、幼苗茎干重与根干重[37]。与对照相比,200 μL·L-1ETH浸种24 h后赖草种子发芽势显著增高,200 μL·L-1ETH浸种12 h后赖草种子发芽率达到最高,这可能由于ETH初始浓度设置过高导致。300 μL·L-1ETH浸种24 h与400 μL·L-1ETH浸种12 h赖草发芽指数与活力指数分别达到最大,500 μL·L-1,600 μL·L-1(高浓度)ETH对赖草发芽势、发芽率、发芽指数、活力指数均存在抑制作用。苏黎等[22]指出多年生黑麦草在0.02%与0.05%的ETH浸种处理之间有差异显著,低浓度ETH对黑麦草出苗有显著的促进作用,较高浓度的ETH浸种则不利于多年生黑麦草的出苗。闫秋洁等[20]指出100~800 mg·L-1的ETH都能提高PEG6000胁迫下玉米种子的发芽率和幼苗长度。田文杰[19]指出在125 mg·L-1和250 mg·L-1ETH浓度下均可提高‘农禾518’种子的发芽势、发芽率、发芽指数和活力指数等指标,高浓度则出现抑制现象,这与本试验研究效果一致。因此,200 μL·L-1ETH浸种12 h后可有效打破赖草种子休眠,但最佳ETH浓度及处理时间有待进一步研究。
3.3 IAA对破除赖草种子休眠的影响
IAA作为一种促进植物生长的外源激素,可以诱导和促进植物细胞分化,尤其是促进植物维管组织的分化,还可以促进植物同化物的运输和种子萌发[38-39]。郑艳冰[27]指出玉米种子在IAA浸种浓度30 mg·L-1时发芽率达到最大,同时指出高浓度IAA对种子的发芽指数、活力指数会产生抑制作用。与对照相比,50 mg·L-1IAA浸种36 h后,均能显著提高赖草种子的发芽势、发芽率、发芽指数和活力指数,说明IAA可以促进种子萌发,从而提高赖草种子发芽势、发芽率等[40]。不同浓度的IAA及浸种时间没有对赖草种子发芽指标产生抑制作用,这与郑艳冰[27]研究高浓度IAA对玉米种子发芽指标产生抑制作用有所不同,可能是由于不同的处理时间或不同种子对于IAA浓度反应不同。史静[12]表明20 mg·L-1IAA处理赖草种子(收获4年)后发芽较为理想为78%,与本试验相比发芽率较高,说明贮藏时间也能影响赖草种子发芽[9]。杨义波等[25]指出20 mg·L-1IAA浸种30 h后,能显著提高绣线菊种子的发芽势、发芽率等,吴丽芳等[40]表明用20 mg·L-1的IAA处理白三叶可显著提高其发芽势、发芽率等,说明IAA浸种可有效打破种子休眠。本试验研究表明50 mg·L-1IAA浸种36 h后可有效打破赖草种子休眠,提高发芽指标。
种子休眠与萌发受到内在多种激素的共同调控[9],添加适宜的外源生长调节物质能快速改变种子内的激素水平,诱导淀粉酶、蛋白酶和其他水解酶的合成,催化种子内储藏物质的降解,以供胚的生长发育所需[41],从而打破种子休眠。本试验选用SA,ETH,IAA物质均有效打破赖草种子休眠,而其共同作用的效果有待进一步研究。
4 结论
本试验研究发现3种物质SA,ETH和IAA均能有效破除赖草种子休眠。使用浓度为0.05 mmol·L-1SA浸种处理12 h能显著促进赖草种子发芽且效果最佳,发芽率可达到64%,其次为IAA,ETH浸种处理。过高浓度的SA,ETH处理反而会降低赖草种子发芽指标,IAA处理则没有出现抑制情况。

