新免疫标志组合在多参数流式细胞术检测多发性骨髓瘤微小残留病中的应用
左晓佳, 冯尽意, 叶丽霖, 邢 苗, 邓之奎, 刘定胜,
(1. 贵州医科大学,贵阳 550004; 2. 上海健康医学院附属周浦医院肿瘤血液科,上海 201318; 3. 江苏省淮安市第一人民医院血液科,江苏 淮安 223000)
近年来,越来越多的证据表明多发性骨髓瘤(multiple myeloma, MM)的缓解深度与患者的无进展生存(progression free survival, PFS)及总生存(overall survival, OS)有着密切关系[1-3]。微小残留病(minimal residual disease, MRD)作为判断MM缓解深度的重要标志也受到更多的关注[4-9]。多参数流式细胞术(multiparameter flow cytometry,MFC)具有检测敏感性高、方便快捷、费用适中等优势,现已成为MM临床应用最广泛的MRD检测手段[5,8,10]。本课题组先前的研究表明[11],经CD38、CD138和CD45设门,对CD19、CD20、CD28、CD45、CD56和CD117的进行检测可有效判别MM的MRD。后续的研究进一步发现[12],CD44、CD49d和CD184在MM细胞中高表达,流式细胞仪检测的敏感性高,但它们是否具有MM特异性免疫标志的特征以及是否可进一步帮助判别MM的MRD目前还不清楚。本研究利用MFC检测以上免疫标志组合,以了解这些新的免疫标志组合在MM的MRD检测中的意义。
1 资料与方法
1.1 一般资料
以2012年4月—2020年4月江苏省淮安市第一人民医院和上海健康医学院附属周浦医院收治的44例治疗后的MM患者为研究组,经过化疗、蛋白酶体抑制剂、免疫调节剂、单克隆抗体或自体造血干细胞移植至少一种治疗,存在MRD且有足够的浆细胞可用于流式细胞仪分析。每例患者均进行骨髓涂片检查,经形态学确定其浆细胞小于5%。所有患者都通过免疫固定电泳检测单克隆免疫球蛋白(M蛋白)和轻链,其中33例为阳性。以43例江苏省淮安市第一人民医院和上海健康医学院附属周浦医院收治的非浆细胞肿瘤的造血系统恶性肿瘤为对照组,进一步分为两个亚组,对照A组为12例未经治疗的非浆细胞肿瘤患者,包括2例新诊断的霍奇金淋巴瘤和10例非霍奇金淋巴瘤。对照B组31例为经化疗、靶向治疗或去甲基化治疗等各种抗肿瘤治疗达完全缓解的非浆细胞肿瘤患者,其中非霍奇金淋巴瘤8例、骨髓增生异常综合症8例、急性髓系白血病7例、急性淋巴细胞白血病3例、慢性粒细胞白血病3例、Ph染色体阴性的骨髓增殖性肿瘤1例和霍奇金淋巴瘤1例。患者相关信息以及骨髓涂片中浆细胞计数数据见表1。研究获得所有MM患者和对照者的知情同意。
1.2 试剂与仪器
Navios流式细胞仪购自美国Beckman Coulter公司;主要试剂: CD19-PC5、CD19-FITC、CD20-PC5、CD45-KO、CD56-A700、CD117-A750、CD38-PC7、CD138-PB、κ轻链-FITC和λ轻链-PE购自Beckman Coulter公司;CD28-APC、CD44-APC和CD49d-APC购自美国BD公司;CD184-PC7购自美国Invitrogen公司。
1.3 方法
研究组和对照组患者的骨髓标本予EDTA抗凝,24h内用10色流式细胞仪检测。标本在4℃与单克隆抗体孵育15min,在室温下按标准程序裂解成熟红细胞后流式细胞仪检测。在检测胞质抗原时,按程序予破膜处理。每份标本分2管检测,使用的抗体组合如下。第1管: cytoKappa-FITC、cyto-Lambda-PE、CD38-AC7、CD138-PB、CD19-PC5、CD56-A700、CD28-ECD、CD44-APC、CD45-KO;第2管: CD38-AC7、CD138-PB、CD19-FITC、CD20-PC5、CD184-PC7、CD117-A750、CD49d-APC、CD56-A700、CD45-KO。每份标本至少分析50万个细胞,一些标本浆细胞较少,分析的细胞数达100万个,并且至少获得100个以上浆细胞用于分析。获得数据应用Kaluza2.0软件进行分析: 通过FSC/SSC点图,设定有核细胞R1(图1A),浆细胞R2通过CD38/CD138高表达进行识别(图1B),通过FS-INT/SS-INT设门以排除非特异性结合,进一步纯化浆细胞R3(图1C),进而分析R3门内细胞。幼红细胞可以通过CD45/SSC识别,并且不表达CD38/CD138,据此可作为阴性内参照。通过胞质轻链κ/λ的限制性的方法保证了浆细胞的克隆性,可以更准确的限定MM的MRD细胞。对κ/λ轻链表达的分析在分析全部浆细胞和CD45dim/-浆细胞基础上进行,同时分析CD20阳性、CD45强阳性的淋巴细胞以确定成熟B淋巴细胞的克隆性,将B细胞淋巴瘤或白血病标本中伴有单克隆浆细胞的标本予以去除,见图1。
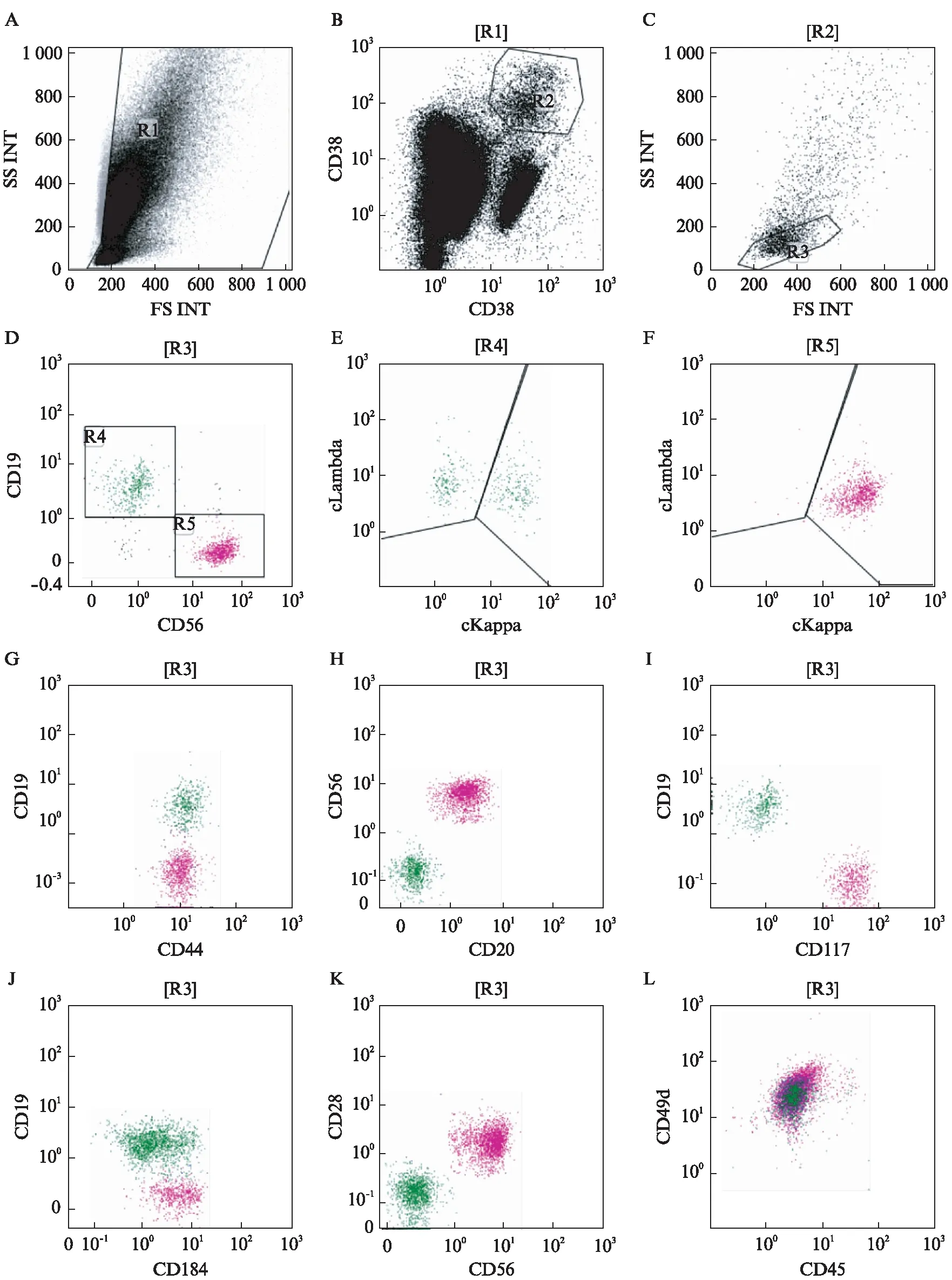
图1 流式细胞术的免疫标志分析Fig.1 Flow cytometry analysisA~C: 确定R1、R2和R3细胞;D~F: 分析R3门内细胞;G~I: 1例MM患者的CD19/CD44、CD56/CD20、CD19/CD117散点图;J~L: CD19/CD184、CD28/CD56和CD49d/CD45散点图
1.4 统计学处理
应用Fisher’s Exact Test分析分类变量的比较;组间比较应用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 MM的MRD细胞与非MM浆细胞的比较
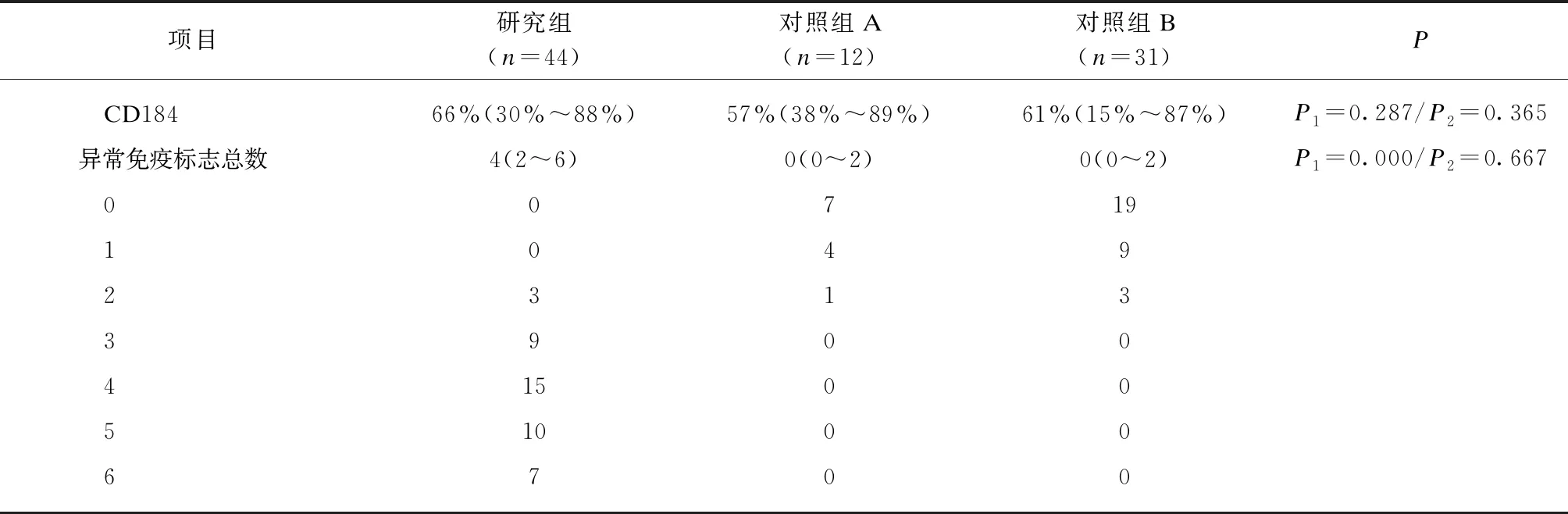
MFC检测显示,研究组CD45、CD28、CD117、CD20、CD44和CD184表达具有较大异质性,CD19、CD56和CD49d表达均一性较好,其中CD19低表达,而CD56和CD49d高表达;对照组CD45、CD19、CD44和CD184表达具有较大异质性,CD56、CD28、CD117、CD20和CD49d表达均一性较好,其中CD56、CD28、CD117和CD20低表达,而CD49d高表达,见图2。与对照组相比,研究组CD45、CD19、CD56、CD28、CD117、CD20和CD44表达差异有统计学意义(P<0.05)。虽然CD49d在研究组中高表达,但在对照组中也高表达,而且在研究组和对照组中表达的均一性良好,差异无统计学意义(P=0.710)。同样,CD184也有较高的表达,虽然与CD49d相比,CD184在研究组和对照组中的表达有一定异质性,但研究组和对照组在统计学上差异无统计学意义(P=0.287),见表1。
2.2 非MM浆细胞之间的比较
两组的浆细胞大多都表达CD45、CD19、CD44、CD49d和CD184,除了CD49d均一性高以外,其他的免疫标志表达均具有一定异质性。与此相反,CD56、CD28、CD117和CD20在多数浆细胞中不表达,而且均一性较高。总体来说,在非MM浆细胞中,未经治疗与经抗肿瘤治疗后浆细胞以上免疫标志比较差异无统计学意义。多数浆细胞中不表达CD28,但经抗肿瘤治疗后,CD28表达有升高(0~27%,中位数5%),且对照A组与对照B组比较差异有统计学意义(P=0.041),见表1。
2.3 设定界值后MM的MRD细胞与非MM浆细胞比较
为了获得更好MM的MRD细胞与非MM浆细胞比较的敏感性和特异性,本研究通过ROC曲线设置了每种免疫标志的界值。CD45、CD19、CD56、CD44和CD28的最佳界值分别为42%、48%、26%、56%和42%,为了便于临床应用,分别被调整为≤40%、≤50%、≥25%、≤55%和≥40%。CD20和CD117的最佳界值分别是8%和4%,在这种情况下为了避免高估阳性率,本研究采用了传统的20%作为界值。研究组与对照组的CD49d与CD184表达差异无统计学意义,对于鉴别MM的MRD细胞与非MM浆细胞无特殊价值,故未设置界值和进一步分析。本研究将超过界值定义为阳性,研究组的浆细胞在CD45、CD19、CD56、CD44、CD28、CD20和CD117中均与对照组的浆细胞差异有统计学意义(P<0.05)。MM的MRD细胞中位异常免疫标志数为4(2~6)个,而非MM浆细胞为0(0~2)个,见表1。

表1 多发性骨髓瘤微小残留病细胞与非多发性骨髓瘤浆细胞的比较
续表

图2 多发性骨髓瘤微小残留病细胞与非多发性 骨髓瘤浆细胞免疫标志表达情况的比较Fig.2 Immunophenotypic comparisons between MRD of MM patients and plasma cells of non-MM patients
3 讨 论
MM治疗后MRD的检测有赖于在非MM浆细胞背景下对MM浆细胞的鉴别,而此时患者骨髓标本中,非MM浆细胞可能占了浆细胞总数的99%[13]。因此,MM的MRD细胞与非MM浆细胞的鉴别需要高敏感性和特异性的检测方法。当前,MFC是临床上公认的应用最广泛的定量检测MM的MRD的方法。但在实际应用过程中,也发现了一些问题,如由于非MM浆细胞与MM细胞的异质性,导致两者的免疫标志有部分重叠,影响检测的特异性[14-15];免疫标志物的选择未能完全统一[8,16];其标准化问题也较为突出等[6,9]。还有研究表明,MM治疗后患者免疫标志的表达发生变化,而且这些变化使得流式细胞仪检测MRD更趋复杂化[17-20]。因此,寻找新的MM免疫标志组合仍是检测MRD的重要挑战。
本研究使用10色流式细胞仪,相对于传统的4色、6色的流式细胞仪,能更方便地在同一群浆细胞中分析更多的免疫标志。例如,当确认有一部分患者的非MM浆细胞亚群表达CD56时,就发现了CD19+CD56+亚群和CD19-CD56+亚群浆细胞;通过在全部浆细胞和CD45dim/-浆细胞基础上设门的方法检测多发性骨髓瘤患者κ/λ的克隆性表达。10色流式细胞仪技术可以允许同时检测细胞膜表面免疫标志和细胞浆轻链,这种方法增加了克隆性分析的敏感性和微小残留病检测的可信度。
本研究发现,在MM的MRD细胞中CD44的表达具有显著的异质性,多数细胞为低表达(0~100%,中位数20%),而对照组的CD44为高表达(43%~100%,中位数88%),两类细胞的表达差异有统计学意义(P=0.007),尤其是经过ROC曲线确定界值后,定义≤55%为异常,可以将MM的MRD细胞与非MM浆细胞有效区分(P=0.001)。以上的检测和分析提示CD44可作为多发性骨髓瘤特异性免疫标志之一。
研究[12]发现,CD49d和CD184在MM细胞中高表达,而且表达的均一性好于CD44,同时在理论上推测有可能成为MM细胞新的特异性免疫标志物。本研究显示,虽然在研究组中CD49d和CD184仍然高表达,CD49d均一性良好,CD184显示一定的异质性,但在对照组中CD49d和CD184也同样高表达,且差异无统计学意义,提示CD49d和CD184并不能用于鉴别MM细胞和非MM浆细胞。以上结果说明,CD49d和CD184广泛存在于浆细胞中,在MM细胞的检测中,虽然有良好的敏感性,但缺乏特异性,不能作为合适的免疫标志物。
本研究证实了CD44可作为鉴别MM的MRD细胞与非MM浆细胞的新的免疫标志,因此,将CD44与先前已确定的CD20、CD28、CD56、CD117、CD19和CD45组合在一起,应用ROC曲线确定各自的界值后,确定每例MM患者肿瘤性浆细胞异常表达的免疫标志的个数。研究组有4个异常表达(范围2~6),而对照组为0个异常表达(范围0~2),差异有统计学意义(P=0.000)。为了比较先前6个免疫标志物组合与本研究确定的7个免疫标志物组合的检测效率,研究组为100%具有MM微小残留病,对照组为100%没有MM微小残留病,以2个标记物异常定义为判断微小残留病的标准,比较两组免疫标志物组合检测MRD的敏感性和特异性。结果显示: 原免疫标志组合灵敏度为93.22%,特异度为92%,新免疫标志组合灵敏度为100%,特异度为90.69%。本研究不但再次证实了课题组先前的工作[11],即CD20、CD28、CD56、CD117、CD19和CD45等6个免疫标志可有效检测MM的MRD,而且发现包括CD44的新的免疫标志组合进一步提高了MM的MRD的检测效率。另外,本研究还发现,先前的工作应用ROC曲线确定的界值[11]与本研究应用ROC曲线确定的界值基本在相近的范围,而经过适当调整后基本吻合。因此,在今后的工作中可以将CD45、CD19、CD56、CD28、CD117、CD20和CD44的最佳界值定义为≤40%、≤50%、≥25%、≥40%、≥20%、≥20%和≤55%,超过界值可判定为异常。
本研究还发现与先前研究不完全一致的两种情况。(1) CD44在2次研究中的表达不一致。本研究中,以55%为界值,MM的MRD细胞CD44的表达多数低于此界值,非MM浆细胞绝大多数病例高于此界值;而在先前的研究中[12],CD44在MM的细胞中多数为高表达,中位数76.9%,如果同样以55%为界值,多数病例高于此界值。对于2次研究的不同结果,可能是前后2次研究中MM患者的疾病状态的差异造成的。有研究[12,21]认为,MM疾病进展和耐药时CD44高表达。先前工作[12]认为,MM患者疾病状态是多样的,包括初诊、维持和难治复发的患者,这部分患者中有疾病进展或耐药的患者,因此总体CD44表达的升高,而本研究中研究组的患者几乎没有疾病进展和耐药患者,所以CD44总体表达比较低。(2) CD28在2次研究中的表达不完全一致。本研究中,研究组与对照组CD28的表达差异有统计学意义(P=0.032),而且对照A组与对照B组相比差异也有统计学意义(P=0.041);先前的研究[11]显示,对照A组与对照B组的比较差异有统计学意义(P=0.01),提示CD28在经过抗肿瘤治疗后,表达可能上调,但研究组与对照组的比较差异无统计学意义(P=0.396)。可能的原因是本次研究病例数相对较少,增加病例数有可能得到一致的统计结果。
综上,本研究的结果表明: (1) MM的MRD细胞中CD44为低表达,而非MM浆细胞高表达,两类细胞的表达有显著性差异,CD44可作为多发性骨髓瘤特异性免疫标志之一;(2) CD49d和CD184广泛存在于浆细胞中,但缺乏特异性,不能作为多发性骨髓瘤特异性免疫标志;(3) 利用CD45、CD19、CD56、CD28、CD117、CD20和CD44新的免疫标志组合将提高MM的MRD的检测效率。虽然仍然可能存在一定的免疫标志的重叠现象,但是应用以上新的免疫标志组合,MFC能有效地检测出MM的MRD细胞。

