鉴别H5亚型两种分支禽流感病毒双重实时荧光RT-PCR方法的建立及应用
彭 程,刘 朔,张 琳,2,李金平,于晓慧,侯广宇,王静静,李 阳,蒋文明,刘华雷
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.山东农业大学动物科技学院,山东泰安 271000)
禽流感病毒(avian influenza virus,AIV),属于正黏病毒科A 型流感病毒属,可引起禽类和哺乳动物的高度传染性呼吸道疾病[1]。根据其致病性不同和HA 蛋白裂解位点处的分子特征,可将AIV 分为高致病性禽流感病毒(highly pathogenic avian influenza virus,HPAIV)和低致病性禽流感 病 毒(low pathogenic avian influenza virus,LPAIV)[2-3],其中HPAIV 主要包括H5 和H7 亚型,引起的高致病性禽流感(highly pathogenic avian influenza,HPAI)不仅严重危害养禽业发展,亦严重威胁人类健康,因而被世界动物卫生组织(OIE)列为须通报动物疫病,在我国被列为一类动物疫病。
自A/goose/Guangdong/1/1996(H5N1)HPAIV 报道以来,全球H5 亚型HPAIV 暴发数逐渐增多,病毒也进化为10 个分支,内部超过30 个亚分支[4-5]。在H5 亚型HPAIV 中,第2.3.4.4 分支和第2.3.2.1 分支病毒在亚洲地区(如中国、越南、韩国等)家禽中呈地方性流行[6-7]。第2.3.2.1 分支于2004 年首次在香港发现,之后病毒逐渐进化为2.3.2.1a、2.3.2.1b、2.3.2.1c、2.3.2.1d 和2.3.2.1e 等5 个小分支[8-9]。第2.3.4.4 分支病毒在亚洲、北美、欧洲、非洲等地区暴发和流行[10-12]。近年来,我国流行的H5 亚型HPAIV 为第2.3.2.1 和第2.3.4.4 分支,且这两个分支病毒具有不同的抗原特性,对应的疫苗毒株也不同。因此,临床上需要对H5 亚型HPAIV 进行快速准确诊断和分支区分。
分子诊断是鉴定和控制HPAI 疫情的第一步。当前,许多实验室建立了多种诊断方法,如DNA芯片、环介导等温扩增方法以及限制性片段长度多态性分析等[13-16],用来快速区分HA 亚型,其中最常用的是实时荧光RT-PCR 方法。这些方法虽然可以对病毒进行亚型鉴定,但不能进行分支鉴定,还需要通过测序等技术进一步分析。因此有必要发展一种快速诊断方法,可以同时检测不同分支的H5亚型HPAIV[17]。
本研究建立了一种可以在检测H5 亚型HPAIV的同时鉴别其所属分支的一步法双重实时荧光RTPCR 方法。该方法检测耗时短,且可快速做出结果及其所属分支判断,对禽流感快速诊断及控制具有重要意义。
1 材料与方法
1.1 主要试剂
QIAamp Viral RNA Mini Kit核酸提取试剂盒,购自Qiagen 公司;HiScript II U+One Step qRT-PCR Probe Kit,购自Vazyme 公司;TOPO 载体克隆试剂盒,购自CloneSmart 公司。
1.2 病毒和核酸提取
各亚型AIV、新城疫病毒(Newcastle disease virus,NDV)、传染性支气管炎病毒(infectious bronchitis virus,IBV)、传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)以及鸡星状病毒(chicken astrovirus,CAstV),均由中国动物卫生与流行病学中心国家禽流感专业实验室分离及保存。按照操作说明书,使用QIAamp Viral RNA Mini Kit 提取上述病毒RNA。
1.3 引物和探针设计
对GenBank 和GISAID 数据库中发表的以及本实验室分离保存的H5 亚型禽流感病毒HA 基因序列进行比对及构建进化树,针对分属于2.3.2.1分支及2.3.4.4 分支的HA 核苷酸序列,在其共同保守区设计引物,在两个分支的特异性区域分别设计探针,并对多条引物、探针进行组合及检验,从而筛选出最优引物和探针。
1.4 反应体系和条件
配制体系为20 μL 的荧光定量RT-PCR 反应液:在反应体系中依次加入2×One Step U+Mix 10.0 μL,RNase Free H2O 3.8 μL,引物H5-301F、H5-498R、2321P3、2344P 各0.8 μL(10 μmol/L),One Step U+Enzyme Mix 1.0 μL,最后加入RNA 模板2 μL。RT-PCR 反应条件设置为:55 ℃反转录15 min,95 ℃预变性30 s,然后进行40 个循环扩增(95 ℃ 10 s;60 ℃ 30 s,在此时收集荧光信号)。
1.5 实时荧光RT-PCR 方法优化
对反应体系中的不同引物和探针浓度组合(引物1.0、0.8、0.6、0.4、0.2 μmol/L,探 针1.0、0.5、0.4、0.3、0.2、0.1 μmol/L),反应体积(50、20 μL)及扩增反应参数(反转录5、10、15 min,退火延伸20、30 s)等反应条件进行摸索和优化,以达到最优组合。
1.6 特异性试验
采用上述优化后的反应体系及反应条件,分别检测H1、H2、H3、H4、H5(2.3.2.1 分支)、H5(2.3.4.4 分支)、H6、H7、H9、H10、H11 亚型AIV,以及NDV、IBV、ILTV、CAstV 等常见禽类病毒,检验该方法的特异性。
1.7 敏感性试验
使用上述引物分别对第2.3.2.1 分支和第2.3.4.4 分支的H5 亚型阳性毒株RNA 进行扩增,将得到的RT-PCR 反应产物进行琼脂糖凝胶电泳分析后进行测序。经测序结果比对,证实扩增产物为H5 亚型HA 基因序列,然后将RT-PCR 反应产物经胶回收后连接TOPO 载体,构建重组质粒TOPO-1923(2.3.2.1 分支) 和TOPO-G1778mH1(2.3.4.4 分支)。将重组质粒经核酸浓度测定仪测定浓度后,先分别稀释1 000 倍,再依次10 倍梯度稀释至10-10,分别取2 μL 作为反应模板,并做3 个重复进行检测,将所能检测到的最高稀释浓度换算成拷贝数。计算公式为:DNA copies/μL=[6.02×1023×最低检测浓度(ng/μL)×10-9]/(DNA碱基数×660)。
1.8 临床样品检测
利用上述建立的双重实时荧光RT-PCR 方法,对2020 上半年采集自某市3 个场点的100 份家禽(鸡、鸭)咽喉和泄殖腔双拭子样品进行检测,并将检测结果与普通RT-PCR 检测及测序结果进行比较,检验该方法的准确性。
2 结果
2.1 实时荧光RT-PCR 方法的建立及优化
利用本实验室保存的H5 亚型AIV 毒株进行多次验证,筛选出最适合的引物和探针(表1)。探针2321P3(针对2.3.2.1 分支)5'端标记HEX,3'端标记MGB;探针2344P(针对2.3.4.4 分支)5'端标记Cy5,3'端标记BHQ2。

表1 最适引物及探针序列
在双重实时荧光RT-PCR 反应体系中,通过对不同引物和探针的浓度组合、反应体积及扩增反应参数等条件进行摸索和优化,建立了可鉴别H5 亚型AIV 不同分支的双重荧光RT-PCR 检测方法。经过反复优化及验证,确定该双重实时荧光RTPCR 检测方法的最适反应体积为20 μL(其中模板2 μL),最适引物和探针浓度均为0.4 μmol/L;最佳反应条件为55 ℃反转录15 min,95 ℃预变性30 s,然后进行40 个循环扩增(95 ℃ 10 s;60 ℃30 s,在此时收集荧光信号)。试验结束后,根据Ct 值及荧光曲线判定结果:Ct ≤32,且出现典型的扩增曲线,样品判为阳性;无典型的扩增曲线并且无Ct 值,样品判为阴性;32 <Ct ≤36,且出现典型的扩增曲线,判为疑似样品,需进行重复检测。
2.2 实时荧光RT-PCR 方法特异性
特异性检测结果(图1)显示,仅2.3.2.1 分支及2.3.4.4 分支的H5 亚型AIV 出现了正常的荧光扩增曲线,对其他亚型AIV 及其他禽类病毒扩增结果均为阴性,表明该方法具有良好的特异性。

图1 H5 亚型AIV 不同分支双重实时荧光定量RT-PCR 方法特异性试验结果
2.3 实时荧光RT-PCR 方法敏感性
敏感性检测结果(图2)显示,该双重荧光定量RT-PCR 方法对于2.3.2.1 分支H5 亚型AIV,检测的最高稀释度为10-8,换算成拷贝数为495.0 copies/μL;对于2.3.4.4 分支H5 亚型AIV,检测的最高稀释度为10-9,换算成拷贝数为22.3 copies/μL。
2.4 临床样品检测
对100 份临床样品检测,发现阳性样品13 份,均为2.3.4.4 分支的H5 亚型AIV。对这些样品同时应用普通RT-PCR 及病毒分离方法检测,并送青岛睿博兴科生物技术有限公司测序,经序列比对及分析,与上述双重荧光实时定量RT-PCR 检测结果符合率为100%(图3)。
3 讨论
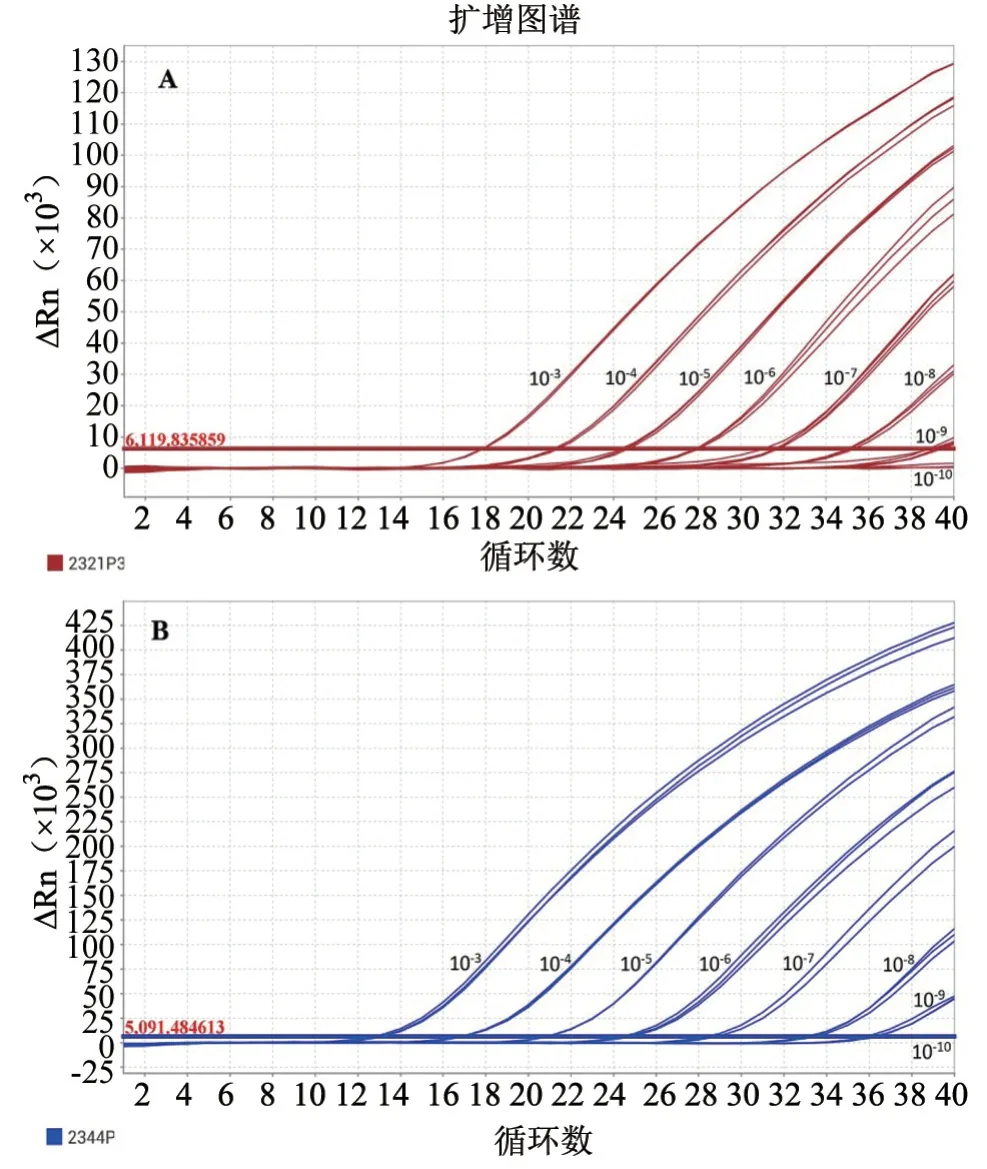
图2 H5 亚型AIV 不同分支双重实时荧光定量RT-PCR 方法敏感性试验结果
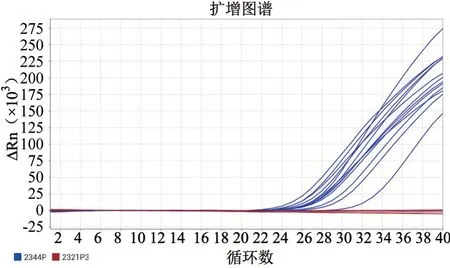
图3 H5 亚型AIV 不同分支双重实时荧光定量RT-PCR 方法临床样品检测结果
近几年,世界各地报告的HPAI 疫情均以H5亚型为主[18-21]。其中:2018 年世界范围内所报道的HPAI 疫情中,H5 亚型疫情比例高达99.1%;OIE 数据显示,2019 年H5 亚型疫情占总HPAI 疫情总数的85.8%。我国自1996 年首次分离到H5亚型HPAIV 至今,多个省份暴发过H5 亚型疫情,对养禽业造成了巨大经济损失[22-23]。据农业农村部官网信息,我国在2019 年发生的4 起HPAI 疫情中,3 起为H5 亚型,比例高达75%,其中2 起由第2.3.4.4 分支引起,1 起由第2.3.2.1 分支引起。
据本实验室调查,2015 年以来,我国流行的H5 亚型HPAIV 主要为第2.3.2.1 分支和第2.3.4.4分支,其中以第2.3.4.4 分支为主,第2.3.2.1 分支引起的疫情偶有发生。2015 年之后,已连续6 年未检测到第7 分支的病毒。
为了有效监测和控制H5 亚型HPAIV 的传播,许多实验室开发了相关诊断技术,如病毒分离、普通RT-PCR、传统的实时荧光RT-PCR 等[24]。病毒分离是流感病毒诊断的金标准,但是该方法耗时、费用高,不适合多亚型HPAIV 的鉴别。普通RT-PCR 检测耗时长,且具有开放操作环节,容易对周围环境造成污染。实时荧光RT-PCR 具有较高的敏感性和特异性,可用于病毒亚型鉴定,被广泛用于临床诊断[25]。为了检测和区分H5 亚型HPAIV,一些实验室开发了多重实时荧光RTPCR 方法[24,26-27]。然而,这些方法由于存在非特异性的交叉反应等缺陷,检测的特异性和敏感性较低[27]。
本研究筛选出的特异性引物和探针,可以对临床样品中的第2.3.4.4 分支和第2.3.2.1 分支病毒进行区分鉴别。这种一步法实时荧光RT-PCR 方法可以同时检测和区分两个分支的病毒且无交叉反应。为了提高靶基因检测的特异性,在2 个分支病毒的共同保守区设计了1 对引物,对不同分支各自的保守区设计探针。13 份H5 亚型HPAIV 阳性样品的Ct 值介于20~30。此外,所有使用本方法检测为H5 阳性的样品均经过测序并BLAST 验证正确。本研究建立的可同时鉴别H5 亚型HPAIV 所属分支的双重实时荧光RT-PCR 检测方法,经验证与其他亚型AIV 及常见禽病病毒无交叉反应,且具有快速、特异、敏感和重复性好等优点,可用于当前H5 亚型HPAIV 的快速检测和分支鉴别,对于HPAIV 的诊断和控制具有较高的临床使用价值。

