牛源多杀性巴氏杆菌PlpE蛋白的原核表达及多克隆抗体制备
张 智,刘 泽,乌吉斯古楞,刘重阳,权璞宏,任旭荣,宋庆庆,关平原
(1.内蒙古农业大学兽医学院,农业农村部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;2.金宇保灵生物药品有限公司,兽用疫苗国家工程实验室,内蒙古呼和浩特 010020)
多杀性巴氏杆菌病(Pasteurella multocidadisease)是由巴氏杆菌属细菌感染所致的传染病,在同种或不同动物间可以相互传染[1]。在过去,按照感染动物的名称把该菌分别称为马、牛、羊、禽、兔巴氏杆菌,之后统一称为多杀性巴氏杆菌。动物的急性型表现以败血性和组织器官的出血性炎症为特征,又称为出血性败血症。慢性型经常表现为各脏器的化脓性病灶,且多与其他病原混合或继发感染[2]。该病在全球各国广泛分布,以热带和亚热带国家最为严重。
巴氏杆菌属包含3 个亚种,即多杀亚种(Pasteurella multocidassp.multocida)、败血亚种(Pasteurella multocidassp.septica)及杀禽亚种(Pasteurella multocidassp.gallicida)[3]。多杀性巴氏杆菌是巴氏杆菌科巴氏杆菌属重要成员,可引起多种动物疫病,如牛、兔出血性败血症,猪萎缩性鼻炎以及禽霍乱等。多杀性巴氏杆菌血清型复杂,根据特异性荚膜抗原(K)吸附与红细胞上间接血凝试验的结果不同,分为A、B、D、E、F 5 个血清型。据报道[4],近年来引发牛多杀性巴氏杆菌病的巴氏杆菌血清型主要为A 型和B 型,且A 型多杀性巴氏杆菌的流行呈逐渐上升趋势,严重影响我国及世界畜牧业发展。
脂蛋白E(PlpE)是多杀性巴氏杆菌的一种外膜脂蛋白,是最早发现于溶血性曼氏杆菌的一种脂蛋白,具有粘附宿主细胞的作用[5]。研究[6]表明,重组PlpE 蛋白加入到疫苗制剂中,接种该疫苗的牛具有抵抗人工感染的能力。重组PlpE 在牛中具有高度免疫原性,使牛获得性免疫力显著增强,由此证实PlpE 是一种重要的保护性抗原。该蛋白分子量大小约39 kDa,可以在家禽和小鼠身上刺激产生良好的交叉保护性。
本试验拟通过扩增多杀性巴氏杆菌PlpE基因,构建pET-32a-PlpE 原核表达载体,通过诱导表达且纯化PlpE 蛋白,制备其多克隆抗体,以期为多杀性巴氏杆菌PlpE基因致病机制研究、诊断方法建立及疫苗研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验试剂 牛多杀性巴氏杆菌核酸、牛多杀性巴氏杆菌阳性血清,均由金宇保灵生物药品有限公司提供;感受态细胞BL21(DE3)、感受态细胞JM109、pET-32a、pMD-19T、琼脂糖凝胶回收试剂盒、蛋白Marker、T4 连接酶、限制性内切酶(BamH Ⅰ、Hind Ⅲ)等,均购自大连宝生物(Takara)有限公司;HRP 标记山羊抗牛IgG、HRP 标记鼠抗兔IgG,购自Sigma 公司;超敏型辣根过氧化氢酶DAB 显色试剂盒,购自上海生物生工有限公司;包涵体蛋白纯化试剂盒,购自康为世纪生物有限公司。
1.1.2 试验动物 2 月龄,体质量2~3 kg 的北京大耳白兔,由金宇保灵生物药品有限公司提供。
1.1.3 试验设备 生物安全柜、高速离心机、恒温培养箱、高速冷冻离心机、PCR 仪、聚丙烯酰胺凝胶电泳仪、超声波细胞破碎仪、紫外照胶仪等,均由金宇保灵生物药品有限公司提供。
1.2 方法
1.2.1 引物设计与合成 根据GeneBank 中登录的牛多杀性巴氏杆菌PlpE基因序列,使用Oligo 6 软件设计1 对特异性引物(上游引物F:5'-GGATCCTGTAGCGGTGGTGGCGGTAG-3';下游引物R:5'-AAGCTTTTATTGTGCTTGGTGACTTTTTTC-3'),预计扩增目的片段大小约1 050 bp。引物送上海生物生工有限公司合成。
1.2.2PlpE基因扩增及表达载体构建 PCR 扩增采用25 μL 反应体系:Mix 12.5 μL、ddH2O 8.5 μL、上游引物1 μL、下游引物1 μL、DNA 模板2 μL。反应程序为:首先94 ℃预变性5 min;94 ℃变性60 s,62 ℃退火60 s,72 ℃延伸90 s,进行35个循环;最后72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳分析鉴定。将目的片段与pMD-19T 连接,构建重组质粒pMD-19T-PlpE。使用BamH Ⅰ和Hind Ⅲ限制性内切酶对重组质粒pMD-19T-PlpE 和pET-32a 原核表达载体进行双酶切,酶切产物经1%琼脂糖凝胶电泳检测后分别进行胶回收;胶回收产物使用T4 连接酶进行连接,然后转化至大肠杆菌BL21(DE3)感受态细胞,活化后涂布在含有氨苄抗性LB 固体培养基上,倒置,37 ℃过夜培养。挑选单克隆菌落进行摇菌,提取质粒,使用BamH Ⅰ和Hind Ⅲ内切酶进行双酶切鉴定。
1.2.3 重组蛋白诱导表达 在培养好的LB 固体培养基上挑取单克隆菌落接种至10 mL 含有氨苄抗性的LB 培养基,37 ℃,180 r/min 过夜培养。取200 μL 菌液接种于200 mL 含有氨苄抗性的LB 培养基,37 ℃,200 r/min 培养5 h,在OD 值达0.6~0.8时,加入IPTG,37 ℃,200 r/min,诱导培养4 h。然后将IPTG 诱导表达后的菌液7 500 r/min,4 ℃离心20 min 后弃上清。按照菌体沉淀:PBS=1:10(V:V)比例加入PBS 重悬沉淀,充分混匀后进行超声破碎(超声循环50%,超声3 s,停5 s,超声破碎40 min)。之后10 000 r/min,4 ℃离心20 min,分离上清和沉淀,向沉淀中加入10 mL PBS 重悬。分别取上清和重悬后沉淀各60 μL 加入20 μL 4×Loading Buffer,煮沸10 min,进行SDS-PAGE 电泳检测以及考马斯亮蓝染色分析。
1.2.4 重组蛋白纯化 采用康为世纪生物有限公司包涵体蛋白纯化试剂盒纯化PlpE 蛋白。纯化效果通过SDS-PAGE 电泳检测以及马斯亮蓝染色分析。
1.2.5 重组蛋白Western Blot 鉴定 SDS-PAGE电泳结束后,在120 V,80 min 条件下进行电转移,转移结束后用5%脱脂乳4 ℃过夜封闭。使用PBST 缓冲液洗涤膜4 次,10 min/次;把牛多杀性巴氏杆菌阳性血清用PBST 缓冲液按照1:200 的比例稀释,将膜置于配好的稀释液中,室温反应2 h;使用PBST 缓冲液洗涤4 次,10 min/次;用PBST 缓冲液按照1:5 000 的比例稀释山羊抗牛的IgG 抗体(HRP 标记),将膜置于配好的稀释液中,室温反应2 h;使用PBST 缓冲液洗涤4 次,10 min/次;使用显色液显色并拍照。
1.2.6 多克隆抗体制备 选取状态较好的北京大耳白兔(2~3 kg/只)。免疫前观察1 周,耳静脉采血,检测抗体作为阴性对照。首次免疫,取纯化抗原与等量弗氏完全佐剂按照1:1 体积比充分混合,形成乳状液体,1 mL/只在腿部肌肉进行分点注射;14 d 后加强免疫,取纯化抗原与弗氏不完全佐剂等量乳化混合,腿部肌肉分点注射,1 mL/只;14 d 后再次进行免疫,条件同上。三免后14 d 心脏采血,分离血清测定抗体效价,所得血清即为多克隆抗体。
1.2.7 Western Blot 检测PlpE 蛋白多克隆血清反应性 目的蛋白SDS-PAGE 电泳结束后,转印至PVDF 膜上,用5%脱脂乳4 ℃过夜封闭。使用PBST 缓冲液洗涤4 次,10 min/次;把PlpE 蛋白多抗血清用PBST 缓冲液按照1:200 的体积比稀释,把膜置于配好的稀释液中,室温反应2 h;使用PBST 缓冲液洗涤4 次,10 min/次;用PBST缓冲液按照1:5 000 的体积比稀释鼠抗兔的IgG 抗体(HRP 标记),将膜置于配好的稀释液中,室温反应2 h;使用PBST 缓冲液洗涤4 次,10 min/次;使用显色液显色并拍照。
1.2.8 PlpE 蛋白多克隆抗体间接ELISA 效价测定采用上述纯化蛋白作为包被抗原,使用正交筛选法[7]确定最佳包被浓度,利用间接ELISA 方法测定所制备多克隆抗体效价。
2 结果
2.1 PlpE 基因扩增和重组质粒双酶切鉴定
经1%琼脂糖凝胶电泳检测,牛多杀性巴氏杆菌PlpE基因PCR 扩增大小为1 050 bp(图1),结果与预期大小一致。将pET-32a-PlpE 重组质粒进行双酶切鉴定,与预期结果相符合(图2)。
2.2 PlpE 蛋白表达
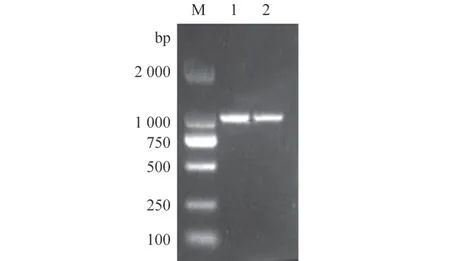
图1 PCR 扩增PlpE 基因结果
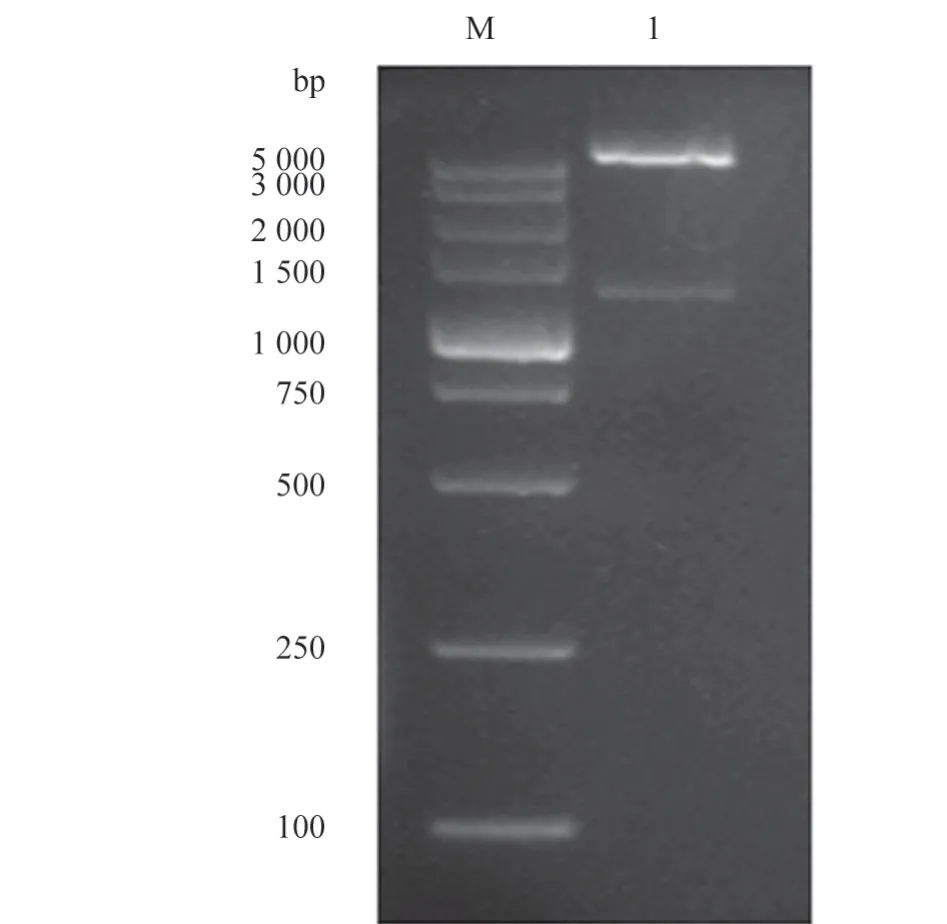
图2 重组质粒双酶切鉴定结果
将超声破碎后的样品离心后分离沉淀与上清,沉淀用适量PBS 重悬。将上清与重悬沉淀上样进行SDS-PAGE 电泳检测以及考马斯亮蓝染色分析。结果(图3~4)显示,PlpE 蛋白在56 kDa 处有明显条带,大小符合预期结果,且其主要表现为沉淀表达,上清中蛋白含量则较低。
2.3 蛋白纯化
参考康为世纪生物有限公司包涵体纯化试剂盒使用说明书,纯化PlpE 蛋白。采用SDS-PAGE电泳检测以及考马斯亮蓝染色分析蛋白纯化效果。结果(图5)显示,PlpE 蛋白纯化后条带单一,表明纯化效果良好。
2.4 Western Blot 检测
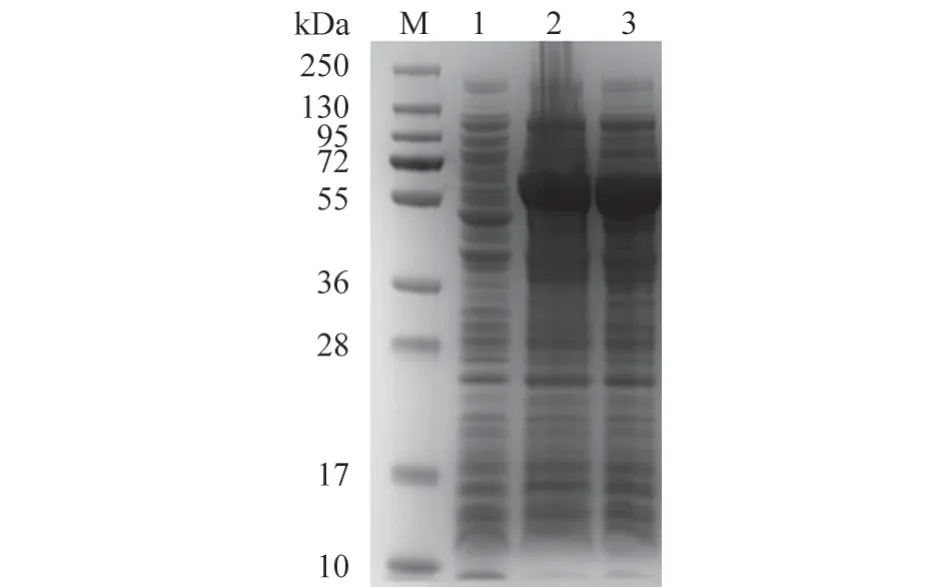
图3 IPTG 诱导前后PlpE 蛋白表达情况

图4 PlpE 蛋白在上清及沉淀中的表达情况

图5 PlpE 蛋白纯化后SDS-PAGE 电泳检测以及考马斯亮蓝染色分析
将纯化后的PlpE 蛋白进行SDS-PAGE 电泳、转膜以及脱脂乳封闭,次日孵育牛多杀性巴氏杆菌阳性血清、阴性血清和HRP 标记的山羊抗牛的IgG 抗体,结果(图6~7)显示,孵育牛多杀性巴氏杆菌阳性血清有明显的特异性条带,而阴性血清则没有出现条带,证明该蛋白有很好的反应性,且大小符合预期结果。
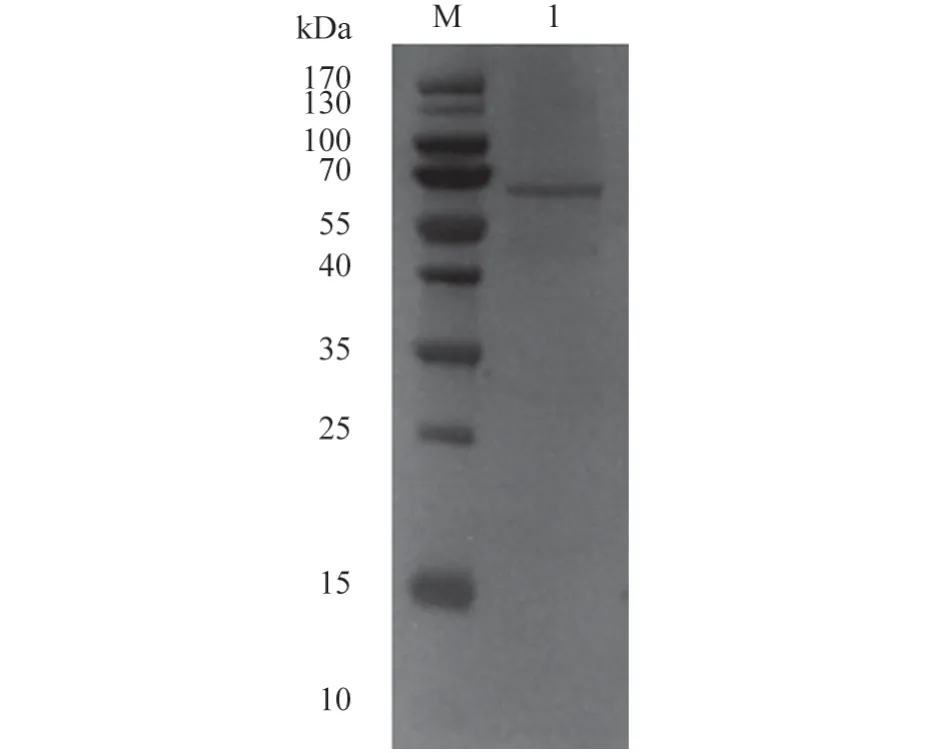
图6 牛多杀性巴氏杆菌阳性血清Western Blot 检测结果

图7 牛多杀性巴氏杆菌阴性血清Western Blot 检测结果
2.5 PlpE 蛋白多抗血清Western Blot 检测
使用制备的兔多克隆血清对PlpE 蛋白进行Western Blot 检测,在适宜条件下进行转膜后,孵育PlpE 蛋白多抗血清和阴性对照血清。结果(图8~9)显示,孵育PlpE 蛋白多抗血清显色后出现明显的特异性条带,而阴性对照血清则没有出现条带,说明制备的兔多抗血清与PlpE 蛋白反应性良好,PlpE 蛋白多克隆抗体成功制备。

图8 PlpE 蛋白多抗血清Western-Blot 检测结果

图9 PlpE 蛋白阴性血清Western Blot 检测结果
2.6 PlpE 蛋白多克隆抗体ELISA 效价检测
使用间接ELISA 法测定多克隆抗体效价,读取PlpE 蛋白多克隆抗体在OD450nm处的值(P)和阴性血清在OD450nm处的值(N),且当P/N>2.1时,所得多克隆抗体的最高稀释倍数为该多抗的效价[8]。结果(图10)显示,PlpE 蛋白多克隆抗体效价高达1:512 000。

图10 PlpE 蛋白多克隆抗体效价ELISA 检测结果
3 讨论
多杀性巴氏杆菌病是由多杀性巴氏杆菌所致动物传染病,急性型以败血性和组织器官的出血性炎症为特征。该病分布广泛,世界各地均有发生,给世界各国带来了重大经济损失[6,9]。黄园媛[3]等研究表明,巴氏杆菌脂蛋白E(PlpE)是最先从溶血性曼氏杆菌中发现的一种脂蛋白,有着粘附宿主细胞的作用。潘婷婷[10]等研究表明:重组蛋白PlpE 可以使牛产生很强的免疫保护,可增强疫苗诱导的免疫力;使用PlpE 蛋白进行免疫接种实验,对小鸡和小鼠均有较高的保护率,而且对于异源性攻击具有抵抗能力。高佳滨等[6]研究表明,重组PlpE 在免疫中是重要的,佐剂化的PlpE 可显著提高牛抵抗人工感染的能力。Carolina 等[11]报道,牛溶血性曼氏杆菌LKT 和PlpE 亚单位疫苗对小鼠的攻毒保护率可达86.7%,并可以诱导兔和羊产生相应抗体。
本试验采用大肠杆菌表达系统表达多杀性巴氏杆菌PlpE基因,并对重组蛋白进行纯化。Western Blot 检测结果显示,重组蛋白PlpE 可与牛多杀性巴氏杆菌阳性血清发生特异性结合,表明该蛋白具有良好的反应原性。利用该蛋白作为抗原成功制备出多克隆抗体,经ELISA 检测该多克隆抗体效价高达1:512 000。由于PlpE 蛋白主要在沉淀中表达且纯化所得浓度较高,因此制备的相应多克隆抗体在ELISA 试验中较敏感,这也与相关研究[12-14]结果一致。多杀性巴氏杆菌PlpE 蛋白的体外成功表达和多克隆抗体的成功制备,为下一步多杀性巴氏杆菌诊断方法的建立和疫苗研发奠定了基础。

