高中物理“氢原子光谱与玻尔模型”的教学尝试
鲁 斌
(浙江省余姚中学 浙江 宁波 315400)
1 引言
“氢原子光谱与玻尔模型”的内容,在人教版《物理·选修3-5》[1]教材中,分两节展开.第十八章第3节“氢原子光谱”中,介绍了光谱及光谱的分类、氢原子光谱的实验规律、经典理论的困难;在第4节“玻尔的原子模型”中,介绍了玻尔原子理论的基本假设、玻尔理论对氢光谱的解释、玻尔模型的局限性.笔者尝试,将两节内容合并为一节,先展现氢原子光谱的实验现象,再引入玻尔理论进行解释,使整堂课的结构更加完整.在此过程中,也应处理和考虑以下问题:
(1)突出主线,弱化对光谱分类、作用等相关内容的讨论.
(2)实验展示氢原子光谱的谱线.
(3)补充光栅方程、分光计等相关内容,定量测量氢原子光谱.
(4)比较自然地得到巴尔末公式.
(5)为巴尔末公式与玻尔理论搭建桥梁.
(6)补充角动量等内容,将玻尔理论的基本假设进行完备.
(7)推导里德伯公式,验证玻尔理论.
2 光谱
2.1 光谱的呈现
实验1:太阳光谱
用三棱镜展示太阳光谱.配合讲解:1665年,牛顿就发现了白光通过三棱镜后能够得到绚丽的光带,并把实验中得到的彩色光带叫做光谱.炽热的固体、液体、高压的气体的光谱,是由连续分布的一切波长的光组成的,这种光谱叫做连续光谱.
提问:是否所有物体发出的光谱都是连续谱?
实验2:钠的焰色反应
将蘸有食盐水的细铁丝放置于酒精灯的灯焰上,看到黄色的火焰,这就是化学课中提到的焰色反应.课件展示钠元素的光谱线,两条钠黄双线(图1)非常明锐.

图1 钠黄双线
师:只含有一些不连续的亮线的光谱叫明线光谱(线状谱).明线光谱中的亮线叫谱线,各条谱线对应不同波长的光.
实验3:光谱管组(图2)实验

图2 光谱管组
利用光谱管组,展示氢气、氮气、氩气、氦气、氖气、汞蒸气的放电现象.
由于每种原子都有自己的特征谱线,因此可以根据光谱来鉴别物质和确定的化学组成,这种方法叫做光谱分析.
课件展示元素的光谱线,如图3所示.
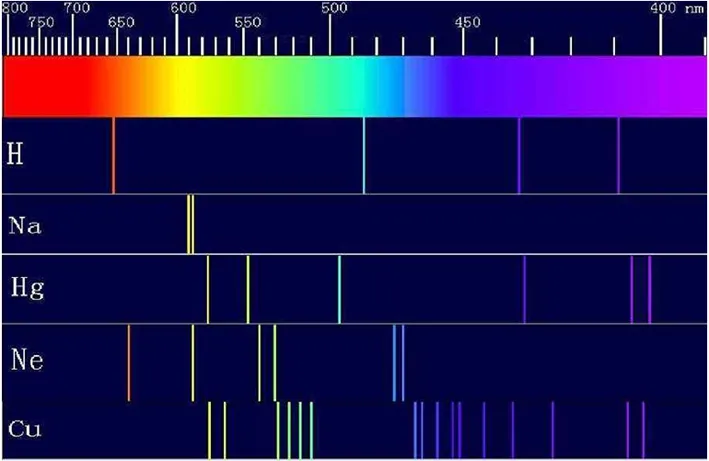
图3 连续谱与线状谱
我们得到了大量元素的谱线,并要对其进行研究、解释.由于氢原子具有最简单的结构,我们就从氢原子产生的光谱入手.
2.2 观察氢原子光谱
实验4:利用分光计观察氢原子光谱
调平分光计,将三棱镜放置于载物台上,点亮氢灯,实验装置图如图4所示.

图4 用分光计观察氢原子光谱
在望远镜处观察经过三棱镜折射的氢原子光谱如图5所示.

图5 氢原子光谱中的红色与绿色谱线
通过三棱镜我们观察到了4条分立的谱线:红色、绿色、紫色、淡紫色.
提问:这些光谱的波长为多少呢?
2.3 测量谱线波长
实验5:利用光栅测量氢原子光谱
由大量等宽等间距的平行狭缝构成的光学器件称为光栅.一般常用的光栅是在玻璃片上刻出大量平行刻痕制成,刻痕为不透光部分b,两刻痕之间的透光部分为a,相当于一狭缝.本次实验采用的光栅为1 mm刻600条线,光栅常数定义为
如图6所示,当平行光入射时,相邻透光部分的光程差为dsinθ,容易证明,当光程差满足

图6 光栅衍射光路图
dsinθ=kλ
(1)
式中k为整数,即可在P处产生明纹.
我们选取绿色光谱进行测量.其光栅的一级衍射角为16°55′,代入式(1),得到绿色光谱的波长为485.2 nm.通过相同的计算方法,我们可以得到氢原子光谱的其他谱线波长,如图7所示,并分别标记为Hα,Hβ,Hγ,Hδ.

图7 氢原子谱线波长
提问:从这些波长分布中,你能发现什么规律吗?
这看似是一个数学游戏,却包含着深刻的物理内涵.
3 巴尔末公式与里德伯常数
3.1 巴尔末的数学游戏
瑞士数学教师巴尔末也一直在研究这个问题,1885年,他发现了一个非常重要的公共因子[2]:364.6 nm,如果将氢原子的波长除以这个数,就会得到如下结果,如图8所示
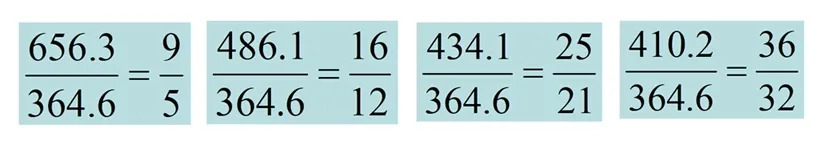
图8 呈现的计算结果
提问:你能从这些数据中得到它们满足的规律吗?
我们可以得到
(2)
式(2)即为巴尔末公式.
当然我们可以将公式进行处理
(3)
这个公式是否正确,需要通过实验进行检验,我们将n=7代入公式,算出了一条λ=397.0 nm的谱线,通过实验观察,果然观察到了这条谱线Hε,其波长为397.1 nm.
提问:巴尔末公式可以较好地解释氢原子光谱,那么公式背后的物理又是什么呢?我们怎么去理解这个公式?
3.2 里兹和里德伯
这时候出现了两个非常重要的物理学家,一位是瑞典物理学家、数学家里德伯,一位是瑞士理论物理学家里兹.
他们试着将公式倒过来,则式(3)为
则公式可总结为
(4)

提问:从这个公式中,我们能得到什么启发吗?
让我们仔细来端详这个公式[3]:
(1)包含两项.说明原子发光过程牵涉到两个对象,有初项与末项,即初态与末态.
(2)差值.两项由减号连接,这要求他们一定对应同一物理性质的不同状态,两者的落差决定发光的波长特征.这是一个类似“跳楼”的过程.
(3)整数平方.这个物理性质的数值要正比于整数平方的倒数.
如果我们能找到一个模型,且其满足上述3个要求的话,说不定能解释氢原子的发光.
4 玻尔理论及其解释
还记得此前普朗克和爱因斯坦已经确立了光能量量子的概念吗?此能量正比于光的频率,ε=hν把式(4)改写为
一切都变得豁然开朗了,氢原子里只有电子和质子,变化的是电子相对于质子的运动.如果电子的能量是个正比于整数平方倒数的量,电子从一个较高能量的状态跳跃(jump)到一个较低能量的状态,因为能量要守恒,假设能量差对应发射光的能量量子,则氢原子光谱的特征就能得到解释.
1913年,年轻的丹麦人玻尔就是这么想的.为了解释氢原子光谱,他提出了3条基本假设.
4.1 定态假设
假设氢原子中,电子绕着原子核做圆周运动,库仑力提供电子做圆周运动的向心力.按照经典物理学,电子做圆周运动属于变加速运动,会辐射电磁波损耗能量,因此电子绕核转动这个系统是不稳定的,电子会失去能量,最后一头栽到原子核上(图9),但事实不是这样,原子是个很稳定的系统.
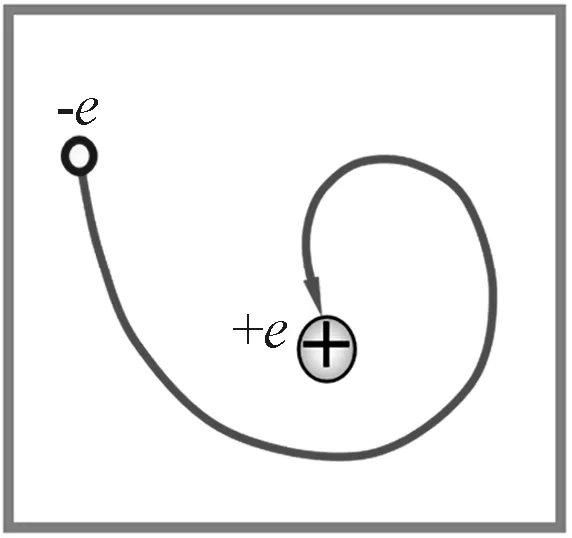
图9 不稳定的轨道
为了解决这个问题,玻尔提出了“定态假设”.原子中的电子只能在一些半径不连续的轨道上(图10)做圆周运动.在这些轨道上运动的电子不辐射(或吸收)能量而处于稳定状态,称为“定态”.

图10 定态轨道
假设电子只能在定态轨道r1,r2,…,rm,rn运动,则电子的环绕规律为
(5)
4.2 频率条件假设
光辐射是怎么产生的呢?
由于每个轨道都对应有不同的能量,电子从某一定态向另一定态跃迁时将发射(或吸收)光子.若电子在轨道rn处的能量为En,在轨道rm处的能量为Em,从轨道rn向rm跃迁时,能放出频率为ν的光子(图11),满足
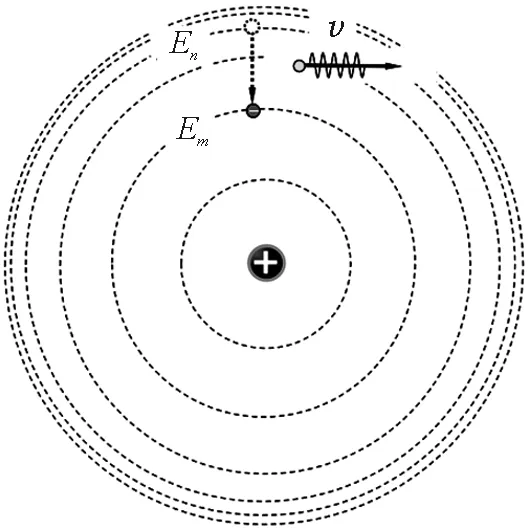
图11 跃迁
ε=hν=En-Em
(6)
4.3 角动量量子化条件假设
那么,能量为什么会分立呢?
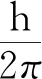

图12 角动量量子化

(7)
此为角动量量子化假设.
4.4 理论求解
根据以上假设,我们如何解释氢原子光谱的规律呢?
联立式(5)、式(7),消去vn,得到
(8)
可见,轨道是量子化的.电子在定态轨道上的机械能为
(9)
将式(8)代入式(9)
(10)
为了得到巴尔末公式与里德伯常数,则
(11)
令n=2,即可得到巴尔末公式,里德伯常数的理论值与实验值几乎一致.由此也成功解释了氢原子光谱.
4.5 玻尔理论的局限性
至此,氢原子光谱有了合理的解释.科学的发展离不开一代又一代人的努力.然而,玻尔理论真的正确吗?
玻尔理论成功地解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.玻尔理论在解决核外电子的运动时成功引入了量子化的观念,同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律.除了氢原子光谱外,在解决其他问题上遇到了很大的困难,例如氦原子光谱.为什么电子要在定态的轨道上运动呢?为什么定态轨道上不会辐射电磁波呢?为什么要求角动量一定是普朗克常数的整数倍呢?为什么电子会像行星一样限制在一个平面内运动呢?物理模型在解决一些问题的同时总会带来新的问题.
5 结束语
本堂课通过对氢原子光谱的研究,从实验现象和理论解释入手,试图还原历史发展的脉络,力图展现科学探究过程中的偶然性与必然性.对于高中学生而言,从高考层面,只要能够利用能级差计算光子频率即可.对于氢原子光谱的产生、测量、玻尔理论涉及的具体内容和数学推导并不要求.但从核心素养层面,经历实验探究,培育科学思维,是物理课堂的重要使命.在此之后,大师辈出,薛定谔、海森伯、泡利、费米、德布罗意、狄拉克、波恩等等科学家前赴后继,逐步发展和完善量子力学的框架,才有现在的信息社会.

