温和灸联合间充质干细胞移植对大鼠损伤肛门括约肌功能的修复*
李 鹏 金文琪 李小嘉 丁旭枫 朱煜璋 杨 镛 郭修田
(上海中医药大学附属市中医医院,上海 200071)
大便失禁是指机体对液体、固体内容物以及气体的蓄控能力的降低或丧失,不能随意控制内容物的溢出,导致大便次数增多,轻者粪便污染内裤,重者完全排出。肛门括约肌损伤引起的结构和功能的破坏会导致大便失禁,它不仅给患者带来极大的痛苦及心理障碍,还会严重影响患者的生活质量。大便失禁影响着5.9%的人口,随着年龄的增加失禁的风险逐渐增大[1]。虽然目前对于大便失禁的治疗方法多种多样,包括饮食疗法、口服药物、膨胀剂注射、盆底神经刺激,生物反馈甚至手术治疗等[2],但是随着时间的延长,复发率却逐年增高,疗效均不理想,使患者的身体及心理上的创伤也被放大,严重影响日常生活。
干细胞的多向分化潜能、归巢机制、分泌生物活性因子等优势使其在组织修复再生医学中发挥着重要作用[3]。在一些动物及临床研究中,细胞疗法与生物工程技术作为一种无创的治疗手段已应用于肛门括约肌组织的修复与再生[4]。但是许多研究也证实经静脉注射的间充质干细胞出现在肺脾肾分布,大部分被清除,只有少部分可到达损伤部位。笔者前期研究证实温和灸不仅可促进间充质干细胞的归巢[5],还可调节大鼠肛瘘术后创面组织局部血流、肉芽组织中血管内皮生长因子(VEGF)的表达从而促进组织修复[6]。因此,笔者将温和灸与骨髓间充质干细胞(BMSC)移植联合应用于大鼠损伤的肛门括约肌,观察不同时间节点对损伤括约肌结构和功能的修复效果。
1 材料与方法
1.1 实验动物 健康SD雌性大鼠120只,年龄约12周,体质量200~250 g,SPF级,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2012-0002。大鼠BMSC制备方法:麻醉大鼠后,穿刺股骨骨髓腔抽取骨髓,DMEM-F12稀释后接种在DF-12胎牛血清培养液中,并放入37℃、5% CO2、饱和湿度的培养箱中培养。每2~3天更换新鲜培养基。收集第三代消化后含有1×107的细胞悬液备用。
1.2 试药与仪器[1]干细胞培养基及胎牛血清均选用Gibco公司的试剂(DMEM/F-12培养基,型号:12660-012;胎牛血清,型号:10091-148),盐酸布比卡因选用山东华鲁制药有限公司,型号为H37022106,Masson染色试剂盒购于Baso公司(型号:BA4079A,BA4079B)。艾条选用佛山市艾传医疗器械有限公司(李时珍蕲艾条,型号:1.8 cm×20 cm)。显微镜分别采用德国OLYMPUS解剖显微镜(型号:CX23)及激光共聚焦显微镜(型号:OLS5000),肛压检测采用成都仪器厂出产的多道信息采集处理系统(型号:RM6240BDJ型),大鼠球囊检测装置采用专利(专利号:ZL 2018 2 0913781.7)。
1.3 分组与造模 健康SD雌性大鼠120只随机分为5组,每组24只,分别为空白对照组、温和灸加干细胞组、干细胞组、温和灸组与假手术组。各组大鼠肛门括约肌损伤均采用Zusthi模型,在腹腔麻醉后,于解剖显微镜下进行大鼠腹侧纵行切除25%的肛门括约肌复合体,即切除10点位到2点位之间的括约肌复合体,术后采用压迫止血及布比卡因(0.5 mg/kg)镇痛。所有需采用干细胞及温和灸治疗的组别均采用以上方式治疗,其中空白对照组大鼠不做任何治疗;温和灸加干细胞组大鼠在干细胞注射完成后立即进行温和灸治疗;干细胞组大鼠仅局部注射0.3 mL PBS(含107个BMSCs);温和灸组大鼠仅采用温和灸局部治疗15 min;假手术组仅造模,不做任何治疗。
1.4 干预方法 干细胞注射:在大鼠括约肌损伤处及缺损两侧断端边缘直接注射,共0.3 mL PBS(含107个BMSCs),每个部位1/3细胞量。温和灸治疗:将点燃的蕲艾条放置距大鼠肛门约2 cm温和灸大鼠肛门局部创面,治疗15 min。所有治疗均从造模后第1日开始,每日1次,连续7 d。空白对照组:不做任何治疗。温和灸加干细胞组:在大鼠括约肌损伤处基底部及两侧断端各注射0.1 mL PBS(共0.3 mL PBS,含107个BMSCs),然后将点燃的艾条直对干细胞注射处(即括约肌损伤处)进行治疗,时间15 min,每日1次,连续7 d。干细胞组:仅在大鼠括约肌损伤处基底部与两侧断端各注射0.1 mL PBS(共0.3 mL PBS,含107个BMSCs),每日1次,连续7 d。温和灸组:将点燃的艾条放置于距括约肌损伤处2 cm的部位进行局部治疗,时间为15 min,每日1次,连续7 d。假手术组:仅造模,不做任何治疗。
1.5 标本采集与检测 1)大鼠肛门括约肌功能检测:包括静息压、收缩压与肌电振幅、频率,均在造模后7、14、28 d进行测定。采用多道信息采集处理系统的不同检测模块,记录并分析不同时间节点各组的功能指标。在大鼠腹腔注射麻醉后,将1个特制的球囊润滑后完全放入大鼠肛内以进行括约肌压力检测,球囊插入深度为球囊淹没后0.5 cm,球囊连接注射器与采集处理系统,每次注水0.8 mL扩张球囊以检测肛压。选取压力通道,设置参数后每只大鼠检测时间为波形稳定后15 min。保存所有文件,分别选取稳定波峰及基线值记录为收缩压与静息压。检测肌电,将两只30号US53153型同轴电针分别插在大鼠肛门3、9点位,深度约0.4 cm,电极夹连接采集系统,选取生物肌电模式进行检测。设置参数后每只大鼠检测时间为波形稳定后15 min。保存所有采集文件,为了定量肛门括约肌EMG动作电位的振幅和频率,在每个节点的检测波形中随机选取5个5 s的时间间隔计算平均值,并设定一个高于噪音但低于动作电位的临界值以定量动作电位的频率。统计波形穿过此阈值的动作电位的振幅和频率。2)组织形态学检测:麻醉处死大鼠,解剖显微镜下剥离肛门括约肌(距离肛缘0.5~1 cm),制作为石蜡切片并进行Masson染色。染色完毕后采用共聚焦显微镜扫描全部组织。采用Image J进行肌肉及胶原纤维定量分析以比较各组的差异。
1.6 统计学处理 应用SPSS21进行统计分析,所有计量资料都进行正态性与方差齐性检验,实验数据统一以()表示。若资料满足正态性、方差齐性与“球对称”假设,采用重复测量资料的方差分析。采用one-way ANOVA联合组间比较检验评价各组之间的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肛门括约肌压力值比较 见表1。术后第7天,3组治疗组的收缩压均显著高于假手术组,差异具有统计学意义(P<0.05),但治疗组组间无显著差异。术后14 d,温和灸加干细胞组的收缩压显著高于其他两治疗组,具有显著差异(P<0.05),但干细胞组与温和灸组之间无显著差异(P>0.05)。术后28 d静息压均较术后14 d增高,且温和灸加干细胞组仍显著高于干细胞组、温和灸组、假手术组3组(P<0.05),但干细胞组、温和灸组两组间仍无显著差异(P>0.05)。在术后14 d时,干细胞组、温和灸组、假手术组、温和灸加干细胞组4组的静息压均较前增高,此时所有治疗组肛管静息压均显著高于假手术组,差异具有统计学意义(P<0.05),但3组治疗组组间仍无显著差异(P>0.05)。在术后28 d时,温和灸+干细胞组的静息压虽显著高于干细胞组与温和灸组,但却仍低于空白对照组。
表1 各组大鼠肛管收缩压与静息压比较(mmHg,±s)
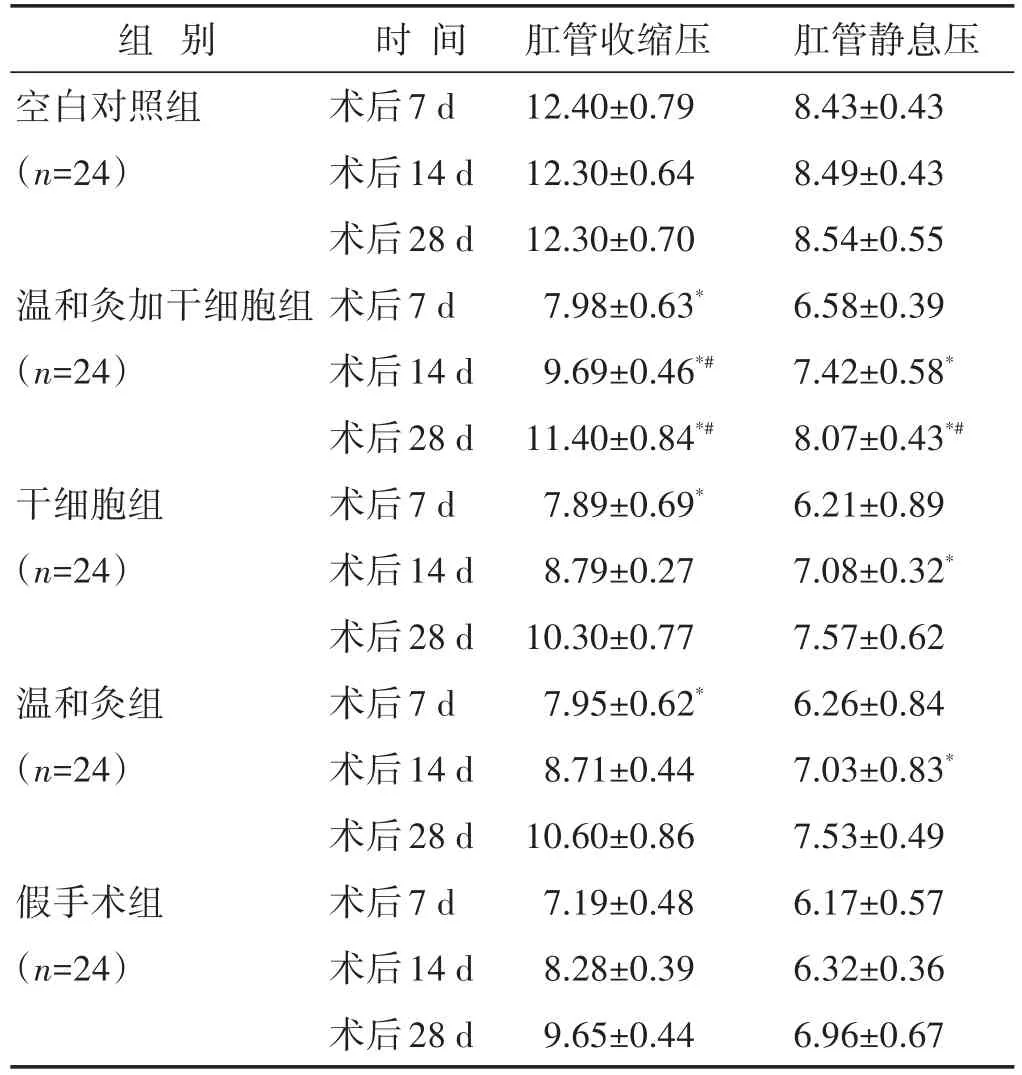
表1 各组大鼠肛管收缩压与静息压比较(mmHg,±s)
与假手术组同期比较,*P<0.05;与干细胞组、温和灸组同期比较,#P<0.05。下同
组别空白对照组(n=24)温和灸加干细胞组(n=24)干细胞组(n=24)温和灸组(n=24)假手术组(n=24)肛管静息压8.43±0.43 8.49±0.43 8.54±0.55 6.58±0.39 7.42±0.58*8.07±0.43*#6.21±0.89 7.08±0.32*7.57±0.62 6.26±0.84 7.03±0.83*7.53±0.49 6.17±0.57 6.32±0.36 6.96±0.67时间术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d肛管收缩压12.40±0.79 12.30±0.64 12.30±0.70 7.98±0.63*9.69±0.46*#11.40±0.84*#7.89±0.69*8.79±0.27 10.30±0.77 7.95±0.62*8.71±0.44 10.60±0.86 7.19±0.48 8.28±0.39 9.65±0.44
2.2 各组大鼠肛门括约肌肌电指标比较 见表2。在术后14 d时,3组治疗组的肌电振幅显著假手术组,差异具有统计学意义(P<0.05)。在术后28 d时,温和灸加干细胞组的振幅显著高于干细胞及温和灸组,差异具有统计学意义,但仍低于空白组,此时干细胞与温和灸组仍无明显差异(P>0.05)。术后14 d,干细胞组、温和灸组、假手术组3组的肌电频率均显著高于假手术组,并且温和灸加干细胞组肌电频率显著高于干细胞组及温和灸组,差异具有统计学意义(P<0.05)。并且这种差异一直持续到术后28 d。在术后28 d时,虽然温和灸加干细胞组肌电频率显著高于其他治疗组,但仍低于空白组,差异具有统计学意义。
表2 各组大鼠肛门括约肌肌电指标比较(±s)
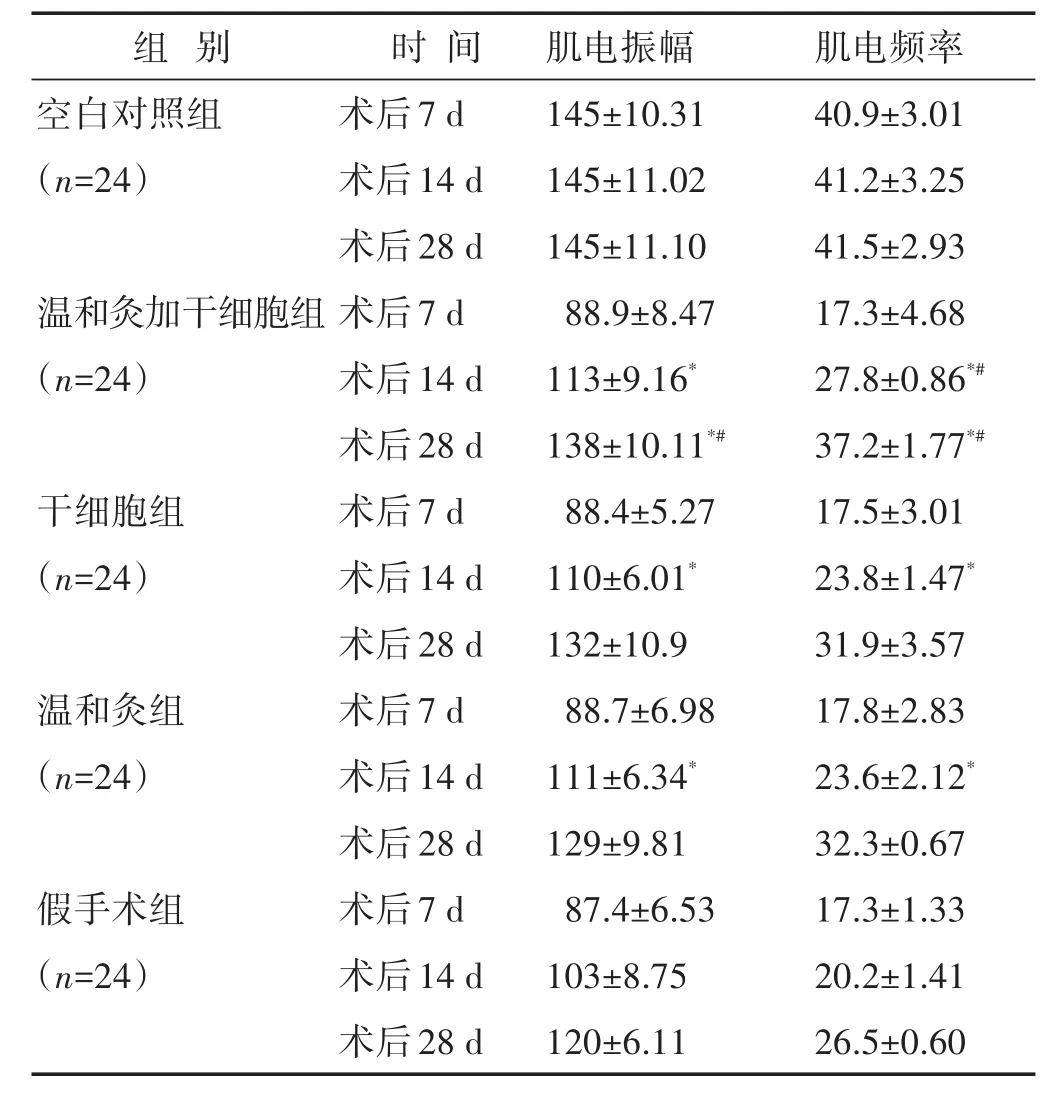
表2 各组大鼠肛门括约肌肌电指标比较(±s)
组 别 时 间 肌电振幅 肌电频率空白对照组(n=24)温和灸加干细胞组(n=24)干细胞组(n=24)温和灸组(n=24)假手术组(n=24)术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d术后7 d术后14 d术后28 d 145±10.31 145±11.02 145±11.10 88.9±8.47 113±9.16*138±10.11*#88.4±5.27 110±6.01*132±10.9 88.7±6.98 111±6.34*129±9.81 87.4±6.53 103±8.75 120±6.11 40.9±3.01 41.2±3.25 41.5±2.93 17.3±4.68 27.8±0.86*#37.2±1.77*#17.5±3.01 23.8±1.47*31.9±3.57 17.8±2.83 23.6±2.12*32.3±0.67 17.3±1.33 20.2±1.41 26.5±0.60
2.3 各组大鼠肛门括约肌组织形态学检测 见表3,图1。在术后28 d时,Masson染色证实所有组别均仍有不同程度的环形缺损,但温和灸加干细胞组已非常接近完整的环形,它的缺损面积明显小于其他组别,缺损部位含有更多红染的新生肌纤维,而C、D、E 3组缺损部位均显示更多蓝染的胶原纤维。定量分析肌肉面积百分比:温和灸加干细胞组肌肉比例显著高于其余3组,差异具有统计学意义,但仍低于空白组(P<0.05)。
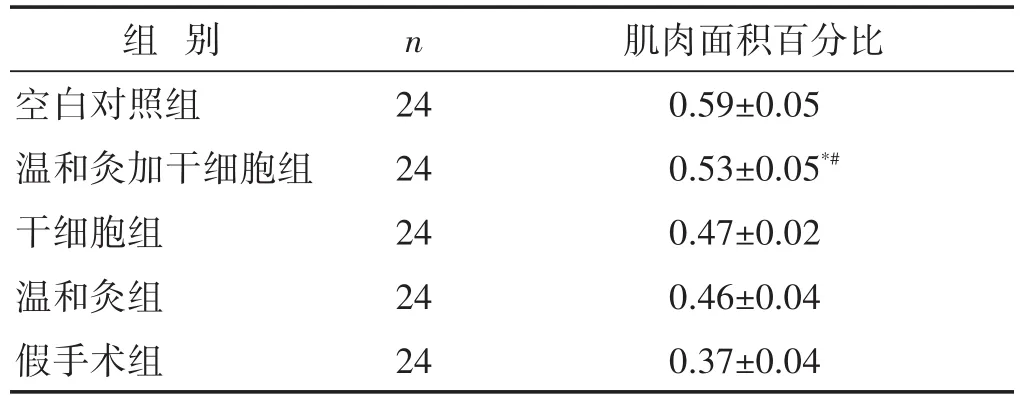
表3 各组大鼠术后28 d肛门肌肉面积百分比(%)
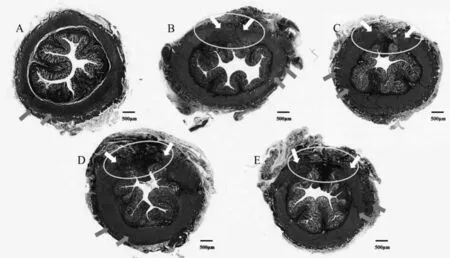
图1 各组造模后28 dMasson染色全景图
3 讨 论
组织的结构与功能相辅相成,结构的完整才能保证功能的正常行使,功能的正常依赖于完整的结构,肛门括约肌亦是如此。作为协调排便机制中的一种,肛门括约肌结构或功能的破坏会影响肠内容物的正常排出,而肛门括约肌的结构和功能则需要肌肉和神经的完整性,其中肛门括约肌损伤引起的大便失禁最为普遍。近年来,干细胞在组织修复与再生医学方面的研究日新月异,因其多向分化潜能、旁分泌潜能、免疫调节与抑制潜能、便捷的分离与扩增等四大特性广泛应用于各种组织工程学研究[7-9]。
骨髓间充质干细胞作为成体干细胞中的一种,在再生医学领域受到广泛重视[10-11]。虽然干细胞对大鼠损伤肛门括约肌的显著的修复效果,但不同的研究结果差异较大。近年来许多研究证实移植的干细胞在创面的存活率与定植率并不能达到满意的效果,而经静脉注射的间充质干细胞出现在肺脾肾分布,大部分被清除,只有少部分可到达损伤部位,严重影响创面的修复作用。因此许多学者采用不同的方法以促进干细胞在创面的定植与存活率,包括与其他细胞共培养,生物材料或机械应力的使用等[12-17]。中医学认为创面愈合的根本为正气虚损,而温和灸具有温通气血、扶正祛邪的功效,而且我们前期研究证实温和灸不仅能够促进骨髓间充质干细胞向损伤部位归巢[5],还可调节大鼠肛瘘术后创面组织局部血流、肉芽组织中VEGF的表达从而促进组织修复。
因此,基于温和灸的温通效应及归巢机制,我们将温和灸与骨髓间充质干细胞移植联合应用于大鼠损伤的肛门括约肌,发现温和灸联合干细胞不仅可显著促进大鼠肛门括约肌肛压与肌电的恢复,还能促进肛门括约肌缺损部位肌肉新生及环形结构的恢复,从组织结构和功能两方面研究证实温和灸加干细胞移植显著优于单纯干细胞移植与温和灸治疗。但本研究也存在一些缺陷,由于观察节点(28 d)的限制,所有治疗组肛门括约肌组织均未恢复为正常的完整环形组织,虽然温和灸+干细胞组大鼠的肛门括约肌趋于完整的环形组织,但仍有部分缺损,这可能也是导致治疗组肛压与肌电低于空白对照组的主要原因。但无论从功能性指标,抑或是组织形态学来分析,温和灸与干细胞移植联合应用的治疗效果显著高于其他治疗组别。但是其中的机制是否与温和灸促进干细胞的定植或分化,抑或与增强干细胞旁分泌效果有关仍未可知,未来仍需要更多更深入的实验探索其相关机制。

