血清PCT对血流感染患者病原菌分布的鉴定作用研究
李翠 段永亮 张美 陈其霞 李冬梅
血流感染是临床上一种非常严重的全身感染性疾病,若不能及时诊断并给予有效治疗,病情可迅速发展,严重威胁患者的生命安全[1]。研究[2]报道,血流感染是重症监护病房常见院内感染类型之一,发病率在30%~40%,病死率高达30%。血培养是临床诊断血流感染的金标准,但目前研究结果证实,血流中含菌量低、血液中存在抗菌物质、抗生素过度使用及血培养的临床实践欠规范等因素,均可影响血培养结果,且血培养耗时较长,不利于及时诊断和治疗,影响患者预后[3]。降钙素原(Procalcitonin, PCT)是近年来研究较多的细菌感染的敏感指标之一,在细菌感染性疾病的鉴别诊断中具有良好的灵敏度和特异度[4]。早期诊断血流感染并评估病原菌种类对指导早期抗菌药物合理使用及患者的转归具有重要意义,故本研究拟分析PCT在不同病原菌感染所致血流感染时检测结果的差异性,评价其在鉴别血流感染患者病原菌种类的临床价值,为起始抗感染经验治疗方案的制定提供参考价值。现将研究结果报道如下。
资料与方法
一、一般资料
采取回顾性分析的方法进行研究,选取2018年1月~2019年12月我院收治的血流感染患者,纳入标准:①临床确诊为血流感染,诊断参照2001年卫生部颁布的《医院感染诊断标准(试行)》[5]中关于血流感染的诊断标准;②血培养分离出单一菌株;③采集血培养及PCT检测标本前未使用抗生素治疗,且血培养及PCT检测标本采集时间<24 h;④年龄>18岁;⑤临床资料完整;⑥了解本研究相关事项,并签署了书面知情同意书。排除标准:①合并其他血液系统恶性疾病;②心脏、器官移植、腹部等大手术后1周内或合并多发性创伤、大面积烧伤等可能影响血清PCT检测结果者;③合并其他慢性感染、恶性肿瘤及严重脏器功能损害;④入院前1个月内曾使用过特殊药物治疗,如免疫抑制剂、激素等;⑤妊娠期、哺乳期妇女。本研究共纳入512例血培养阳性的血流感染患者,其中男261例,女251例,年龄18~79岁,平均(55.27±17.38)岁。
二、方法
1 血培养
所有操作均严格按照无菌操作程序进行。需氧瓶、厌氧瓶均采集患者静脉血8~10 mL,2 h内送检。采用Bact/ALERT 3D 240型全自动血培养分析仪(法国梅里埃生物公司)进行培养,血培养结果阳性者,将培养液转移接种于血平板、中国蓝平板和沙氏斜面培养基,采用API细菌生化鉴定系统及BioMerieux VITek2 Compact 全自动细菌鉴定仪完成菌种鉴定,并排除污染菌。
2 血清PCT检测
所有研究对象均于采集血培养标本的同时无菌采集静脉血4 mL,于室温条件下静置60 min,随后离心(4 000 rpm)10 min,留取血清待测。采用生物梅里埃PCT检测仪及原装配套试剂检测血清PCT 浓度,所有操作按照试剂盒使用说明严格进行。血清PCT水平以≥0.5 ng/ml为阳性阈值。
3 分组
将上述患者根据血培养结果分为革兰阴性菌感染组(G-菌组)、革兰阳性菌感染组(G+菌组)和真菌组,收集所有研究对象年龄、性别、体质指数(Body Mass Index, BMI)等基本情况,并进行组间比较。
三、质量控制
①制定明确的纳入标准、排除标准及研究对象的筛选流程,并严格按照上述标准和流程纳入研究对象。②所有研究对象血培养检测、菌种鉴定及血清PCT水平检测均由我院检验科同一批经验丰富的医生进行检测,确保数据的准确性。③认真详实核对研究对象的基本信息及相关数据,以确保收集信息和资料的真实性、完整性。④采用双轨录入法录入数据资料,录入后进行核对、补漏、校正,以确保数据的可靠性和真实性。
四、统计学数据处理
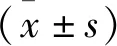
结 果
一、血流感染患者病原菌分布情况
本研究共纳入512例血培养阳性的血流感染患者,其中G-菌348例,占67.97%,以大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌等为主;G+菌133例,占25.98%,以凝固酶阴性葡萄球菌、金黄色葡萄球菌、肠球菌属等为主;真菌31例,占6.05%。根据血培养结果将上述患者分为G-菌组、G+菌组和真菌组,其中G-菌组348例,男176例,女172例,年龄18~78岁,平均(55.31±17.45)岁;G+菌组133例,男70例,女63例,年龄18~79岁,平均(55.25±17.19)岁;真菌组31例,男17例,女14例,年龄18~79岁,平均(55.26±17.20)岁。三组患者在性别、年龄等一般资料上比较,差异均无统计学意义(P>0.05)。上述患者病原菌分布情况(见表1)。

表1 血流感染患者病原菌的分布(n=512)
二、血流感染患者不同菌种感染者血清PCT水平的比较
G-菌组患者血清PCT水平明显高于G+菌组、真菌组患者,差异均具有统计学意义(P<0.05)。PCT阳性率也明显高于G+菌组、真菌组患者,差异均具有统计学意义(P<0.0167)。G+菌组患者血清PCT水平明显高于真菌组患者,差异均具有统计学意义(P<0.05),但G+菌组患者PCT阳性率与真菌组无显著性差异(P>0.0167)(见表2)。

表2 三组患者血清PCT水平及PCT阳性率的比较
三、血清PCT水平鉴别不同菌种感染的ROC曲线分析
当血清PCT Cut-off值分别为7.02 ng/mL、0.95 ng/mL、1.07 ng/mL时,血清PCT水平鉴别G-菌与G+菌、G-菌与真菌、G+菌与真菌的检测效能最优,ROC AUC分别为0.68、0.73、0.64(见表3、图1)。
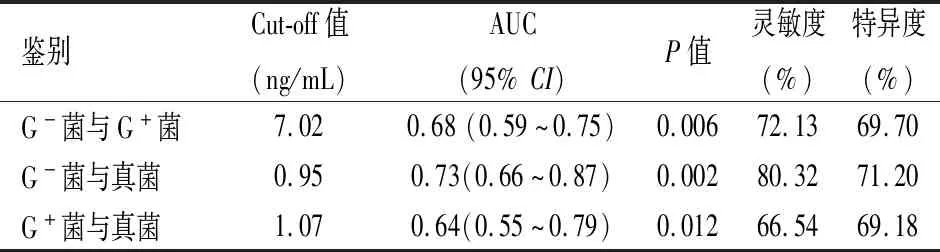
表3 血清PCT水平在不同菌种感染鉴别中的检测效能

图1 血清PCT水平鉴别不同菌种的ROC曲线分析(A:G-菌与G+菌;B:G-菌与真菌;C:G+菌与真菌)
讨 论
早期诊断和识别病原体困难致丧失及时抗菌治疗时机是血流感染患者病死率高的原因之一。因此,早期鉴别不同病原体所致血流感染可指导起始抗菌药物合理使用,在改善患者预后、降低病死率方面具有重要积极作用。本研究512例血流感染患者血培养分离到的病原菌中,以G-菌为主,占67.97%,其次为G+菌,占25.98%,仅6.05%为真菌,这与卫生部全国细菌耐药监测网近年来的检测数据显示G-菌是血流感染的优势菌种的结果相符[6],而主要病原菌的组成略有不同,可能与血流感染患者病原菌的分布存在人群和区域的差异有关。
PCT是降钙素前肽,是一种无激素活性的糖蛋白,在正常代谢情况下,人体内PCT分泌量极少,但在病原体感染后PCT浓度显著升高[7]。已有较多研究[8-9]证实,PCT对于细菌感染具有较高的灵敏度。本研究结果显示,G-菌组血清PCT水平及阳性率均明显高于G+菌组、真菌组,而G+菌组血清PCT水平高于真菌组,与文献报道[10]一致。与G+菌和真菌不同,大多G-菌的细胞壁上含有内毒素,而内毒素是诱导PCT产生的最主要刺激因子。G-菌感染进入血流时,一方面通过诱导全身性炎症反应,引起PCT合成和释放增多,另一方面其细胞壁上的内毒素可直接刺激机体,诱导PCT-mRNA翻译产生PCT[11]。李宇等[12]研究结果显示,PCT在G-菌所致肺炎的诊断中有显著意义,而对G+所致肺炎诊断意义不大,提示了PCT产生机制与G-菌释放的内毒素相关。因此,检测血清PCT水平可能有助于区分不同病原菌所致血流感染。
本研究在血清PCT水平鉴别不同菌种感染的ROC曲线分析中,得到最佳阈值分别为7.02 ng/mL、1.07 ng/mL时,血清PCT水平鉴别G-菌与G+菌和G+菌与真菌所致血流感染的AUC分别为0.68、0.64,灵敏度、特异度均不高,提示血清PCT水平可区分G-菌与G+菌和G+菌与真菌所致血流感染,但鉴别诊断性能较弱。而在最佳阈值为0.95 ng/mL时,血清PCT水平鉴别G-菌与真菌所致血流感染的AUC为0.73,灵敏度、特异度分别为80.32%、71.20%,提示血清PCT水平对G-菌与真菌所致血流感染的鉴别诊断中有一定的价值。国内一项监测ICU感染者的PCT动态变化的研究[13]表明,与G+菌、真菌感染比较,G-菌感染下的PCT含量的波动范围最广,峰值最高。同时也研究[14]PCT含量除了在不同病原体感染间存在差异,还可能与细菌负荷和感染严重程度有关,即细菌负荷越大,刺激机体分泌PCT越多。因此,本研究推测血清PCT水平对不同病原体所致血流感染的鉴别诊断效能不佳,可能与PCT水平受病原体种类、感染时间、细菌负荷等多种因素影响有关。
血清PCT水平检测在不同菌种所致血流感染的鉴别诊断中有一定的应用价值,对于病原菌种类的评估具有辅助作用,在实际临床应用时需结合患者的相关临床表现进行综合判断。本研究也存在一定的局限性。首先,本研究缺乏血培养阴性患者作为对照组,其次,未对血流感染患者血清PCT水平进行动态监测,仅通过单一时间点血清PCT水平检测鉴别病原体种类不够严谨。因此,今后应进行更科学的大样本量研究,以进一步明确血清PCT水平对不同病原体所致血流感染的鉴别诊断价值。

