基于HPLC-AFS联用法测定地龙蛋白粉中形态砷的前处理方法优化
王剑
(宁夏食品质量监督检验二站,宁夏 银川750001)
砷是一种可致癌类金属元素,以各种形态存在于自然界中[1]。砷在土壤中主要以三价砷As3+、五价砷As5+、一甲基砷(MMA)和二甲基砷(DMA)的形态存在,海洋产品中主要存在的形态砷是砷甜菜碱(AsB)和砷胆碱(AsC)[2]。无机砷通常是通过食物链进入人体,食物在消化时含有的砷化合物破坏了人体内酶的活性,进而造成基因突变及变异,从而导致癌症[3]。
地龙又名蚯蚓,生存于土壤中,地龙蛋白粉中含有机砷,原因是无机砷在动物体内的正常代谢过程中会发生甲基化,形成一甲基砷或二甲基砷[4]。作为我国传统中药,其药用价值随着新药效的发现而不断提升,促使其被砷污染情况越来越得到重视。
1 实验部分
1.1 仪器及试剂
实验仪器及设备见表1。
实验原料及试剂见表2。
实验所需器具及耗材:微孔滤膜(有机相),0.45μm;C18小柱;具塞离心管50mL。
1.2 试剂溶液配制
见表3。
1.3 混合标准使用液
1.3.1 标准中间液
见表4。
1.3.2 混合标准使用液
分别吸取As3+中间液、As5+中间液、MMA中间液与DMA中间液各0.25 mL、0.50 mL、1.00 mL、2.00mL、2.50mL于25mL容量瓶配制出10 ng/mL、20 ng/mL、40 ng/mL、80 ng/mL、100 ng/mL的混合标准使用液,用流动相定容,摇匀。

表1 仪器设备一览表

表2 实验原料及试剂

表3 试剂溶液配制

表4 标准中间液的配制
2 试验方法
2.1 仪器参数
见表5。
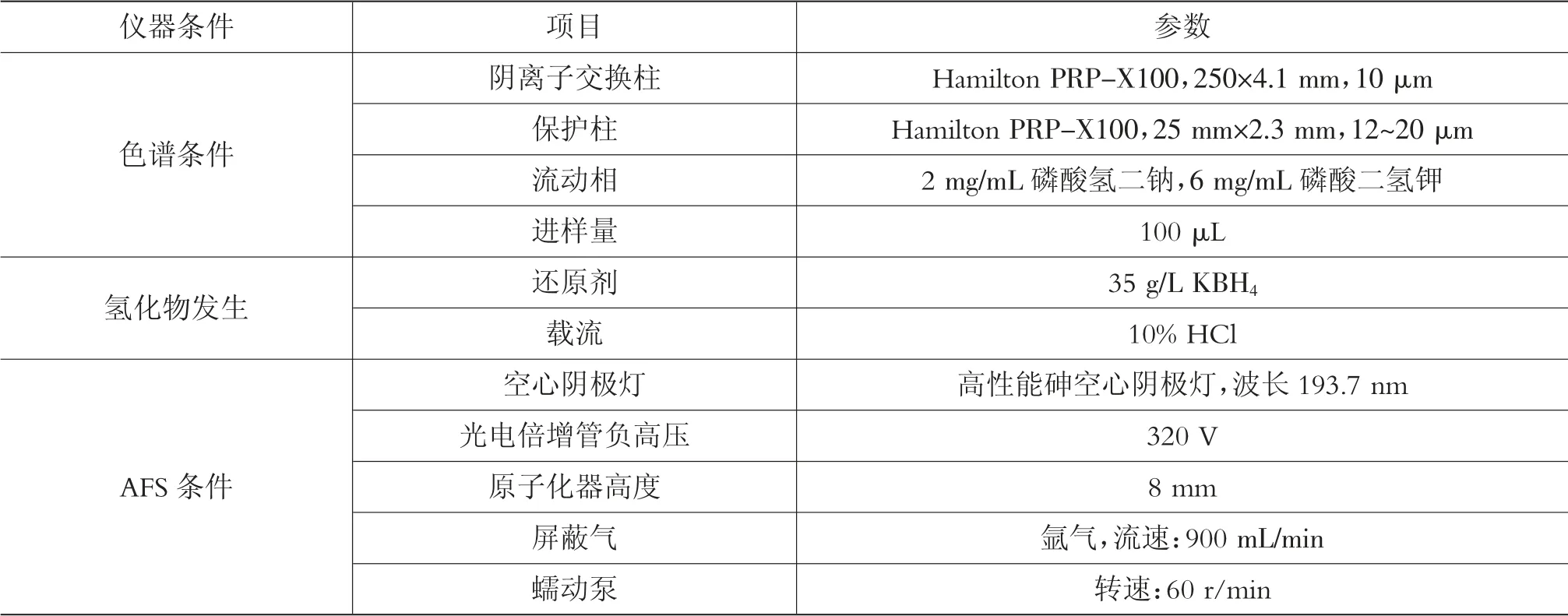
表5 HJPLC-AFS仪器参数
2.2 样品的制备
准确称取1.0 g(精确至0.001 g)试样于50mL离心管中,加入20mL硝酸(0.05mol/L)溶液,静置过夜。于60℃恒温箱中浸提1 h,每半小时取出混匀一次。取出,冷却至室温,离心15min,转速为8000r/min,取5mL上清液置于离心管中,加入5mL正己烷,振摇,静置,弃去上层正己烷,收集提取液,经0.45μm有机滤膜过滤,测定。
2.3 定性试验
取四种形态砷的标准中间液稀释为40 ng/mL浓度的单标溶液,依次测定,在仪器设定识别四种形态砷后,取配置好的中间浓度的混标(40 ng/mL)溶液进行测定。确定每种形态砷的保留时间。

图1 四种单标溶液谱图
2.4 标准曲线的绘制
将配制好的10 ng/mL、20 ng/mL、40 ng/mL、80 ng/mL、100 ng/mL的混合标准使用液,进行上机测定。得出结果以标液浓度为x轴,以目标物峰面积为y轴,绘制出标准曲线,如图2—图5。
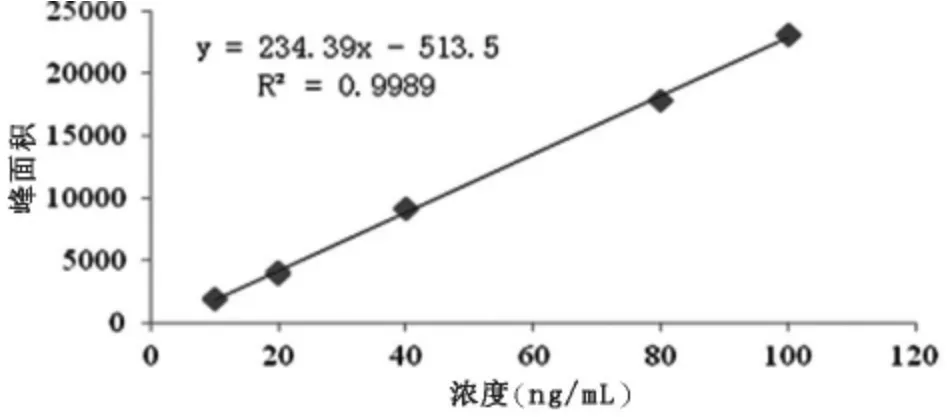
图2 三价砷标准曲线

图3 二甲基砷标准曲线
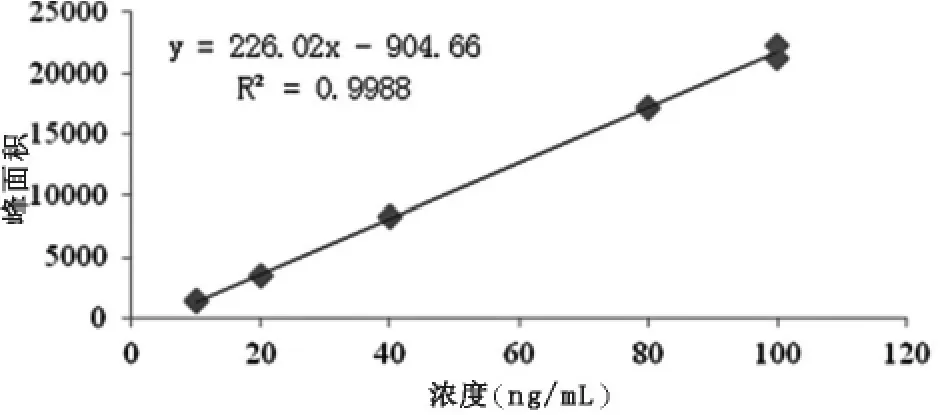
图4 一甲基砷标准曲线
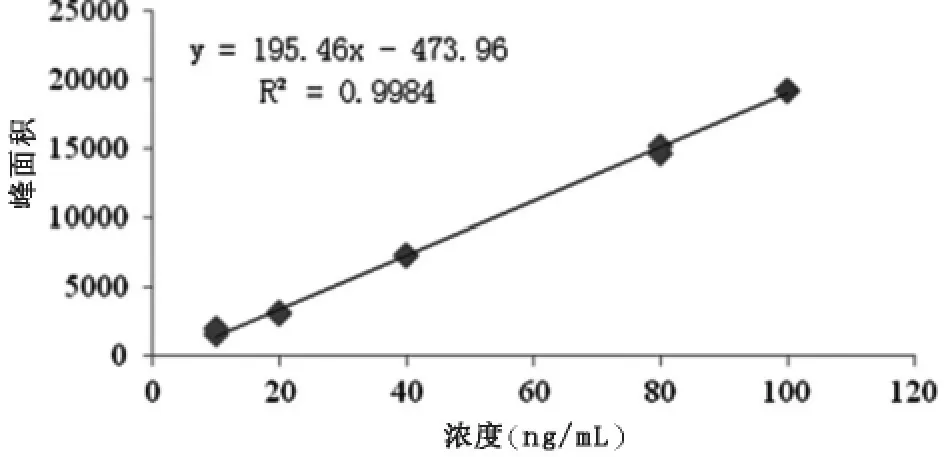
图5 五价砷标准曲线
由图2、图3、图4、图5可知,四种形态砷均在10~100 ng/mL范围内呈现较良好的线性关系,相关系数均大于0.9980。
3 前处理条件的优化
3.1 提取液浓度
选取0.05 mol/L、0.10 mol/L、0.15 mol/L和0.20mol/L的硝酸溶液进行试验,实验结果见表6和图6。

表6 不同提取液浓度的回收率
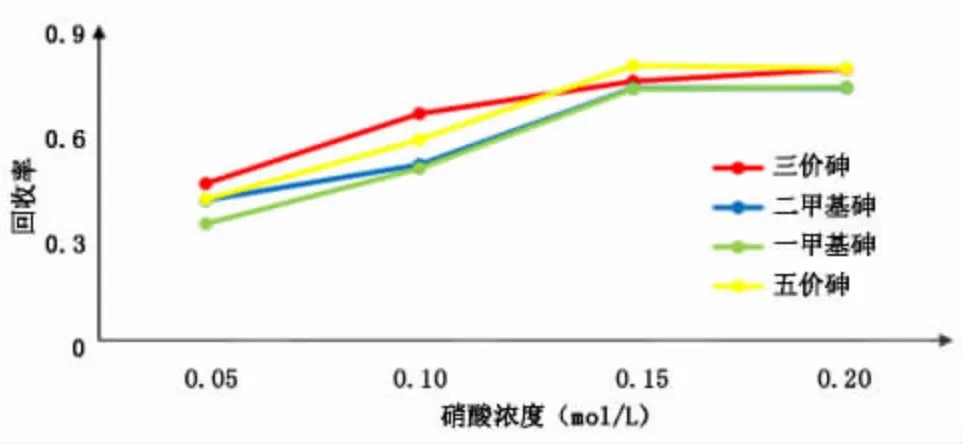
图6 提取液浓度的选择
由图6可知,在0.05~0.15mol/L范围内,回收率随着硝酸浓度的增加而增加,浓度为0.15mol/L和0.20mol/L时回收率变化平缓,故选择浓度为0.15 mol/L的硝酸溶液为提取液。
3.2 浸提时间
选取浸提时间1 h、1.5 h、2 h、2.5 h、3 h和3.5 h进行试验,实验结果见表7和图7。
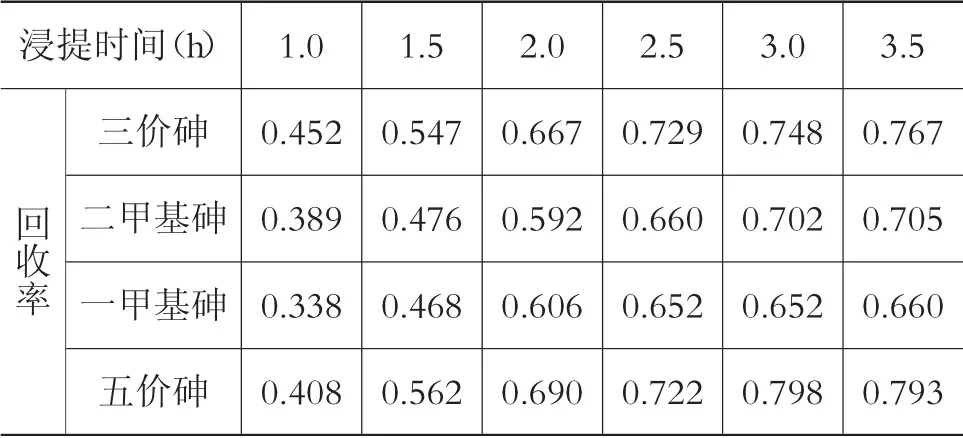
表7 不同浸提时间的回收率
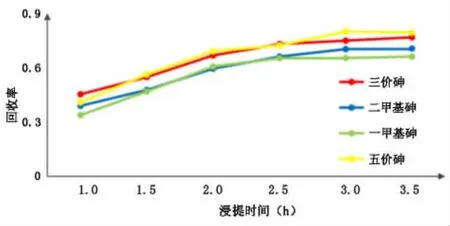
图7 恒温浸提时间的选择
由图7可知,在1~2.5 h范围内回收率随着浸提时间的增加而上升,浸提时间为2.5~3.5 h回收率变化平缓,故选择2.5 h作为浸提时间。
3.3 浸提温度
选取恒温浸提温度60℃、70℃、80℃、90℃和100℃进行试验,实验结果见表8和图8。

表8 不同浸提温度的回收率

图8 恒温浸提温度的选择
由图8可知,浸提温度在60℃、70℃时回收率过低,80℃回收率有部分未达标,100℃时提取状况很不稳定,形态砷会发生相互转换,故选择90℃为浸提温度。
3.4 正己烷去脂次数
选取正己烷1次、2次、3次去脂进行试验,实验结果见表9和图9。
由图9可知,去脂一次的回收率较低,说明油脂包裹待测物影响了检测结果,去脂两次与三次的回收率非常接近,在提取过程中发现,去脂两次后的正己烷有浑浊现象,去脂三次后的正己烷已近澄清,故选择正己烷去脂次数为两次。

表9 去脂次数与回收率的关系
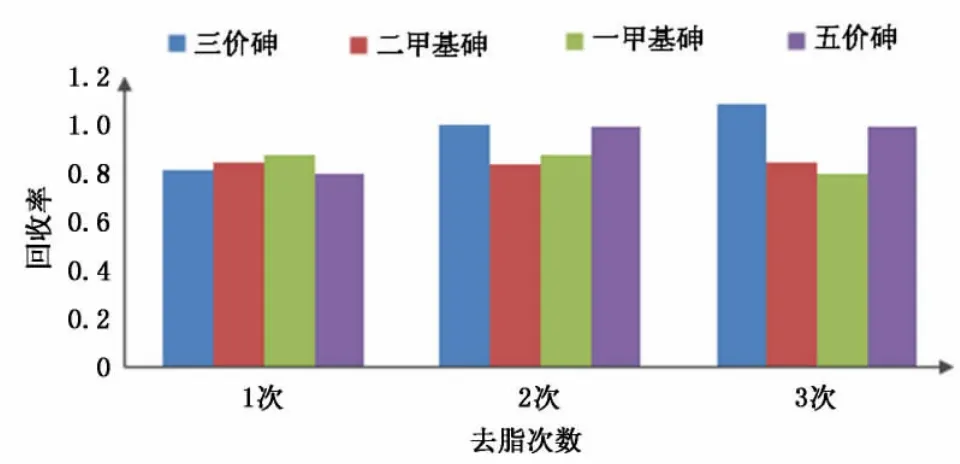
图9 正己烷去脂次数的选择
4 结论
本论文通过对提取剂浓度、浸提时间、浸提温度、去脂次数、等前处理方法进行优化,建立了应用HPLC-AFS法对地龙蛋白粉中As3+、As5+、MMA和DMA四种砷形态分析的前处理方法。该方法优化为:提取剂选择0.15mol/L硝酸溶液,恒温浸提时间选择2.5小时,浸提温度选择90℃,正己烷去脂两次,三价砷回收率为98%、二甲基砷回收率为93%、一甲基砷回收率为94%、五价砷回收率为101%,可应用推广。

