微小RNA-7在帕金森病患者血清中的表达及其临床意义
杜煜,马宇,卢柳西,黄巧,展群岭,李兴贵
帕金森病(PD)是CNS的变性疾病,主要病理改变为黑质多巴胺能神经元进行性退变和路易小体形成,患者主要表现为震颤、肌强直、姿势平衡障碍、运动迟缓,病情严重者生活难以自理,给患者家庭以及社会都带来了沉重的疾病负担[1]。PD起病隐袭,在疾病早期临床症状较轻或症状不典型,一般PD患者要在多巴胺能神经元减少50%和(或)纹状体内多巴胺水平减少70%~80%时才会出现典型的运动症状,这导致PD在早期容易被误诊或漏诊[2],因此寻找与PD相关的生物学标志物具有重要的临床意义。微小RNA(miRNA)是一类内源性的小分子单链RNA,通过与靶基因mRNA3′非编码区的碱基配对调节靶mRNA的降解或翻译抑制,进而对基因进行转录后表达调控[3]。微小RNA-7(microRNA-7,miR-7)是一种关于神经疾病密切相关的miRNA,其在黑质、纹状体、伏隔核、新皮质和海马等多个脑部区域中均有表达[4]。且有细胞实验[5]证实,miR-7可调节α-突触核蛋白(α-synuclein)的表达,进而在PD的发生、发展中起到一定的作用。然而目前关于miR-7与PD相关的临床研究较少,其与患者病情严重程度的关系及其对疾病的诊断价值尚不清楚。本研究旨在探讨miR-7在PD患者血清中的表达及其临床意义,现作如下报道。
1 对象与方法
1.1 对象 选取2017年1月到2019年10月期间在我院接受治疗的PD患者58例作为PD组,纳入标准:(1)均根据《中国帕金森病的诊断标准(2016版)》中的相关内容进行诊断[6];(2)病历资料完整;(3)患者及其家属对本次研究知情同意。排除标准:(1)脑卒中、脑外伤、脑膜炎等病史;(2)合并有神经系统疾病;(3)患有严重痴呆伴记忆力、语言和行为障碍;(4)合并有恶性肿瘤者;(5)合并有严重器质性疾病者。另选取同期在我院体检的30名健康志愿者作为对照组。本研究获得我院伦理委员会批准。
1.2 方法
1.2.1 血清miR-7检测 采用实时荧光定量PCR检测血清miR-7的相对表达量。采用真空采血管收集所有研究对象的空腹静脉血6 ml,3 000 r/min离心10 min,提取上清液。取适量血清加入Trizol溶解试剂,充分混匀裂解,提取总RNA后通过分析260 nm和280 nm的紫外吸收值的比值(A260/A280)确认RNA的浓度和纯度,逆转录提取cDNA,以U6为内参检测血清miR-7的相对表达量。miR-7正向引物:5′-AAA GAA CAT CCA GGC AAA TGT GA-3′,miR-7反向引物:5′-CCG CCT AAC GTA CGC GCA TAT T-3′,U6正向引物:5′-CTG CGA AGC CGT GCT CA-3′,U6反向引物:5′-AGC GTT GAG CAA TTA GCG T-3′,95 ℃预变性15 min;94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s,40个循环。采用2- Ct法计算血清中miR-7的相对表达量。
1.2.2 统一帕金森病评定量表(UPDRS)评定 由经过统一培训的神经内科医务人员,在PD患者处于安静状态下对其进行UPDRS评分。UPDRS共分为6部分,本研究主要选用其中的第Ⅰ、Ⅱ、Ⅲ部分[7]。 第Ⅰ部分为精神、行为及情绪,用于判断PD患者的精神活动和情感障碍;第Ⅱ部分为日常生活活动,用于判断PD患者的日常生活能力;第Ⅲ部分为运动检查,用于判断PD患者的运动功能。各项目均分为5个等级,计分为0~4分,其中0分表示正常,分数越高表示症状越重。同时采用Hoehn-Yahr分级进行分组,其中<Ⅲ期的患者纳入到轻度PD组(25例),≥Ⅲ期的患者纳入到重度PD组(33例)[7]。
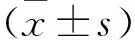
2 结 果
2.1 PD患者和对照组的一般资料比较 两组研究对象的男女比例、年龄、高血压、糖尿病比较差异均无统计学意义(均P>0.05)。PD患者的的病程、UPDRS Ⅰ评分、UPDRS Ⅱ评分、UPDRS Ⅲ评分的具体数据见表1。
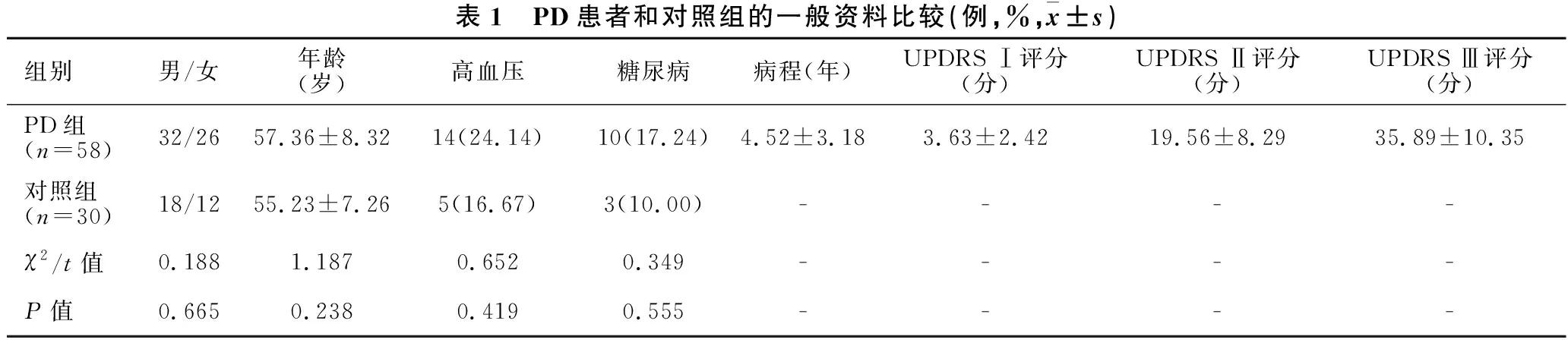
表1 PD患者和对照组的一般资料比较(例,%,x±s)组别男/女年龄(岁)高血压糖尿病病程(年)UPDRS Ⅰ评分(分)UPDRS Ⅱ评分(分)UPDRS Ⅲ评分(分)PD组(n=58)32/2657.36±8.3214(24.14)10(17.24)4.52±3.183.63±2.4219.56±8.2935.89±10.35对照组(n=30)18/1255.23±7.265(16.67)3(10.00)----χ2/t值0.1881.1870.6520.349----P值0.6650.2380.4190.555----
2.2 不同研究对象血清miR-7相对表达量的比较 PD组的血清miR-7相对表达量为(0.77±0.28),明显低于对照组的(1.04±0.36),差异有统计学意义(t=3.882,P=0.000)。轻度PD组的血清miR-7相对表达量为(0.88±0.31),明显高于重度PD组的(0.69±0.22),差异有统计学意义(t=2.731,P=0.008)。
2.3 PD患者血清miR-7与病程、UPDRS评分、Hoehn-Yahr分级的相关性分析 见表2。Pearson分析显示, PD患者血清miR-7与病程、UPDRS Ⅰ评分无明显相关性(均P>0.05),但与UPDRS Ⅱ评分、UPDRS Ⅲ评分、Hoehn-Yahr分级均呈负相关(均P<0.05)。
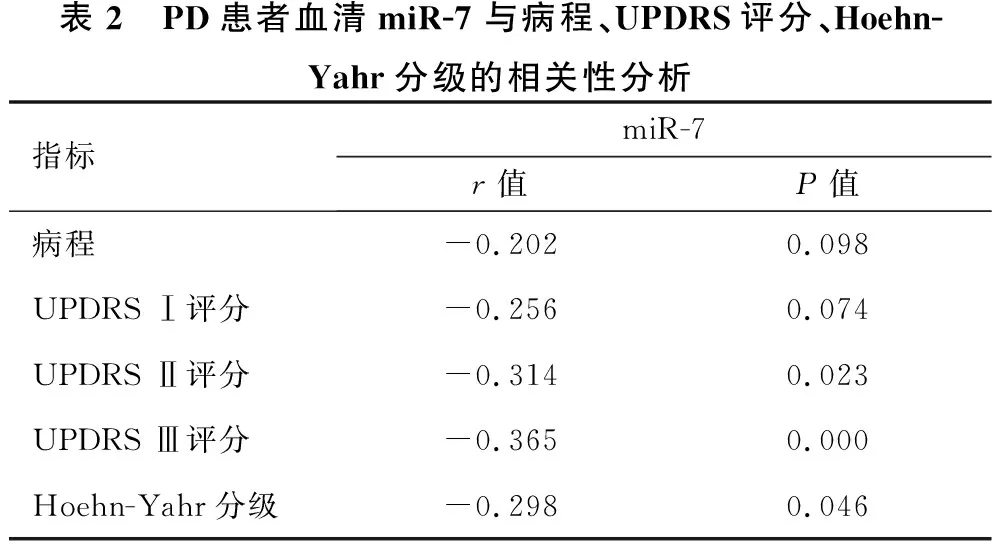
表2 PD患者血清miR-7与病程、UPDRS评分、Hoehn-Yahr分级的相关性分析指标miR-7r值P值病程-0.2020.098UPDRS Ⅰ评分-0.2560.074UPDRS Ⅱ评分-0.3140.023UPDRS Ⅲ评分-0.3650.000Hoehn-Yahr分级-0.2980.046
2.4 血清miR-7对PD的诊断价值分析 以PD患者的血清miR-7相对表达量数据作为阳性数据,以对照组的血清miR-7相对表达量数据作为阴性数据,建立ROC曲线分析血清miR-7对PD的诊断价值。结果显示,血清miR-7对PD的诊断价值一般,曲线下面积为0.698(95%CI:0.573~0.822),其最佳诊断阈值为0.95,敏感度为53.45%,特异性为86.67%。ROC曲线如图1所示。
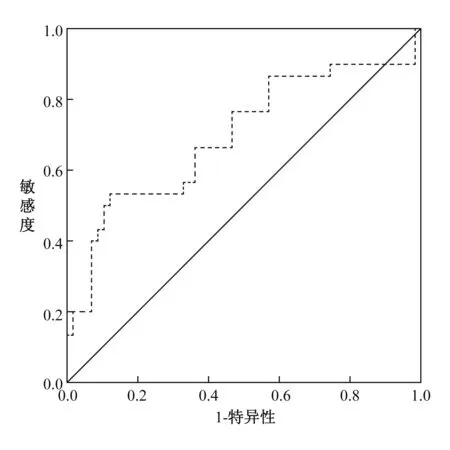
图1 血清miR-7对PD的诊断价值的ROC曲线图
3 讨 论
PD是仅次于Alzheimer’s病的第二大神经退行性疾病。据世界帕金森病协会统计数据[8]显示,全球约有570万例PD患者。而我国是PD高发的国家,患病人数约270万,且PD的主要发病群体为老年人。可以预见,随着近年来我国老年化社会的到来,PD患者的数量将进一步上升[9]。目前临床多采用多巴胺替代疗法、多巴胺受体激动剂、抗胆碱能制剂等治疗PD,但以上治疗方法仅能缓解患者的临床症状,难以阻止疾病的进展。就目前的医学手段而言,患者越早诊断、越早干预,病情才越可能得到有效的控制和缓解[10]。然而PD患者的早期临床表现不易察觉,且目前尚缺乏准确的早期客观诊断指标,因此迫切需要探究与PD密切相关的生物标志物,用于临床辅助诊断PD。miRNA是一类真核生物内源性的小分子单链RNA,长度为18~25 nt。目前已有相关研究[11]证明,miRNA与PD等多种神经退行性疾病有关,如miRNA-4639可靶向调节PD相关蛋白DJ-1的表达,进而在疾病的发生、发展中起到重要的作用[12]。miRNA除了具有丰富的生物学功能之外,还可在血清、唾液、尿液等体液中都能保持稳定状态,具有便于检测、可重复性高等特点,因此寻找与PD相关的miRNA成为临床研究的热点。
miR-7是一种在机体脑组织中高表达的miRNA,其成熟体和前体序列具有较高的保守性。过往研究多集中在miR-7与恶性肿瘤相关的方向[13]。但近年来的研究[14]显示,miR-7是一种与PD发生、发展密切相关的miRNA。本研究结果显示,PD组的血清miR-7相对表达量低于对照组,且轻度PD组的血清miR-7相对表达量高于重度PD组,这提示血清miR-7在PD患者中呈异常低表达,且其表达水平可能与患者的病情严重程度存在一定的关系。通过进一步的相关性分析发现,PD患者血清miR-7与UPDRS Ⅱ评分、UPDRS Ⅲ评分、Hoehn-Yahr分级均呈负相关,这再次提示了miR-7的表达水平与患者的病情严重程度相关。α-synuclein在PD发病机理中具有重要作用,其过表达会导致神经元损伤和特定的多巴胺能神经细胞死亡,促进线粒体功能障碍和氧化应激,进而导致PD的发生[15]。相关研究显示,miR-7可直接负性调控α-synuclein的表达,并可通过促进细胞自噬来清除α-synuclein及其聚集物,进而影响PD的疾病进展[16]。还有研究证实,miR-7可通过抑制Nod样受体蛋白3(NLRP3)炎性小体的激活,减轻神经炎症,进而起到保护多巴胺能神经元的作用[17]。Mcmillan等[18]的研究还发现,在抑制miR-7的表达后,会导致多巴胺能神经元的丢失,同时减少纹状体内多巴胺含量。这就证实miR-7的表达水平与多巴胺能神经元的状态有关,而miRNA均可在血液中稳定表达,血清中的表达水平与组织内的表达水平有较好的一致性,因此血清中miR-7的变化也可在一定程度上影响中枢神经多巴胺能神经元。由此可见,miR-7可通过多个途径参与PD的发生、发展,是PD发病的关键调节因子,有作为PD新的生物标志物的潜力。本研究通过ROC曲线分析了血清miR-7对PD的诊断价值,结果显示,miR-7诊断PD的曲线下面积为0.698(95%CI:0.573~0.822),其敏感度和特异性分别为53.45%、86.67%。这提示血清miR-7对PD的诊断价值一般,曲线下面积还略低于0.7。值得注意的是,miR-7诊断PD的特异性较高,这说明其阴性诊断能力较强。目前尚未发现单一的生物标志物可较好的诊断PD,今后的研究趋势是联合应用多种的生物学标志物,制定出预测PD发病的风险模型,以便在疾病早期甚至是在PD前驱期就实行合理有效的干预措施,进而更好的改善患者的生活质量[19]。
综上所述,miR-7在PD患者血清中呈异常低表达,且其表达水平可在一定程度上反映病情严重程度,但对PD的诊断价值一般。本研究选取的病例数较少,且为单中心研究,同时未分析治疗前后miR-7的动态变化,在后续的研究中将增加病例数,同时分析miR-7对临床治疗效果是否具有评估价值。目前miR-7在PD中的作用机制尚未完全阐明,还处于初级研究阶段,期待更多更深入的研究。

