非创伤性股骨头坏死中纤溶酶原激活物抑制剂-1作用机制的研究进展
王奕凯 李璐 于炜婷 赵德伟*
(1.大连大学附属中山医院骨科,辽宁大连 116001;2.大连大学附属中山医院骨科植入材料开发国家地方联合工程实验室,辽宁大连 116001;3.大连大学中山临床学院,辽宁大连 116001)
非创伤性股骨头坏死(nontraumatic osteonecrosis of the femoral head,NONFH)是一种骨科常见的破坏性、致残性疾病,好发于青壮年人群,病理表现为股骨头软骨下骨的变性和坏死,进一步发展会导致股骨头区域大范围塌陷,最终引起关节功能障碍。NONFH 的致残率高,预后差,严重影响患者的生活质量[1]。
已有多种因素(糖皮质激素滥用、酒精等)被确定为NONFH 的危险因素,但其病因与发病机制仍不清楚。大量研究将NONFH 的发生发展归因于血液供应障碍及遗传因素[2],研究表明异常的血运障碍与血管栓塞、内皮损伤、骨髓间充质干细胞分化异常有重要的联系[3]。也有临床研究报道了NONFH 患者的凝血稳态失调,其股骨头区域的血栓形成率相对正常人群显著增高[4]。在NONFH 的非手术治疗方法中,抗凝血药物的应用在减轻NONFH 患者关节疼痛和降低关节塌陷的发生率方面均取得了一定的效果[5]。在影响凝血稳态的相关因子中,PAI-1 作为重要负调控因子起到了关键的作用。过表达的PAI-1可导致股骨头内的血运异常发生[6]。在NONFH 患者的血清中观察到PAI-1 水平相对其他骨关节疾病出现了特异性的上调[7]。PAI-1基因与NONFH 的遗传易感性联系密切。当PAI-1基因启动子中的-675 4G/5G 单核苷酸多态性(SNP rs1799889)为4G/4G 时更易发生NONFH[8]。PAI-1基因启动子上的rs11178的4G 等位基因,rs2227631 的A 等位基因和rs11178的C等位基因也被证实与其NONFH的发病风险显著相关。这一基因多态性与PAI-1血浆水平显著相关,4G等位基因纯合的受试者血浆中的PAI-1水平相对5G等位基因纯合的受试者出现了明显的升高[9]。
以上结果表明PAI-1与NONFH的发生发展密切联系。PAI-1可以作为重要的生理因子调控NONFH中纤溶水平、血管再生、内皮及骨细胞状态,从而影响NONFH 的发生发展。本文综述PAI-1 在NONFH 中的具体作用机制,PAI-1 抑制剂的研发与应用,提出PAI-1可以作为重要治疗靶点来干预和治疗NONFH。
1 PAI-1结构及功能特性
PAI-1是丝氨酸蛋白酶抑制剂(serpin)超蛋白家族的重要成员,最早在牛内皮细胞的产物中被发现,是作为一种纤溶酶原激活物抑制剂。此后,PAI-1在越来越多的组织细胞中被发现,脂肪细胞、骨细胞、血管内皮细胞、平滑肌细胞、肝细胞均可合成并分泌PAI-1,其表达可以被细胞因子、生长因子、激素、内毒素等调节[10]。
PAI-1 的编码基因serpin1 位于人类染色体7q21.3-q22。PAI-1 作为一种单链糖蛋白,由379 个氨基酸组成,分子量为52 kDa,具备serpin 超家族的高度有序结构,由3个β折叠、9个α螺旋和一个包括23 个氨基酸残基的活性反应中心环(reactive center loop,RCL)构成。由于其功能的灵活性,PAI-1在serpin 家族中又是独一无二的,虽然其合成后即成为具有抑制纤溶系统活性功能的活性构象,但在正常生理条件下,会自发转变为非反应性的稳定的潜在构象,在37℃下表观半衰期约为2 h。这种非反应性潜伏形式不与目标蛋白酶相互作用,可以通过变性剂和随后的再折叠而部分再活化。当RCL与目标蛋白结合发生障碍时,PAI-1 会从目标蛋白酶上释放,此时PAI-1只作为一个蛋白酶的底物,没有作为抑制剂发生反应,这种状态称为底物构象;血浆和细胞外基质中PAI-1主要以活性构象为主,在血小板中PAI-1主要以潜在构象为主。PAI-1 能通过RCL 的突环结构与组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和尿激酶型纤溶酶原激活物(urokinase plasminogen activator,uPA)形成稳定共价复合物,进而抑制纤溶系统的活性[11]。
2 PAI-1在NONFH的纤溶系统的作用
纤溶系统可通过影响纤维蛋白的降解从而维持血管内的凝血稳态。纤溶酶调节因子含有纤溶酶原(plasminogen,Plg),其通过tPA 或uPA 和uPA 受体(urokinase plasminogen activator receptor,uPAR)的作用,转化为纤溶系统的主要组分活化丝氨酸蛋白酶用于溶解血栓及清除相关蛋白[12]。有研究提出低纤溶是原发性NONFH 的重要危险因素之一[13]。在NONFH 患者中观察到纤溶系统功能减弱,清除纤维蛋白和血栓的能力出现明显的下降,如在重症急性呼吸综合征(severe acute respiratory syndrome,SARS)的研究中发现,在接受大剂量激素治疗后出现的股骨头坏死患者的凝血和纤溶能力相对正常人群出现了显著的功能障碍[14]。2012 年波兰的流行病学调查结果也显示遗传性纤溶能力不足提高了NONFH 的发病概率[15]。低纤溶的状态可以直接导致凝血功能的异常和血栓的形成,也能够直接导致股骨头区域的血运障碍并通过低灌注表现导致区域性的坏死[13]。
而PAI-1 是纤溶系统的主要负调控因子,是tPA和uPA 的主要生理抑制剂。PAI-1 可以通过与uPA和tPA 等摩尔比例结合形成不可逆的复合物来对两者活性进行抑制,从而阻止纤溶酶的产生和纤维蛋白的降解[16](图1)。这种负调节可间接导致动静脉中血栓的形成,影响血供及血液循环[6]。在临床中因为PAI-1 活性升高而导致的低纤溶水平已经在如静脉血栓栓塞、冠状动脉疾病和急性心肌梗死等疾病中被发现[17]。在NONFH 中,过高的PAI-1 表达可能通过损害纤溶系统的功能从而导致NONFH 中股骨头区域的血运功能异常从而在股骨头坏死的发生中起到重要促进作用。
3 PAI-1在NONFH的血管生成中的作用
NONFH患者的股骨头坏死区域中的血管新生能力相对正常人群出现了显著的减弱,Wu 等研究发现,股骨头坏死组织标本的血管标志物CD31、血管假性血友病因子(von Willebrand factor,vWF)较股骨骨折组织标本显著减少;体外研究也说明了这一问题,NONFH患者的血清可以抑制动脉环血管内皮细胞的形成和血管的新生[18]。坏死骨区域的血管新生是坏死骨组织修复的关键环节,新生血管的减少直接影响机体对于坏死骨的修复能力,也是未进行治疗的NONFH病情进展的重要原因。当针对血管新生功能受损予以治疗后,股骨头处骨小梁的丢失得到了显著的抑制[19]。
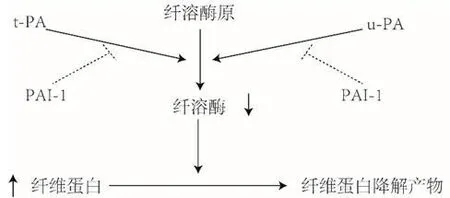
图1 PAI-1在纤溶系统中的作用
内源性PAI-1 的异常改变在体外和体内均会影响血管生成。有研究报道当宿主细胞产生超过生理浓度的PAI-1 时,肿瘤的血管新生受到了显著的抑制[20]。而从PAI-1 敲除的小鼠中获取的血管外植体的血管生成潜能显著上升,加入PAI-1后这种潜能受到了明显的抑制。当血管外植体缺乏tPA时,其血管新生能力基本消失,在缺乏Plg的血管外植体中也观察到了类似的血管新生能力丧失的表现,而加入外源性tPA 后血管外植体的血管新生能力显著提高。这些研究证据说明纤溶酶活性对于血管生成是必不可少的[21]。PAI-1 既可以通过抑制纤溶酶原激活物活性来抑制血管新生,还可以通过与维生素C的高亲和力结合而起到抑制玻连蛋白促血管生成的功能[22]。此外,众所周知的血管内皮生长因子(vascular endothelial growth factor,VEGF)等几个重要基本因子可以诱导血管生成[33],异常上升的PAI-1便可以通过抑制促血管生成的成纤维细胞生长因子-2和VEGFA通路减弱血管的重建和新生能力[23]。过高的PAI-1水平会使NONFH 患者坏死区域的血管新生能力显著下降并进一步破坏骨坏死修复功能,这正是NONFH患者的症状无法得到缓解甚至进一步加重的重要因素。
4 PAI-1在NONFH的内皮细胞损伤中的作用
内皮祖细胞(endothelial progenitor cells,EPCs)在很大程度上可以影响血管内平衡,如血管修复和新血管生长[24]。相比健康人,NONFH 患者血液循环中的EPCs 数量及其集落形成单位(colony forming unit,CFU)显著减少,迁移能力明显降低,细胞衰老加剧,体外血管生成能力也受到损害[25]。在另一项关于激素性NONFH 的临床研究中也发现了同样的问题:NONFH 患者体内的EPCs 和内皮集落形成细胞(endothelial colony forming cells,ECFCs)的增殖能力、迁移能力、成血管能力都出现了显著的下降[26]。激素诱导的NONFH 患者股骨头中骨微血管的内皮细胞增殖能力受到显著抑制[27]。内皮细胞损伤标志物升高的人群与NONFH 患者有高度相关性,局部内皮功能障碍与NONFH之间存在潜在的联系[28]。
纤溶调节因子与EPCs的生理能力和活性密切相关,tPA 增强骨髓中EPCs 的动员能力,uPA 的表达增加可以调节EPCs 迁移[29]。而PAI-1能在血液中抑制tPA活性,也可以在内皮细胞中抑制tPA的分泌,即其可以间接影响EPCs 的功能和数量,过表达的PAI-1对于EPCs可以起到负调控作用[12]。除了这种间接作用以外,PAI-1 还可以通过转化生长因子-β(transforming growth factor β,TGF-β)抑制EPCs 的活性。过高的PAI-1会导致内皮细胞(endothelial cells,ECs)对外界环境毒性的敏感性上升,最终影响ECs 的存活。周细胞条件培养基(pericyte cell medium,PCM)含有一种生物活性成分,在体外可以控制内皮细胞的迁移和小管的形成,并且这些反应可能部分地被PAI-1 的内皮细胞表达增加所控制[30]。以上这些研究可以说明NONFH的EPCs的异常表现是由于PAI-1的异常升高所致。
5 PAI-1在NONFH的骨细胞变化中的作用
NONFH 患者中的骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)、成骨细胞、破骨细胞均有不同程度的改变,这些也可能是股骨头坏死的重要影响因素。NONFH患者的股骨头中细胞凋亡的比例显著高于创伤性骨坏死患者。相对股骨远端区域,坏死的股骨头区域中的成骨细胞的增殖能力出现了下降,成骨细胞和骨细胞凋亡更为频繁[31]。而比较NONFH 患者与无骨坏死的正常人群可以发现其BMSCs的活性、增殖能力均明显下降[32]。类似的临床研究也证实:NONFH 患者的BMSCs 成骨基因的表达和成骨分化能力与正常人群相比出现了显著的减少[33],骨矿物质密度也表现为明显的减少,骨代谢率指标则显著上调[34]。
而活性构象的PAI-1 能抑制成骨细胞的矿化能力和成骨基因表达水平[35](图2),在骨损伤发生后,敲除PAI-1 基因的小鼠中碱性磷酸酶阳性细胞数量相较于未敲除PAI-1的小鼠显著增多,其骨修复的速度也明显高于未敲除PAI-1 的小鼠[36]。与正常的卵巢切除小鼠相比,缺乏PAI-1的小鼠在卵巢切除后皮质骨的流失未见明显区别,但其小梁骨的丢失远小于正常卵巢切除小鼠,而当使用PAI-1 抑制剂处理后,其股骨处的小梁骨丢失减少。这证明PAI-1 在骨代谢中起到促进作用[37]。过高的PAI-1 蛋白可以通过其与玻连蛋白的高亲和力减少间充质干细胞(mesenchymal stem cells,MSCs)与玻连蛋白的黏附,这直接导致MSCs 的存活率下降,而存活的MSCs 会进一步释放PAI-1 从而影响细胞的长期存活[38]。所以异常上调的PAI-1 对于NONFH 中骨细胞增殖、分化和代谢起到了重要的负面调控作用。
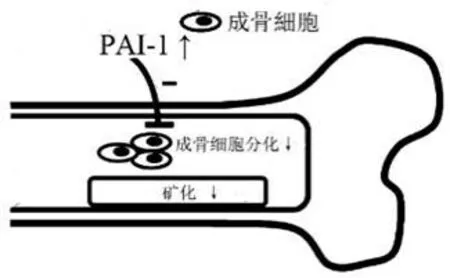
图2 PAI-1对成骨细胞分化的影响
6 PAI-1作为NONFH潜在治疗靶点的前景
如上所述,PAI-1 可以通过多种机制影响NONFH 的病理发展进程。将与NONFH 具有紧密联系的调控因子PAI-1作为潜在的治疗靶点,通过对其针对性的抑制,最终延缓并改善NONFH 病情进展的方案可以作为NONFH 治疗的一种新思路,但目前国内外并没有与其相关的研究。抑制PAI-1 的安全性已经有研究证实。抑制PAI-1后,抗血栓形成的作用是通过增强内源性纤溶活性实现的,并没有直接影响凝血和血小板功能[39]。基因型为PAI-1-/-的小鼠在生长发育过程中并未受到PAI-1 缺失的影响,在具有PAI-1缺陷的人群中也未发现自发性出血倾向,并未观察到其他明显的不良反应[40]。在使用PAI-1 抑制剂抑制PAI-1活性以后,动物模型的血栓形成受到了显著的抑制,但整体止血能力并没有受到影响[41]。因此,PAI-1 作为NONFH 的潜在治疗靶点具有相当的可行性、创新性和安全性。
7 PAI-1抑制剂的研究进展
目前已开发出均针对PAI-1的抑制剂,这些抑制剂从不同方面对PAI-1 的活性、功能、合成等进行抑制(表1)。
7.1 单克隆抗体抑制剂
早在1986 年,有人提出了第一种可以用于中和PAI-1 的单克隆抗体[48]。目前,可抑制PAI-1 活性的单克隆抗体至少可以细分为三种不同的类别:第一类单克隆抗体可以通过其表位的ESPI-12、MAI-12、MA-42A2F6、MA-44E4 和MA-56A7C10 等残基影响PAI-1 的RCL,直接干扰PAI-1 与其靶蛋白酶的结合;第二类单克隆抗体则被称为转换抗体,它通过诱导改变生成PAI-1的底物途径来抑制PAI-1的活性;第三类单克隆抗体(如H4B3等)对PAI-1的抑制性是通过加速PAI-1转化为其潜在构象达到的[42]。
7.2 多肽类抑制剂
已经有很多研究证明,PAI-1与目标蛋白酶的相互作用需要其RCL重排成一种适合与蛋白酶活性位点初始结合的构象,并且这种重排涉及其A-β 折叠的顶部或附近的结构元素。一些多肽类抑制剂,如CDE-096被设计出来用于抑制PAI-1的活性,主要参与PAI-1的RCL结构的结合,两者之间可以形成稳定的构象使得RCL不再能够采用必要的关键构象以用于蛋白酶结合[43]。
7.3 小分子抑制剂
多种小分子抑制剂可以有效抑制PAI-1的作用,其主要作用机制是诱导PAI-1 由活性构象转变为稳定的潜在构象并与PAI-1 结合形成可以被蛋白酶降解的底物。链霉菌属物种产生的一些二酮哌嗪类化合物具有PAI-1 的抑制活性。为了提高对于PAI-1的抑制作用,有研究基于这些二酮哌嗪模板,构建了新的PAI-1 小分子抑制性化合物(如XR5118 和XR11211)。在静脉内施用XR5118(5 mg/kg)后,在离体血凝块溶解测定中血液凝块溶解的速率和程度出现了显著的增加[49]。Tiplaxtinin,一种吲哚衍生物,也是一种非常有前途的PAI-1 抑制剂[47]。在几种动物模型中进行的实验已经证实了该PAI-1 抑制剂可以被用于治疗目的[50]。除此之外,Triton X-100,一种广泛用于生化分析缓冲液的洗涤剂,也显示出同样的抑制PAI-1活性的能力[45]。
7.4 合成抑制剂
刺激内源性纤维蛋白溶解的另一种方法是抑制PAI-1生成。一些目前上市的药物,例如噻唑烷二酮类可通过抑制肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)介导的PAI-1生成来降低血浆中PAI-1水平[51]。而丁二烯衍生物T-686 减弱了TGF-β 诱导的内皮细胞中PAI-1抗原积累的增加,通过动物模型证明了其可以降低PAI-1的活性,并下调主动脉和动脉血管缺损处的PAI-1 的mRNA 的表达水平[52]。也有报道称对PAI-1 mRNA(MPO-16R)反义寡核苷酸降低了大鼠血浆和血小板中的PAI-1活性[53]。
尽管PAI-1被认为是NONFH的潜在治疗靶点之一,但其抑制剂尚未大量应用于临床治疗,以上相关的抑制剂的研究目前大多停留在基础研究及临床前实验阶段。被观察到可以抑制骨髓脂肪干细胞PAI-1表达水平的他汀类药物有时会被用于NONFH的预防及早期的治疗[54]。但目前国内外暂缺少关于该药物的PAI-1抑制能力在预防和治疗NONFH中具体作用的研究。PAI-1抑制剂在NONFH治疗中的应用也亟需进一步的深入系统研究。

表1 现有PAI-1抑制剂的研究报道
综上所述,PAI-1 在NONFH 患者中存在特异性升高,诱发了异常纤溶状态及血运障碍,对其内皮损伤、血管新生减少和骨细胞分化增殖能力减弱也起到促进NONFH 病理变化的作用。PAI-1 可以作为NONFH的无创性生物标志物用于高危人群的筛查并成为NONFH潜在治疗靶点。PAI-1抑制剂的研究对于NONFH的临床治疗有相当重要的意义,对于PAI-1 的高效特异性的抑制能够多途径多角度的缓解NONFH 患者病情的进一步进展,并可以作为早期治疗的有效手段以及在中后期重要辅助治疗方法。目前对于NONFH中PAI-1的作用机制及其抑制剂的研究均尚在初期阶段,并未完全明晰,进一步的研究将有助于NONFH 的发病机制的阐明,并在临床上对NONFH早期预防和中期治疗提供理论支持和依据。

