高低脂饮食差异对小鼠肠道乳糖酶活力的影响
吴燕婷, 刘 健
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
乳糖酶可将食物中包含的乳糖分解为一分子葡萄糖和一分子半乳糖,分布在哺乳动物小肠黏膜上皮细胞绒毛远端刷状缘上。葡萄糖是糖酵解作用的底物,参与到人体各部分代谢中;而半乳糖是人体大脑和黏膜组织代谢中的必要成分,对于婴幼儿的大脑发育和成长至关重要[1]。人在成年后,依然需要在食物中摄入一定量的乳糖,来供机体日常所需。调查结果主要将人群分为乳糖耐受型(lactase persistence,LP)和乳糖不耐受型(lactase non persistence,LNP)两大类,前者在成年后,肠道中的乳糖酶活力依旧很高,而后者相反[2]。有研究[3]表明,LP及LNP是由乳糖酶基因(LCT)决定的,人的LCT基因上游有多个与LCT表达相关联的单核苷酸多态性(single nucleotide polymorphism,SNP)位点[4],这些SNP位点会影响LCT的表达,改变乳糖酶活力的高低,并且这2种人群在世界范围内的分布存在着明显的地理差异,北欧等西方国家的人群大多为LP,而亚洲等东方国家的人群大多为LNP[5-6]。也有研究[7-9]表明,哺乳动物肠道中的乳糖酶活力会受到饮食的调控,改变食物中糖脂的含量,会影响LCT的表达,影响肠道中的乳糖酶活力。流行病学研究[10-12]表明LP及LNP人群的肥胖发生几率不同,这2种人群在日常生活中摄入食物的种类也不同。但是,饮食成分尤其是脂质含量的改变,是否影响肠道乳糖酶的活力仍不清楚。
本文考察了在当代小鼠3周断乳后、亲代小鼠哺乳期间和亲代小鼠孕前孕中期间,对各组小鼠分别喂养高低脂饮食,观察对当代或子代雄性和雌性小鼠肠道乳糖酶活力的改变。揭示高脂饮食(high-fat diet,HFD)相比于低脂饮食(low-fat diet,LFD)对于小鼠肠道乳糖酶活力的影响,为进一步探究不同饮食对于人体中乳糖酶活力影响提供一定的参考。
1 材料与方法
1.1 材料与试剂
周龄为3、8周的SPF级C57BL/6小鼠购自于北京维通利华实验动物技术有限公司;小鼠LFD饲料按Research Diets D12450B配制,小鼠HFD饲料按Research Diets D12451配制,制成的饲料经真空包装,60Co辐照杀菌,于-20 ℃贮藏。
本实验所用的乳糖酶测定试剂盒购于南京建成生物工程研究所;玻璃研磨棒和氯化钠购于国药集团化学试剂有限公司。考马斯亮蓝G-250粉末购于生工生物工程有限公司。
1.2 方法
1.2.1 小鼠饲养与分组
小鼠饲养于食品与生物工程学院SPF级动物房中,温度维持于22 ℃,12 h/12 h光暗周期下,自由摄取食物和水。各组小鼠分组处理如下:
当代饮食差异组。3周的雄性和雌性小鼠各被分为2组,分别喂养LFD和HFD,收取周龄分别为3、6、9周的当代雄性和雌性小鼠的小肠组织。
亲代哺乳期饮食差异组。8周的雄性和雌性小鼠作为亲代小鼠,在孕前孕中期间,亲代小鼠饮食均为LFD,在其哺乳期间(即子代小鼠0~3周期间),分别喂养LFD和HFD,3周哺乳期后,子代3周断乳小鼠均喂养HFD。收取周龄分别为3、6、9周的子代雄性和雌性小鼠的小肠组织。
亲代孕前孕中饮食差异组。8周的雄性和雌性小鼠作为亲代小鼠,分为2组,在亲代小鼠产下子代小鼠之前(即子代小鼠0周之前),分别喂养LFD和HFD,收取周龄分别为3、6、9周的子代雄性和雌性小鼠的小肠组织。
1.2.2 小鼠肠道收取及肠道黏膜匀浆制备
CO2窒息处死动物,立即取其胃幽门以下10 cm肠段作为待测标本,加入2倍肠质量的生理盐水,用DY89-I型玻璃匀浆器于冰浴中低速匀浆1 min,然后低温3 000 r/min离心10 min。取上清液待测或置于-80 ℃保存。
1.2.3 小鼠肠道乳糖酶活力的测定
测定方法参考Dahlqvist 法[13]。以各小鼠肠道黏膜匀浆上清为待测样本,进行酶活力测定。第1步为酶促反应,在各管中依次加入底物(乳糖溶液)和酶(待测样本),混匀后37 ℃孵育20 min,反应结束后加入终止剂,混匀后,4 000 r/min离心10 min;第2步为显色反应,取出各样本上清液于96孔板中,各孔中加入显色液,混匀后37 ℃孵育15 min,反应结束后,酶标仪上读取各孔505 nm处吸光值。每个待测样本的测定管需与一个空白管作为对照。标准曲线以5.55 mmol/L葡萄糖溶液制作。利用BCA法测定各鼠肠黏膜匀浆的蛋白含量。乳糖酶活力(U)定义为:在37 ℃、pH=6.0的条件下,每mg组织蛋白每min水解1 nmol乳糖,记为1个乳糖酶活力单位。
1.2.4 数据分析
实验结果以(x±se)表示。采用Origin9统计软件进行数据分析,2组之间比较采用Mann-Whitney检验,P<0.05为差异显著(*),P<0.01为差异极显著(**)。
2 结果与讨论
2.1 当代小鼠高脂饮食改变乳糖酶活力
当代饮食差异组实验设计如图1所示。当代小鼠高脂饮食改变乳糖酶活力的结果如图2所示。

图1 当代饮食差异组实验设计

图2 当代高脂饮食对雄性和雌性小鼠体质量和乳糖酶活力的影响
图2中,*表示与3周组相比,有显著性差异;#表示不同饮食相同周龄间的比较,有显著性差异。从图2a、图2c可以看出,当代雄性和雌性小鼠随着周龄的增加,小鼠的体质量明显升高,在喂养HFD后,小鼠的体质量相较于LFD组显著性升高。而在图2b中,雄性小鼠肠道中乳糖酶的活力随着周龄的增加逐渐降低,在HFD喂养后,6周、9周的小鼠的乳糖酶活力比3周下降得更多。但图2d中,LFD的雌性小鼠肠道乳糖酶活力并没有表现出同雄性小鼠相同的生理性降低,在HFD喂养后,6、9周小鼠肠道中的乳糖酶活力比同周龄喂养LFD的反而有显著性升高。而雄性小鼠在3周断乳时,乳糖酶活力值为(63.13±3.93) U,与雌性小鼠的(21.93±2.64) U相比,有显著性差异,P=0.001,雄性小鼠在断乳时的乳糖酶活力显著高于雌性。
结果表明,当代高脂饮食会增加雄性和雌性小鼠的体质量。雄性小鼠中,肠道乳糖酶活力会出现生理性的降低,而在雌性小鼠中,HFD会提高小鼠的乳糖酶活力。
2.2 哺乳期高脂饮食改变子代小鼠乳糖酶活力
研究表明,在哺乳动物3周(断乳)时,肠道中的乳糖酶活性较高,而断乳后,大部分哺乳动物肠道中的乳糖酶活力都会降低(图2b),这可能与哺乳动物的乳汁成分相关联,而亲代哺乳期的饮食不同,会改变乳汁的成分,为了进一步验证高脂饮食对小鼠肠道乳糖酶活力的影响,亲代哺乳期饮食差异组实验设计如图3所示。

图3 亲代哺乳期饮食差异组实验设计
亲代哺乳期喂养HFD,对子代小鼠体质量与乳糖酶活力的影响如图4所示,图4中,*表示不同饮食同周龄之间的比较,有显著性差异。在图4a和4c中,亲代哺乳期喂养HFD后,子代雄性和雌性小鼠的体质量同亲代哺乳期饮食为LFD的子代小鼠相比,在3、6、9周时,体质量均升高,且在3周时有显著性差异。在图4b中,当亲代哺乳期喂养HFD后,子代3周雄性小鼠的乳糖酶活力与亲代哺乳期为LFD的子代小鼠相比有显著性降低,子代6、9周雄性小鼠比LFD组也有降低趋势,但没有显著性差异。图4d中,在亲代哺乳期饮食为HFD后,子代6周的雌性小鼠比LFD组的乳糖酶活力有显著性降低,而子代3、9周的雌性小鼠与LFD组相比,则没有显著性变化。在亲代哺乳期饮食为HFD后,子代3周的雄性小鼠的乳糖酶活力为(44.92±13.97) U,与雌性小鼠的(34.72±6.45) U相比无显著性差异,P=0.54。
结果表明,亲代哺乳期喂养HFD会增加子代雄性和雌性小鼠的体质量,并且在雄性小鼠中,亲代哺乳期喂养HFD会显著降低子代3周的雄性小鼠的肠道乳糖酶活力,而在雌性小鼠中,亲代哺乳期喂养HFD则会显著降低子代6周的雌性小鼠的肠道乳糖酶活力。亲代哺乳期喂养HFD,子代3周的雄性和雌性小鼠的乳糖酶活力水平的差距缩小。

图4 亲代哺乳期高脂饮食对子代不同周龄雌雄小鼠体质量和肠道乳糖酶活力的影响
2.3 亲代高脂饮食改变子代小鼠乳糖酶活力
为了进一步验证高脂饮食对小鼠肠道乳糖酶活力的影响以及亲代饮食对于子代小鼠乳糖酶活力的影响,亲代孕前孕中饮食差异组实验设计如图5所示。

图5 亲代孕前孕中饮食差异组实验设计
亲代孕前孕中期间喂养HFD,对子代小鼠体重和乳糖酶活力的影响如图6所示,图6中,*表示不同饮食同周龄间的比较,有显著性差异。由图6a、图6c可知,亲代孕前孕中饮食为HFD,子代雄性和雌性小鼠的体质量与亲代小鼠饮食为LFD的子代小鼠的体质量相比,没有显著性差异。由图6b可知,当亲代孕前孕中饮食为HFD,雄性3、6周的子代小鼠的乳糖酶活力比亲代小鼠饮食为LFD的同周龄子代小鼠均显著性降低。由图6d可知,子代雌性3、6、9周小鼠的乳糖酶活力在亲代孕前孕中饮食为HFD后,比LFD组的子代雌性小鼠有与雄性小鼠相同的降低趋势,但没有显著性。
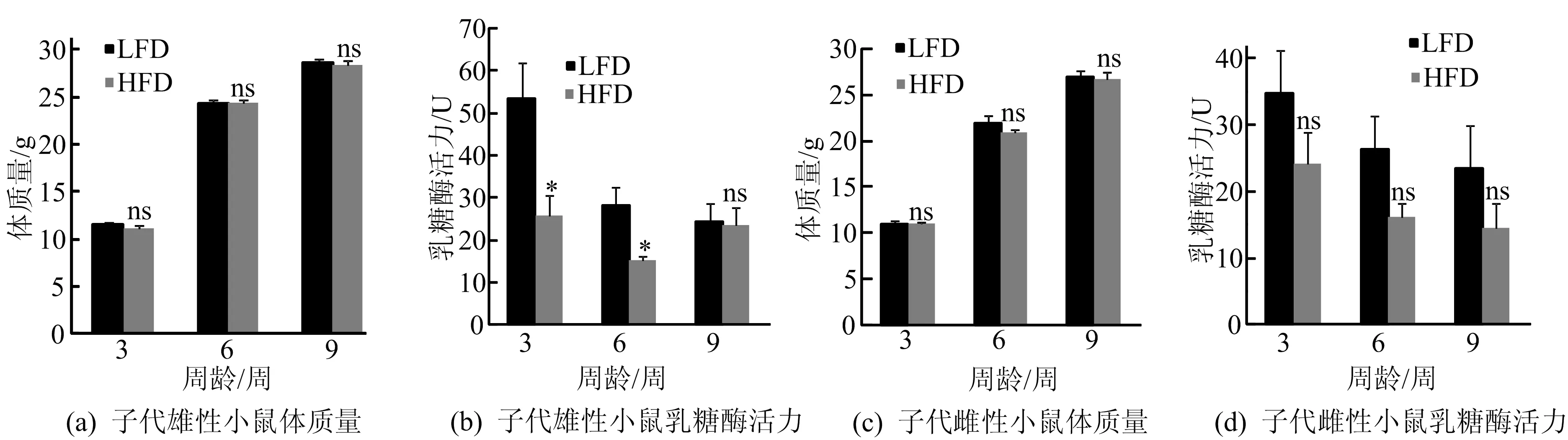
图6 亲代孕前孕中期高脂饮食对子代不同周龄雌雄小鼠体质量和肠道乳糖酶活力的影响
3 结 论
本文研究表明喂养正常低脂饮食的雄性小鼠,伴随着小鼠周龄的增加,肠道中乳糖酶的活力显著降低,这与之前的报道也是一致的[14]。而改变小鼠的饮食为高脂饮食后,不论是改变当代小鼠的饮食,还是改变亲代小鼠孕前孕中或哺乳期的饮食,雄性小鼠小肠中的乳糖酶活力都会比对照的低脂饮食小鼠的乳糖酶活力更低。这可能是由于高脂饮食相比于低脂饮食,脂肪含量高,碳水化合物的含量低,尤其是蔗糖的含量较低。高脂肪油腻的饮食,对于小鼠肠道具有一定的刺激作用,会影响小鼠肠道的消化与吸收。而有研究表明,饮食中的蔗糖会刺激小鼠肠道中乳糖酶mRNA水平的升高,进而提高肠道中乳糖酶的活力[8]。长期喂养低脂高碳水的饮食相比于长期喂养高脂饮食,小鼠肠道中的乳糖酶水平可以维持得更好,这是由于碳水化合物的代谢产物能够在一定程度上对于乳糖酶基因具有一定的调节作用。虽然乳糖酶的作用底物是乳糖,但有研究[15]表明,蔗糖的代谢产物之一果糖,能够影响LPH和GLUT5基因的转录,从而影响肠道中碳水化合物的消化和吸收,改变肠道中双糖酶的活力,包括蔗糖酶和乳糖酶的改变。而雌性小鼠的乳糖酶变化规律不同,且在正常低脂饮食喂养下,检测不到小鼠肠道中的乳糖酶活力随着周龄增长而出现的生理性降低的现象,这可能是雌性小鼠在生长过程中,由于体内的雌性激素的存在,对小鼠肠道中的消化酶产生了一定的作用,研究[16]表明,雌激素有一种潜在的对于肠道中消化酶,包括双糖酶(乳糖酶等)和脂酶的抑制作用,这也可能是造成检测到的雌性小鼠肠道中的乳糖酶活力比雄性小鼠较低的原因。
综上所述,本实验证明了在雄性C57BL/6小鼠生长发育过程中,肠道中的乳糖酶活力会出现生理性的降低,而雌性小鼠的乳糖酶活力随着周龄的增加没有规律性的变化;亲代小鼠孕前孕中期间以及哺乳期间喂养高脂饮食,会导致子代雄性小鼠肠道乳糖酶活力的降低。而在雌性小鼠中,可能由于激素水平等因素的影响,小鼠肠道中乳糖酶的变化与雄性小鼠不一致。

