核果类果树褐腐病在重庆的发生与防治初报
王青 任杰群 图尔罕•麦麦提伊敏 陈国康 党婷婷 罗朝喜 马冠华
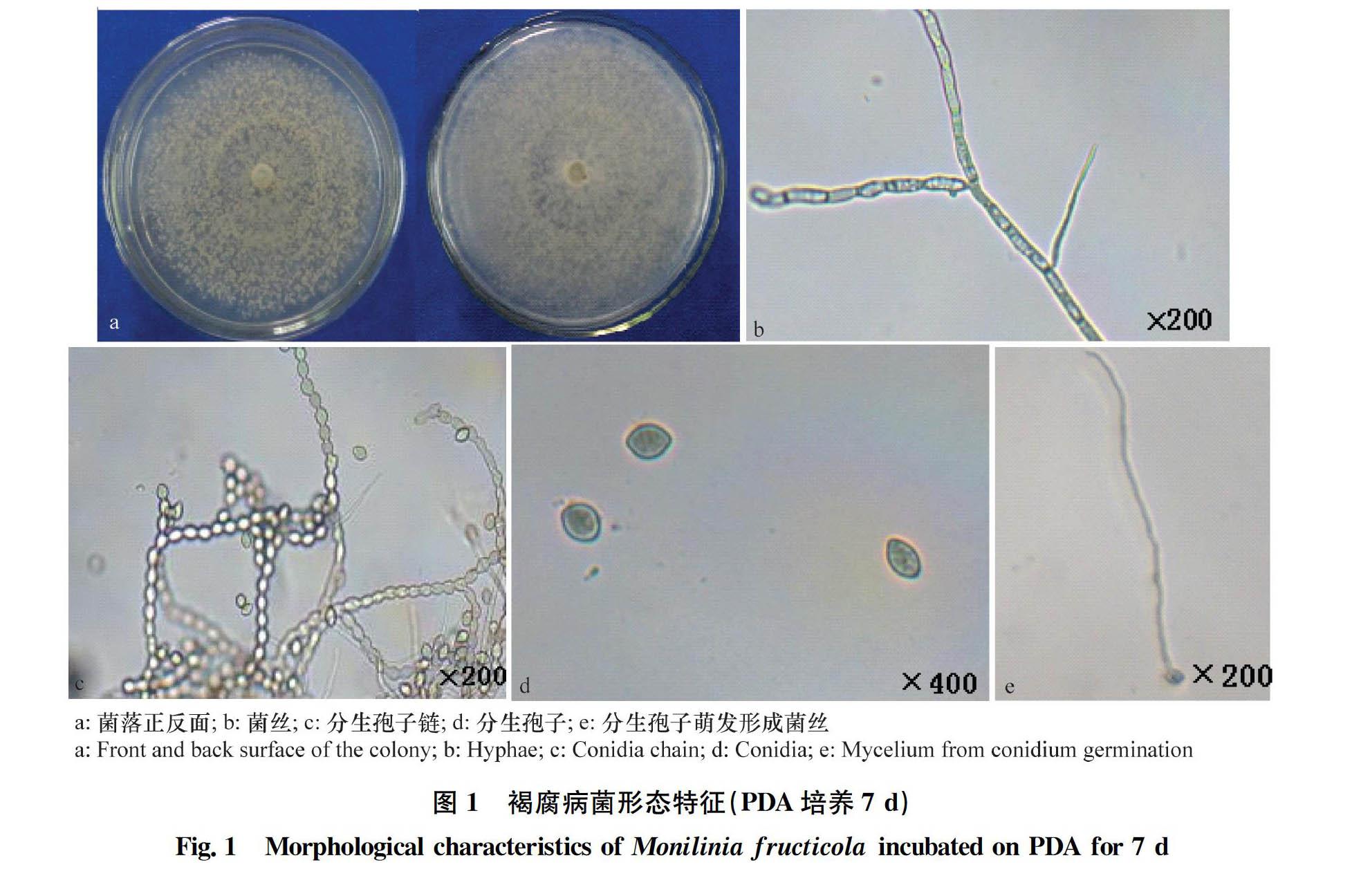



摘要 :近年随着乡村产业调整和果业发展,褐腐病在我国的发生呈加重趋势。本文对重庆地区核果类果树褐腐病的发生状况做了调查分析,在室内通过平板及离体果实试验,筛选拮抗菌和化学药剂,为田间防治实践提供科学依据。主要结果如下:桃褐腐病在重庆普遍发生,核果类果树均易感,病原菌经鉴定为果生链核盘菌Monilinia fructicola;系统调查初步分析发现,降雨时间与李褐腐病发生发展关系最密切,其与病情指数增幅的相关系数R=0.94(P<0.05);平板对峙和离体桃果筛选,获得2株有生防潜力的放线菌YLS5-2和YYDB3-1,二者的抑菌率分别为91.3%和84.5%,相对防效分别为65.1%和67.1%,可能具有较好的应用前景;平板毒力测定和离体桃果控病试验,效果最优的化学药剂分别为戊唑醇、苯甲·丙环唑,其中戊唑醇在推荐浓度处理96 h其离体果实防效仍维持在100%水平。
关键词 :果生链核盘菌; 发生调查; 拮抗放线菌; 化学药剂
中图分类号:
S 436.62
文献标识码: A
DOI: 10.16688/j.zwbh.2020392
Preliminary study on the incidence and control of brown rot on stone fruit trees in Chongqing
WANG Qing1, REN Jiequn2, TUERHAN·Maimaitiyimin1,3, CHEN Guokang1,
DANG Tingting1, LUO Chaoxi4, MA Guanhua1*
(1.College of Plant Protection, Southwest University, Chongqing 400716, China;
2.Chongqing Three Gorges Academy of Agriculture Science, Wanzhou 404155, China;
3.Kashi Custom, The People’s Republic of China, Kashi 844000, China; 4.College of
Plant Science and Technology, Huazhong Agriculture University, Wuhan 430070, China)
Abstract
With the adjustment and development of countryside production, brown rot is getting more serious in China.In this study, the incidence of brown rot on stone fruit trees was investigated and control experiments in vitro peaches were conducted in laboratory.The results indicated that brown rot disease occurred generally in Chongqing areas, and all stone fruits were susceptible to the pathogen, which was finally identified as Monilinia fructicola after single spore isolation.The systematic investigation suggested the rainfall time (h) was the main factor affecting disease increase, with the positive correlation coefficient of 0.94.The inhibiting effects of two actinomycetes strains YLS5-2, YYDB3-1 were 91.3% and 84.5% against M.fructicola on plates, while the relative control efficacies were 65.1% and 67.1% to peach brown rot in vitro fruits, respectively, suggesting that they had potential application prospects in field control.The results of toxicity detection and control tests of six fungicides showed tebuconazole and benzoyl propiconazole had better effects, especially tebuconazole showing more persistent control efficacy in vitro peach fruits in recommended concentrations within 96 hours.
Key words
Monilinia fructicola; incidence investigation; antagonistic actinomycete; fungicide
褐腐病(brown rot)是核果類作物重要的真菌病害,可危害桃、李、杏、樱桃等果树,病原菌包括美澳型果生链核盘菌Monilinia fructicola、松散链核盘菌M.laxa、果生链核盘菌M.fructigena、云南链核盘菌M.yunnanesis、梅果串珠霉Monilia mumecola等,在我国大部分省区以M.fructicola为优势种[1]。褐腐病在世界主要桃产区均有分布[23],我国四川、贵州、云南、河南、山东、北京等16个省市有发生报道[45]。该病主要危害果实,引起果实腐烂、失水干缩形成僵果,也感染花、叶和幼嫩枝梢,造成花、叶和枝干枯萎[69]。在我国桃产区雨水偏多年份,该病发生加重,造成烂果是果园安全生产的主要威胁[1011];果品储运期间也极易发生褐腐病造成产后损失[1213]。病菌以菌丝在僵果或枝梢溃疡部越冬,由分生孢子借助风雨进行侵染[1417]。
褐腐病的防控须从果树休眠期着手贯穿整个生育期,综合运用农业、化学、生物等多种防治措施[78],如通过果园合理施肥,提高果树自身抗病力。或者通过严格清除园内褐腐病僵果及病残体,能显著压低病原菌在桃园的越冬基数,可减少病害初侵染源。化学防治在桃褐腐病的防治实践中占据重要的地位[17],利用拮抗菌等微生物资源防治采后烂果也是近年来的研究热点[1822]。
重庆山地桃、李种植历史悠久,近年随着国家乡村振兴和脱贫政策的推行,桃和李水果产业呈发展壮大之势,但有关褐腐病在重庆核果类果树的发生情况和有效防治手段尚不明确。鉴于此,本文开展了褐腐病在重庆的发生状况调查,以及初步的防病试验探索,以基本明确其发病规律,为褐腐病科学防控提供依据和可能途径。
1 材料与方法
1.1 重庆地区褐腐病发生调查
2014年-2017年在重庆市代表区县开展核果类果树褐腐病调查采样,带回室内进行分离鉴定。同时在北碚区缙云山(106oE,29oN)农家普种的李园开展褐腐病发生发展系统调查。于2014年5月-7月采用五点法每7 d调查1次,统计病果率和病情指数。鉴于褐腐病尚无统一的分级标准,依据田间褐腐病病斑扩展危害特点,参照木瓜褐腐病标准[23],改进拟定了0~9级标准,用以计算病情指数。0级:无病斑,1级:病斑面积占整个果面积6%以下,3级:病斑面积占整个果面积6%~15%,5级:病斑面积占整个果面积16%~25%,7级:病斑面积占整个果面积26%~50%,9级:病斑面积占整个果面积50%以上。当地同期气象数据资料由重庆市北碚区气象局提供。
对分离获得的单孢菌株镜检观察其菌丝和分生孢子形态,委托华中农业大学进行rDNA-ITS分子鉴定。采用针刺伤口接种法,将分离物菌饼(直径6 mm)菌丝面朝下回接于桃果上(成熟期,品种为‘巴南香’),25℃温室培养至发病,再从发病果实病健交界处分离病原菌,完成柯赫氏法则验证。
1.2 拮抗放线菌筛选及离体控病试验
供试放线菌菌株由西南大学植物生态病理研究所菌种资源库提供,分离自烤烟黑胫病田健康烟株根围。采用平板对峙法测定供试放线菌的抑菌带宽,计算其抑菌率[24]。以桃褐腐菌株CH-4-1(M.fructicola,单孢分离自巴南区发病桃果)为靶标菌。用移植饵蘸取待测放线菌菌株(活化前保藏于甘油瓶内),在PDA平板距中心25 mm处划30 mm长的直线,28℃培养2 d后,在平板中央接种直径为6 mm的桃褐腐菌菌饼,每个菌株重复3次,28℃培养7 d后测量各处理的病原菌菌落直径。依据对照与各处理菌落直径的差值,占对照直径的百分比,计算相对抑制率。
离体果实试验方法,采用菌饼无伤接种法[2527]。选择相同品种、外观一致、成熟度相同的健康桃果(成熟期‘巴南香’),以蒸馏水冲洗5 min,75%乙醇表面消毒2 min,自然风干备用。处理1:果实先用拮抗菌发酵液浸泡2 min,1 h后在果实相对两侧面贴6 mm的桃褐腐菌菌饼,菌丝面朝下;处理2:发病对照(CK1),果实不浸泡拮抗菌发酵液只接病原菌菌饼;处理3:清水对照(CK2),果实只浸泡无菌水;处理 4:发酵液对照(CK3),果实只浸泡拮抗菌发酵液。每个处理重复3次,每个重复5个果实,在25℃,光照L∥D=12 h∥12 h,相对湿度约95%条件下培养。从接种病原菌到果实全部腐烂,每隔12 h观察记录发病情况,测量病斑直径,依据对照与各处理病斑直径的差值,占对照病斑(CK1)直径的百分比,计算相对防效。
拮抗放线菌发酵液的制备方法:拮抗放线菌于高氏一号培养基上28℃活化4 d后,再接种于盛有100 mL高氏一号液体培养基的250 mL三角瓶中,28℃、180 r/min振荡培养4 d;然后按2%(V/V)接种量于液体培养基中再次振荡培养5 d。使用前加0.5%体积比吐温-80,备用。
1.3 化学药剂抑菌测定及离体控病试验
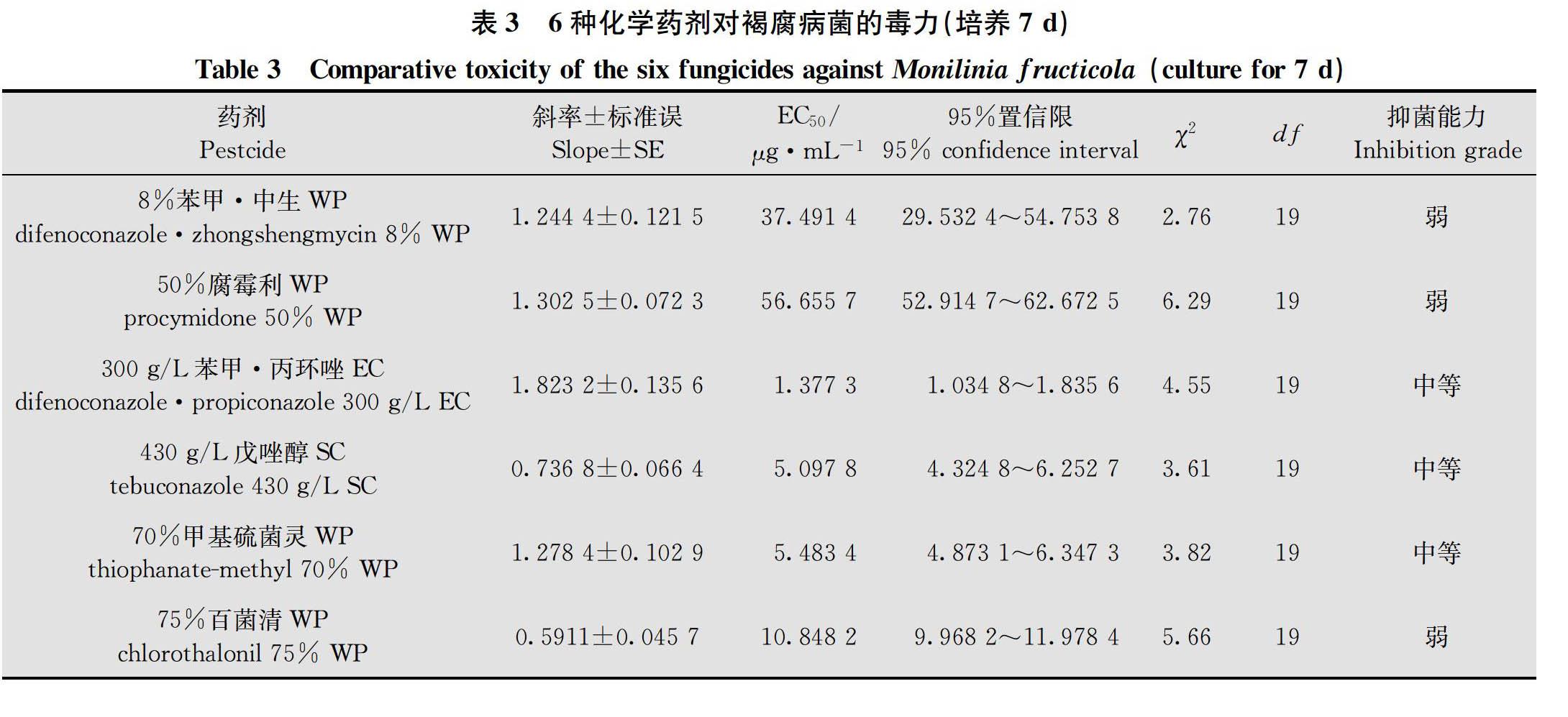
采用菌絲生长速率法,测定化学药剂对桃褐腐病菌菌株CH-4-1菌丝生长的抑制作用[1011],选择文献报道生产上常用的广谱杀菌剂,由东莞市瑞德丰生物科技有限公司生产的8%苯甲·中生可湿性粉剂(WP)、50%腐霉利可湿性粉剂(WP)、300 g/L苯甲·丙环唑乳油(EC)、430 g/L戊唑醇悬浮剂(SC)、70%甲基硫菌灵可湿性粉剂(WP)、75%百菌清可湿性粉剂(WP) 6种化学药剂。打取直径6 mm菌饼接种于含有0.1、0.5、1、10、100 μg/mL 5个不同浓度药剂的PDA平板上,以加l mL无菌水培养基为对照,每个浓度重复4次。在25℃恒温培养箱中培养,7 d后采用十字交叉法测量菌落直径,计算杀菌剂对菌丝体生长的相对抑制率,并建立毒力回归方程y=a+bx,计算化学药剂EC 50和相关系数。根据EC 50评价杀菌剂毒力[10]:EC 50≤0.01 μg/mL,很强;0.01 μg/mL<EC 50≤0.1 μg/mL,强;0.1 μg/mL<EC 50≤1.0 μg/mL,较强;1.0 μg/mL<EC 50≤5.0 μg/mL,中等;5.0 μg/mL<EC 50≤10.0 μg/mL,较弱;EC 50>10.0 μg/mL,弱。
化学药剂离体控病试验,采用菌饼无伤接种法,具体处理如下,处理1:桃果(成熟期‘巴南香’)先用化学药剂按质量百分比浓度稀释液浸泡2 min,1 h后在果实相对两侧面贴6 mm的病原菌菌饼,菌丝面朝下;处理2:发病对照(CK1),果实不浸泡化学药剂,只接病原菌;处理3:清水对照(CK2),果实只浸泡无菌水。测量病斑直径,依据对照与各处理病斑直径的差值,占对照病斑直径的百分比,计算相对防效。
2 结果与分析
2.1 褐腐病在重庆地区的发生状况
2014年-2017年通过对重庆果树主要种植区县实地调查,发现褐腐病在该地区发生较为普遍,包括北碚区、渝北区、巴南区、合川区、永川区、涪陵区、南川区、酉阳县、垫江县,基本涵盖重庆东南西北及中心区域。褐腐病危害果树,包括樱桃(4月)、杏(5月)、桃(5、6月)、李(6、7月);其中李褐腐病普遍发生、受害严重,其次是桃褐腐病,樱桃尽管种植普遍,但仅在巴南区采集到病害样本,由于杏在重庆各地种植稀少,其调查地点十分有限,仅在垫江县五洞镇果园采集到病害样本。
对重庆各区县采集的桃、李、杏褐腐病病果,通过单孢分离、形态学观察、致病性测定,并委托华中农业大学罗朝喜实验室进行分子鉴定,对送检的代表性菌株采用多重PCR检测,均扩增获得354 bp特异性片段,确定为果生链核盘菌M.fructicola,形态特征见图1。在致病性回接试验中,从接种后发病的果实上再次分离到与接种体形态特征完全一致的菌株。
2.2 影响褐腐病发生的气象因子分析
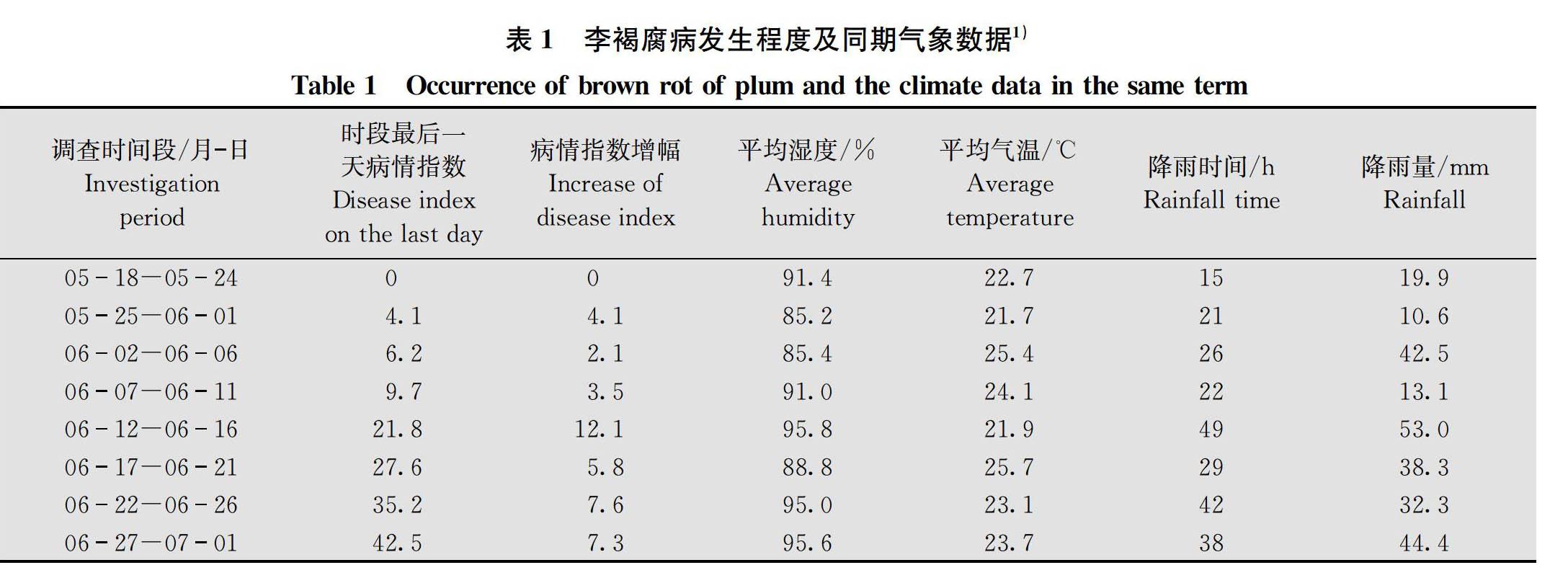
初步分析李褐腐病的系统调查数据与温湿度、降雨量等气象因子之间的关系(表1),结果显示:病情指数在6月11-16日时间段的增幅最大(12.1),由9.7突增至21.8;其次是6月21-26日时间段,增幅为7.6。这两个时间段的平均湿度均在95.0%以上,且湿度增幅较大;湿度增大源于降雨因素,包括时段内降雨时间(h)、时段内降雨量(mm)的增加。特别是6月12-16日时间段,降雨时间累计49 h,较上个时段6月7-11日的22 h增加27 h,降雨量由13.1 mm陡增至53.0 mm,增加近40 mm,与病情指数增幅形成呼应,病情指数增幅与降雨时间的相关性显著(R=0.94,P<0.05),与降雨量的相关性不显著(R=0.64,P>0.05)。而同期气温因降雨而降低,与病情指数增幅之间无相关性(R=0.04)。
2.3 拮抗生防菌筛选及离体控病效果
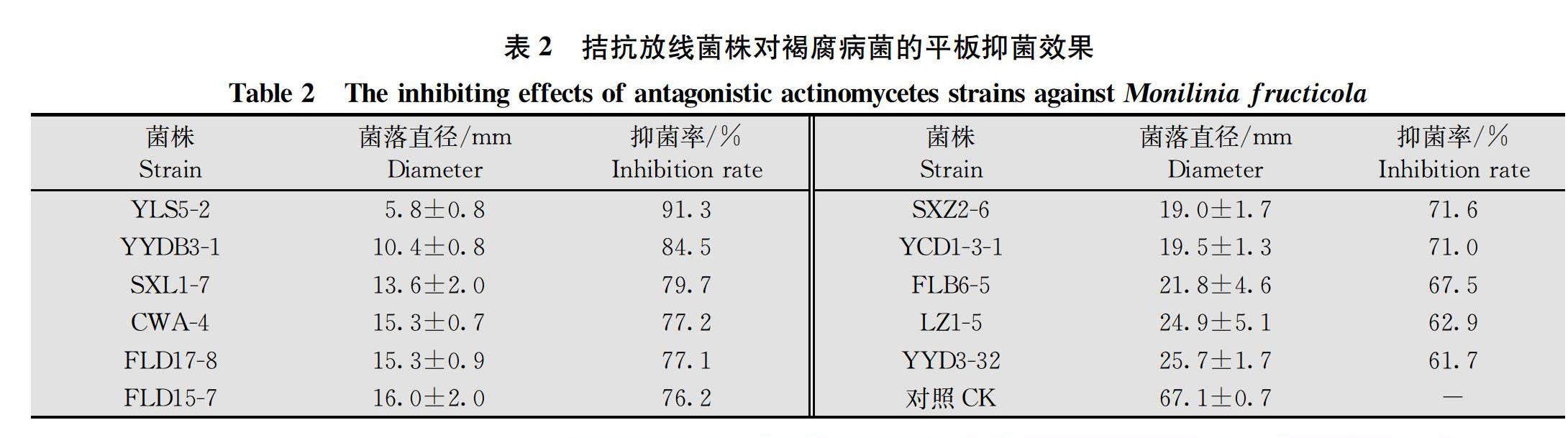
通过平板筛选测定(表2,图2),获得拮抗效果较好的放线菌11株,其中放线菌YLS5-2和YYDB3-1的平板抑菌效果最好,分别达到91.3%和84.5%。
选取平板拮抗作用最强的两株菌YLS5-2和YYDB3-1进行离体果实控病试验(图3)。结果显示,二者的相对防效在接种病原菌后60 h达最高值,分别为65.1%和67.1%,其中菌株YYDB3-1在48~120 h的防效持续高于YLS5-2;60 h后二者防效均呈下降趋势,但菌株YYDB3-1处理的病斑扩展较慢,防效下降相对平缓,表现出较强的稳定性。
2.4 化学药剂抑菌测定及离体控病效果
6种供试化学药剂的抑菌能力从高到低依次为(表3):300 g/L苯甲·丙环唑EC、430 g/L戊唑醇SC、70%甲基硫菌灵WP、75%百菌清WP、8%苯甲·中生WP、50%腐霉利WP。比较上述药剂的离体控病效果,发现430 g/L戊唑醇SC的防治效果最好且比较稳定,其质量浓度500倍、1 000倍稀释液处理96 h的相对防效均为100%,伤口处未见有病斑(图4),而同期百菌清等其他药剂均出现较明显的扩大病斑。如百菌清1 000倍处理96 h的病斑直径34.7 mm,而发病对照为46.6 mm,其相对防效仅为25.5%。
3 讨论
研究初步明确了褐腐病在重庆地区核果类作物的发生危害状况,且从桃、李、杏果实上获得的褐腐菌单孢,经鉴定均为果生链核盘菌Monilinia fructicola。Yin等仅在巴南区乌皮樱桃上发现了M.mumecola[28],这表明M.fructicola是重庆地区的优势种,而有关种间是否存在消长动态,还需要较长期的跟踪监测来证实。华中农业大学开发的多重PCR检测方法能区分我国褐腐菌主要类群,从M.fructicola、M.yunnanensis和M.mumecola褐腐病菌扩增出的特异片段长度分别为354、237 bp和712 bp[1]。
分析发现褐腐病在李园的发生趋势与降雨时间成显著正相关,而与降雨量、气温、湿度等无显著相关性,与前人的部分研究报道一致[1517]。一段时间内累积的降雨时间,可能影响着病原菌在果园侵染及扩展,該研究结果为重庆山地果园确定褐腐病的防控关键时间提供了科学的预警依据。
试验筛选出2株对桃褐腐病菌有较强拮抗作用的放线菌,在离体果实控病试验中表现优良。这为深入研究应用拮抗放线菌控制褐腐病奠定了基础,拮抗菌株次生代谢产物的成分及生物活性有待进一步研究。
平板抑菌活性和离体控病试验表明,桃褐腐菌对戊唑醇更为敏感,戊唑醇防病效果最好。这与前人的研究结论一致,何献声测定了19种杀菌剂对桃褐腐菌的抑制活性,结果显示戊唑醇具有较高的抑菌活性[11];纪兆林等测定了15种杀菌剂对桃褐腐菌的抑制活性,结果显示戊唑醇、甲基硫菌灵、腐霉利等药剂的EC 50在0.080 2~51.590 0 μg/mL之间[10],也与本研究选用的6种药剂EC 50范围接近。综合考虑认为,化学药剂戊唑醇可能具有更好的褐腐病防控应用优势。
参考文献
[1] 胡勐郡. 中国桃褐腐病菌及其抗药性相关研究[D]. 武汉: 华中农业大学, 2013.
[2] OGAWA J M, ZEHER E I, BIRD G. Brown rot, compendium of stone fruit disease [M]. USA: American Phytopathological Society Press, 1995: 710.
[3] MICHAILIDES T J, MORGAN D P, FELTS D. Detection and significance of symptomless latent infection of Monilinia fructicola in California stone fruit [J]. Phytopathology, 2000, 90: 48.
[4] 中国农业科学院果树研究所柑橘研究所. 中国果树病虫志[M]. 第2版. 北京: 中国农业出版社, 1994: 657678.
[5] 陈笑瑜, 国立耘, 骆勇, 等. 北京桃褐腐病调查[C]∥中国植物病理学会青年学术研讨会论文集. 北京:中国农业科学技术出版社,2003: 167169.
[6] 李正. 不同杀菌剂对桃褐腐病的防治效果研究[J]. 现代农业科技, 2019(22): 6568.
[7] 陆彦, 龚卫良, 殷茵, 等. 不同杀菌剂对桃褐腐病的田间防治效果[J]. 农药科学与管理, 2019, 40(2): 5861.
[8] 樊会丽. 桃褐腐病发生及综合防治技术[J]. 河南农业, 2009(12): 28.
[9] 胡世平, 冷德良, 肖建强, 等. 桃褐腐病的显微识别与综合防治[J]. 果农之友, 2019(9): 3335.
[10]纪兆林, 蒋长根, 戴慧俊, 等. 不同杀菌剂对桃褐腐病菌的毒力测定[J]. 中国南方果树, 2013, 42(5): 9597.
[11]何献声. 19种杀菌剂对桃褐腐病离体抑菌活性[J]. 农药, 2011, 50(11): 853854.
[12]HONG Chuanxue, MICHAILIDES T J, HOLTZ B A. Effects of wounding, inoculum density and biological control agents on postharvest brown rot of stone fruits [J]. Plant Disease, 1998, 82(11): 12101216.
[13]SMILANICK J L, DENISA R, BOSCH J R. Control of postharvest brown rot of nectarines and peaches by Pseudomonas species [J]. Crop Protection, 1993, 12(7): 513520.
[14]NGUGI H K, SCHERM H, NESMITH D S. Distribution of pseudosclerotia of Monilinia vaccinii-corymbosi and risk of apothecial emergence following mechanical cultivation [J]. Phytopathology, 2002, 92(8): 7788.
[15]BIGGS A R, NORTHOVER J. Inoculum sources for Monilinia fructicola in Ontario peach orchards [J]. Canada Journal of Plant Pathology, 1985, 7(3): 302307.
[16]钟亚凤. 北京地区桃褐腐病发生规律的研究[D]. 北京: 中国农业大学, 2007.
[17]李世访, 陈策. 桃褐腐病的发生和防治[J]. 植物保护, 2009, 35(2): 134139.
[18]侯旭, 关伟, 胡晓, 等. 桃树根部内生真菌ZJ-4的分离鉴定及其对桃褐腐病的抑制效果[J]. 微生物学杂志, 2018, 38(2): 6369.
[19]WITTING H P P, JOHNSON K B, PSCHEIDT J W. Effect of epiphytic fungi on brown rot blossom blight and latent infections in sweet cherry [J]. Plant Disease, 1997, 81(4): 383387.
[20]LARENA L, TORTES R, DECAL A. Biological control of postharvest brown rot (Monilinia spp.) of peaches, by weld applications of Epicoccum nigrum [J]. Biological Control, 2005, 32(2): 305310.
[21]李美霞, 冯晓元, 邓西民, 等. 植物提取物对桃采后褐腐病(Monilinia fructicola)的防治研究[J]. 保鲜与加工, 2004, 4(3): 2729.
[22]范青, 田世平, 李永兴, 等. 枯草芽孢杆菌(B-912)对桃和油桃褐腐病的抑制效果[J]. 植物学报, 2000, 42(11): 11371143.
[23]邵伟. 木瓜褐腐病的病原学、发生规律及防治技术研究[D]. 武汉: 华中农业大学, 2009.
[24]王丽珍, 肖崇刚. 重庆烟草主要病害土壤拮抗细菌的筛选[J]. 烟草科技, 2008,41(4): 2526.
[25]熊国如, 赵更峰, 范成明, 等. 拮抗菌株XF1的鉴定和抑菌谱的测定[J]. 云南農业大学学报, 2009, 24(2): 5964.
[26]杨振, 郭红莲, 张晓波, 等. 枯草芽孢杆菌BS-331防治油桃采后病害的研究[J]. 中国果树, 2008(6): 3538.
[27]YNEZ-MENDIZBAI V, ZERIOOH H, VI AS I, et al. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin like lipopeptides [J]. European Journal of Plant Pathology, 2012, 132: 609619.
[28]YIN L F, CHEN G K, CHEN S N, et al. First report of brown rot caused by Monilinia mumecola on Chinese sour cherry in Chongqing municipality, China [J]. Plant Disease, 2014, 98(7): 1009.
(责任编辑:田 喆)

