两类抗生素药剂对‘纽荷尔’脐橙黄龙病菌的抑制作用及根际细菌群落结构的影响
黄洋 关巍 王铁霖 晏建红 田二渊 刘堰凤 刘博 杨玉文 赵廷昌





摘要 :為探究磺胺二甲氧嘧啶钠盐(sulfadimethoxine sodium salt,SDM)和氨苄青霉素(ampicillin,AMP)对柑橘黄龙病(citrus Huanglongbing,HLB)的防效以及对柑橘根际细菌群落结构的影响,本试验以‘纽荷尔’脐橙为研究对象,采用0.5 g/L SDM和1 g/L AMP进行灌根,使用TaqMan qPCR技术监测病树叶内黄龙病菌菌量的动态变化,并利用宏基因组技术分析根际细菌群落结构的变化。结果显示,AMP连续处理后病树叶片内黄龙病菌菌含量在一定程度上受到抑制,初步判断AMP对黄龙病有一定的抑制效果,SDM处理对黄龙病菌菌含量抑制效果较差;2类抗生素处理组中根际主要优势类群结构和相对丰度在门、属分类水平上均发生改变,解磷细菌中慢生根瘤菌属Bradyrhizobium细菌的相对丰度在处理后有明显变化,pstA、pstC等部分磷循环功能基因相对丰度发生改变,表明2类抗生素药剂均影响了‘纽荷尔’脐橙病树根际细菌群落结构。
关键词 :柑橘黄龙病; 根际细菌; 宏基因组; 抗生素; 抑制作用
中图分类号:
S 436.66
文献标识码: A
DOI: 10.16688/j.zwbh.2020219
Effects of two antibiotics on pathogen causing Huanglongbing of ‘newhall’ navel orange and the community structure of rhizosphere bacteria
HUANG Yang1#, GUAN Wei1#, WANG Tielin2, YAN Jianhong1, TIAN Eryuan1,
LIU Yanfeng1, LIU Bo1, YANG Yuwen1, ZHAO Tingchang1*
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of plant protection, Chinese Academy
of Agricultural Sciences, Beijing 100193, China; 2. State Key Laboratory Breeding Base of Dao-di Herbs, National
Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China)
Abstract
In order to investigate the control effects of sulfadimethoxine sodium salt (SDM) and ampicillin (AMP) on citrus Huanglongbing (HLB) and the effects of these two chemical agents on the citrus rhizosphere bacteria, the dynamic changes of the quantity of Candidatus Liberibacter asiaticus (CLas) in the leaves of ‘newhall’ navel orange was monitored by using TaqMan qPCR detection technology, and the changes of the bacterial community structure in rhizosphere soil was analyzed by using metagenomic technology. The results showed that the quantity of CLas in the leaves of diseased tree was lower than initial bacteria after root irrigation with 1 g/L AMP, indicating that AMP can suppressed content of the CLas in HLB-infected citrus plants, while the control effect was poor after root irrigation with 0.5 g/L SDM. The structure and relative abundance of the dominant rhizosphere bacteria were changed at the levels of phylum and genus. The relative abundance of Bradyrhizobium with phosphorus-dissolving ability and some phosphorous cycle-related functional genes such as pstA and pstC were changed after treatment with AMP and SDM. It suggested that both antibiotics affected the community structure of the rhizosphere bacteria in ‘newhall’ navel orange.
Key words
citrus Huanglongbing; rhizosphere bacteria; metagenome; antibiotic; inhibition effect
柑橘黄龙病是目前柑橘产业面临的一种最严重的病害,给柑橘产业造成了巨大的经济损失。黄龙病菌以木虱为传播媒介,可侵染芸香科Rutaceae植物如甜橙Citrus sinensis、柚Citrus maxima等多种植物[12]。柑橘黄龙病菌主要分为亚洲种、非洲种和美洲种,扩散最广的是亚洲种Candidatus Liberibacter asiaticus(CLas)。目前,黄龙病防控手段仍然以“三板斧”为主,即使用无毒苗木,及时铲除病树和防控木虱[3]。黄龙病菌是革兰氏阴性细菌,施用广谱性的细菌抗生素可有效控制黄龙病病情发展。田间和温室条件下的抗生素防治试验结果表明无论是向树干注射或浸根,都能在一定程度上控制病原菌[46]。因此药剂防治成了目前在“三板斧”之外防控黄龙病的一个有效手段。
根际土壤微生物对植物健康具有重要作用,其可以通过产生抗生素、调节激素水平等拮抗作用与营养竞争的方式阻止病原菌侵入植物,还可以帮助植物完成物质循环,其中参于磷循环的微生物可以将有机磷转化为无机磷,明显提高土壤中可溶性磷含量,进而提高植株抗旱、抗寒和抗病等能力[712]。研究表明,黄龙病菌侵染柑橘后会优先定殖在根部,可能与根际微生物存在一定的联系[13]。因此开展患黄龙病的柑橘根际细菌群落结构的研究具有重要意义。
为明确氨苄青霉素(ampicillin,AMP)和磺胺二甲氧嘧啶钠盐(sulfadimethoxine sodium salt,SDM)灌根对柑橘黄龙病菌的抑制效果,本研究选取江西省赣州市柑橘科学研究所内严格防控木虱的脐橙果园,采取灌根方式连续多次施入AMP和SDM,采用TaqMan qPCR定量检测技术评价药剂对树体内黄龙病菌的抑制效果,同时基于宏基因组测序技术分析根际土壤细菌群落结构的变化,旨在了解药剂处理对带菌脐橙根际细菌群落结构的影响,同时进一步揭示菌群的动态变化,为解析药剂对柑橘黄龙病的作用机制提供研究基础。
1 材料与方法
1.1 试验地点与供试植物
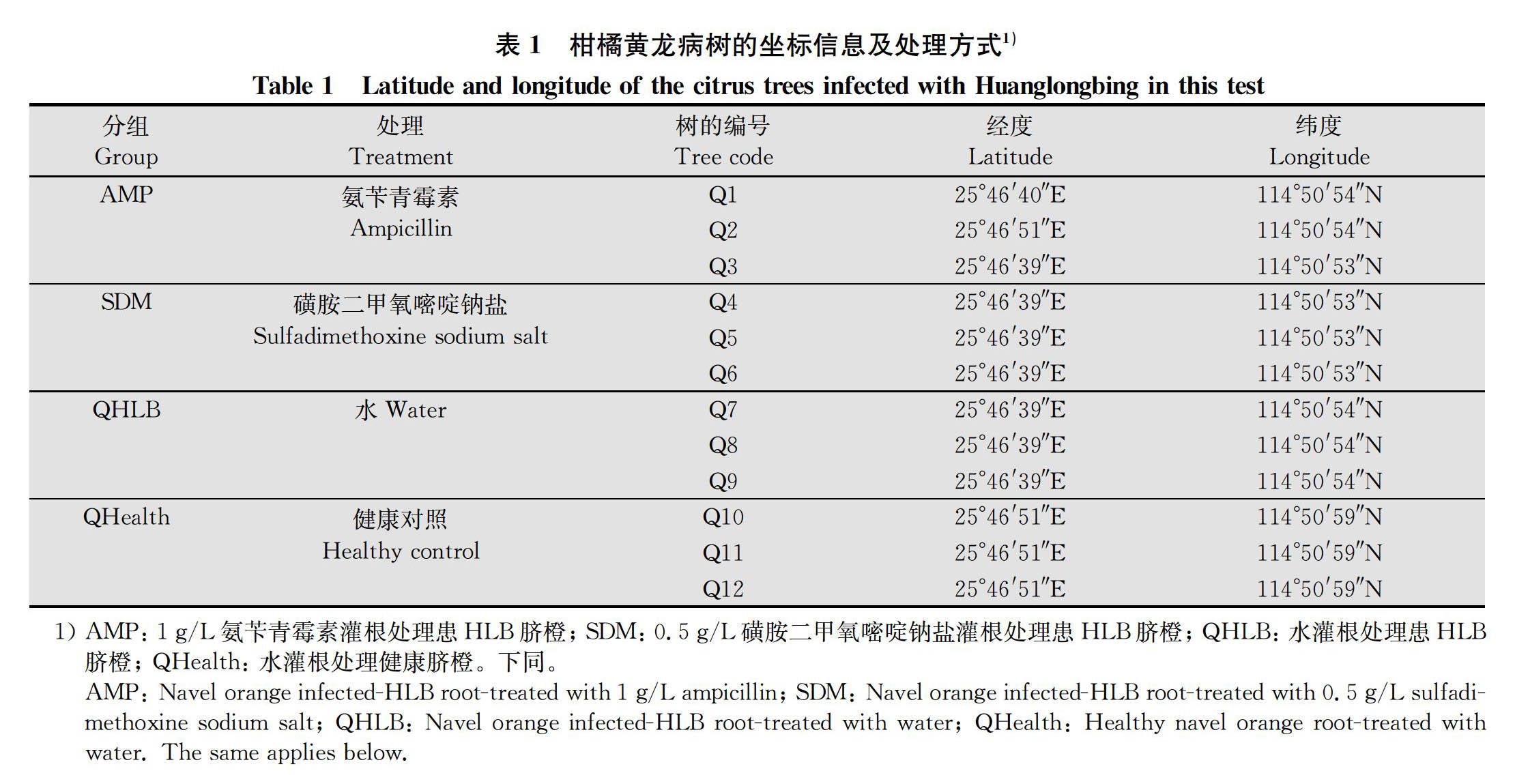
试验地位于江西省赣州市柑橘科学研究所。供试植物包括健康和患黄龙病的‘纽荷尔’脐橙。柑橘树在果园中的详细坐标信息见表1。本试验中所有患病植株均感染黄龙病5年以上。在试验期间,果园按照当地政策管理,严格防控木虱,在病害调查和取样期间均未发现木虱为害。
1.2 试验试剂
氨苄青霉素(ampicillin,AMP)和磺胺二甲氧嘧啶钠盐(sulfadimethoxine sodium salt,SDM)购自中国源叶生物科技有限(上海)公司。
1.3 试验设计
分别于2018年8、10、11、12月,2019年2、3、4、5月进行灌根处理。处理组采用0.5 g/L SDM和1 g/L AMP溶液对感染柑橘黄龙病的病樹灌根,每株1 L,每处理重复3株树;分别设等量清水对病树灌根对照(QHLB)和等量清水对健康树灌根对照(QHealth)。每次灌根前在感染柑橘黄龙病的病树树冠东西南北4个方向各采集4~5片叶,每棵树总共采集16~20片叶,混为1个样品,采集过程避免样品之间交叉污染,并于采样后进行药剂灌根处理。采用TaqMan qPCR检测叶片样品内黄龙病菌(CLas)的含量,以监测CLas含量的动态变化。2018年8月药剂处理前
和2019年5月药剂处理后分别采集脐橙根际土样品,用于分析根际细菌群落结构的变化。
1.4 叶片样品总DNA的提取及CLas含量的检测
取切碎后的脐橙叶中脉约20 mg装入裂解介质管,加入500 μL PBS缓冲液(美国 GE Healthcare Life Sciences),用MP FastPrep-24 5G研磨机(美国 MP Biomedicals)研磨。采用AxyPrep Multisource Genomic DNA Miniprep kit(美国 Axygen)提取叶片总DNA。采用TaqMan荧光定量检测方法于QuantStudio6 Flex(美国 ABI)检测CLas的含量。基于本实验室建立的TaqMan荧光定量检测体系,用含有CLas基因片段的阳性质粒制作标准曲线,为使通过该标准曲线获得的植物总DNA的量具有更好的可比性,将DNA浓度单位转化为CD值(CD=模板拷贝数/总DNA浓度)作为菌含量单位[14]。引物和探针[15]由北京六合华大基因科技有限公司合成。
1.5 根际土样品的采集与制备
在距离树干基部80~120 cm处分别设置5个取样点,用土铲逐段逐层挖去上层覆土,沿侧根找到须根部分,轻轻抖落黏附在根上的较大颗粒。将5个采集点样品合并,装入无菌自封袋干冰运输。将根放入PBS缓冲液中充分搅动,反复清洗至澄清,收集浊液。将浊液过孔径149 μm的尼龙网筛,滤液转移至新的50 mL离心管中,4℃、7 830 r/min离心7 min,弃上清即得到根际土样品,于-80℃保存备用。根际土样品委托北京诺禾致源科技股份有限公司进行宏基因组测序。
1.6 根际细菌群落的宏基因组测序
将检测合格的根际土DNA样品用超声波破碎仪打断,经末端修复、加A尾和测序接头、纯化、PCR扩增等步骤完成文库制备。对文库浓度进行准确定量并验证文库质量,最后按照需求进行Illumina PE150测序。质控过滤后得到有效数据(clean data),进行Metagenome组装,完成基因预测、物种注释、功能数据库注释,进一步基于物种丰度、功能丰度进行聚类分析和差异分析[1617]。
1.7 数据处理与分析
使用DIAMOND软件将unigenes与从NCBI的NR(Version: 20141019)数据库中筛选出的细菌序列进行比对。从各个分类层级上的丰度出发,进行物种相对丰度分析、PCA降维分析。
采用GraphPad prism 8进行数据分析和图表绘制,运用SPSS软件进行单因素方差分析和独立样本t测验分析。
2 结果与分析
2.1 药剂灌根对脐橙植株体内黄龙病菌的抑制作用
自2018年8月至2019年5月患病植株共施用AMP和SDM 8次。每次施药前定点定枝采集不同处理组及清水处理患HLB植株对照组(QHLB)病株的叶片,采用实时荧光定量PCR检测脐橙叶片的带菌量。结果显示,AMP和SDM处理后CLas含量均有变化,但变化趋势不同。2018年8月首次施药后,从2018年10月至2019年3月AMP处理组植株CLas含量均低于起始带菌量,2019年3月下降至最低(1.74×106 CD),而SDM处理组初次施药后于2018年10月菌含量上升,2018年11月至2019年3月呈下降趨势,2019年3月下降至1.94×106CD,除2019年3月外各监测时期CLas含量均高于起始带菌量。两种药剂处理组CLas含量均在2019年4月明显升高,并在5月显著降低。QHLB对照组病株叶片内CLas含量也存在一定的起伏变化,在2019年5月出现增长高峰,上升至1.20×107 CD,分别是AMP和SDM组的43倍和6倍(图1)。处理前AMP组与对照组带菌量无显著差异,除2019年2月和4月AMP组菌含量高于对照组,其他处理时间均低于对照组且差异显著(图1);根据以上结果初步判断AMP灌根对患病脐橙植株内的CLas含量有潜在抑制效果,而SDM灌根后在初次施药2个月后CLas含量明显升高,虽然随后的灌根处理有一定的抑制作用,但并不稳定。
2.2 药剂处理后根际细菌群落结构的变化
根际细菌是植物根际微生态的重要组成成分,直接参与植物多种代谢活动和免疫防御。本试验对AMP和SDM处理前后的脐橙根际土壤样品进行宏基因组测序分析,结果表明,处理后,酸杆菌门Acidobacteria和拟杆菌门Bacteroidetes相对丰度提高、放线菌门Actinobacteria相对丰度降低。主成分分析(PCA)显示,AMP处理、SDM处理分别和患病脐橙对照组(QHLB)不存在交叉重叠,说明药剂对根际细菌群落结构和相对丰度产生重要影响。
门水平的分析结果显示,处理前患病脐橙根际细菌群落的主要成分是放线菌门、变形菌门Proteobacteria、酸杆菌门、拟杆菌门等。处理前,健康脐橙对照组(QHealth)根际中酸杆菌门相对丰度高于患病脐橙,而变形菌门相对丰度远低于患病脐橙。处理后,患病脐橙植株根际土壤主要优势类群和相对丰度发生改变。硝化螺旋菌门在抗生素处理组和QHLB对照组中的相对丰度均低于QHealth对照组。与QHLB对照相比,AMP处理和SDM处理组中放线菌门相对丰度均降低了近50%,而拟杆菌门相对丰度分别提高了0.7倍和0.3倍,SDM处理组中酸杆菌门相对丰度提高了0.5倍。另外,排名前十菌门相对丰度之和在AMP处理、SDM处理和QHLB对照和QHealth对照中分别为79%、69%、81%、80%(图2)。以上结果说明药剂使用影响了一部分有益微生物的相对丰度,AMP处理组物种相对丰度高于SDM处理组,SDM处理后纽荷尔脐橙根际微生物群落结构变化更大。
属水平分析结果显示,处理前,患HLB脐橙根际土壤中慢生根瘤菌属Bradyrhizobium、沙雷氏菌属Serratia、假单胞菌属Pseudomonas、戴氏菌属Dyella细菌的相对丰度均高于健康脐橙。处理后,与QHLB对照相比,AMP处理组和SDM处理组中无色杆菌属Achromobacter、假单胞菌属细菌相对丰度降低,与QHealth对照组相比相对丰度相近。处理前节细菌属Arthrobacter在各样品组间相近,但处理后,各样品组间节细菌属的相对丰度增加(图3)。
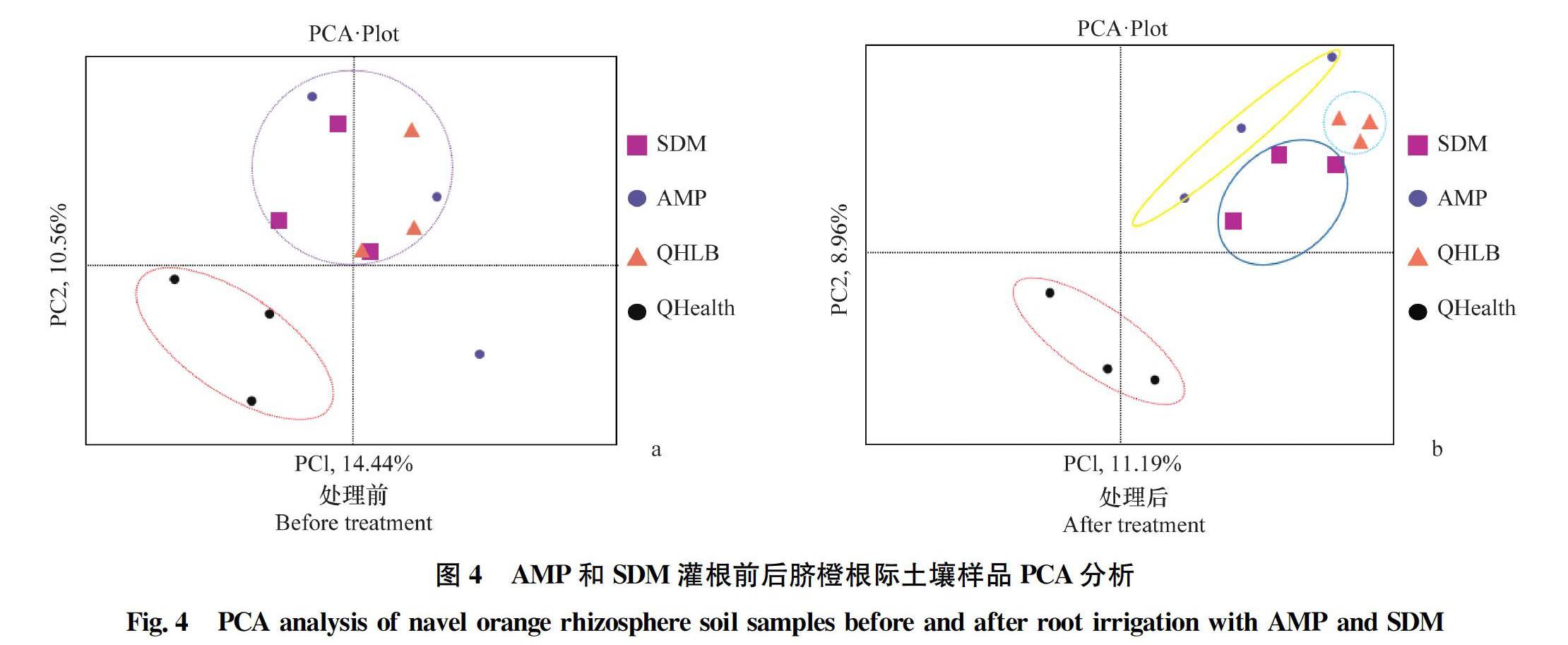
主成分分析(PCA)显示,处理前,不同患病脐橙组的根际土壤样品点聚集在一起,主要分布在第1、2象限,不同组间样品点之间存在交叉重叠,而QHealth组中的样品点聚集在特定区域,主要分布在第3象限,与患病脐橙样品点不存在交叉重叠。药剂灌根处理后,QHealth组根际样品点仍聚集在特定区域,主要分布在第3和第4象限,与抗生素处理组和患病脐橙对照组(QHLB对照)不存在交叉重叠;AMP处理、SDM处理和QHLB对照组中样品点分布在第1象限,QHLB对照与AMP和SDM处理组无交叉重叠区域,与QHealth对照组中样品点距离较处理组更远;AMP和SDM处理组样品点无交叉部分。与QHLB对照组相比,AMP和SDM处理后群落结构均发生显著变化(图4)。
磷是植物体内重要化合物组成成分,是维持植物生长和发育的重要营养元素。我们对相关文献报道的土壤中存在的已知解磷微生物进行了属水平上的分析。处理前在脐橙病株根际土壤样品中共检测到9种解磷微生物,而AMP和SDM处理后,检测到11种解磷微生物,分别属于慢生根瘤菌属、假单胞菌属、戴氏菌属、黄杆菌属Flavobacterium、沙雷氏菌属、节细菌属、欧文氏菌属Erwinia、无色杆菌属、泛生菌属 Pantoea、酸杆菌属Acidobacterium、芽孢杆菌属 Bacillus,其中酸杆菌属、芽胞杆菌属在处理前脐橙根际样品中没有检测到。相对丰度分析发现,处理前各组解磷细菌相对丰度之和以慢生根瘤菌属丰度最高、其次是戴氏菌属、再次是假单胞菌属。进一步分析发现,药剂处理前各组间慢生根瘤菌属相对丰度相近,但健康对照组相对丰度略低于染病组;药剂处理后AMP处理组和SDM处理组慢生根瘤菌属相对丰度与处理前差异显著,而QHLB对照组与处理前差异不显著;药剂处理前各组间假单胞菌属细菌的相对丰度相近;药剂处理后,AMP处理组和SDM处理组的假单胞菌属细菌的相对丰度与健康脐橙相近,且相对丰度较处理前差异均不显著,而QHLB对照组中假单胞菌属相对丰度大幅增长,极显著高于处理前(图5)。以上分析结果表明,药剂可影响解磷属微生物群落,所选的2类抗生素药剂均可能对慢生根瘤菌属细菌有潜在的促进作用,对假单胞菌属细菌有抑制作用。本试验中药剂处理对不同解磷微生物产生了不同程度的促进和抑制效果。
2.3 药剂处理前后黄龙病植株根际微生物磷循环相关功能基因表达水平的差异
利用DIAMOND软件将宏基因组鉴定到的基因与各功能数据库进行比对。分析药剂处理前后根际细菌参与磷循环功能基因表达差异。结果显示处理后部分参与磷循环功能基因相对丰度变化显著。处理前的样品中注释到磷循环功能基因K02038(pstA)、K02037(pstC)和K05986在处理后的样品中没有注释到;而K06080(rcsF)、K09994(phnO)、K03280(lnt)、K00323(NNT)在处理前样品中没有注释到,但处理后相对丰度增加。结合相对丰度比较分析发现,K02221、K06019(corC)、K05306(phnX)、K06080(phnA)相对丰度表现为QHealth对照>QHLB对照>SDM处理>AMP处理。磷酸酶基因相对丰度比较分析发现,处理前K01085(agp)、K01096(pgpB)、K09612(iap)、K03788(aphA)、K12945(nudK)、K12978(lpxF)在抗生素處理组中的相对丰度低于QHLB对照,而K01078(PHO)、K05695(PTPRF)、K17458(PPP1R16A)、K17499(PPM1G)、K03456(PPP2R1)、K04461(PPM1B)在抗生素处理组中的相对丰度高于QHLB对照。处理后在健康脐橙中没有注释到K05695、K17499、K01096和K03788。磷酸酶基因K01078、K17458、K04461相对丰度表现为QHealth对照>AMP处理>SDM处理>QHLB对照,但K09612、K12945相对丰度表现为QHLB对照>SDM处理>AMP处理>QHealth对照(图6)。说明药剂处理对脐橙根际磷循环功能基因产生了影响。
3 结论与讨论
赣南脐橙是赣州主要特色产业,近年来受柑橘黄龙病影响经济损失巨大。因病原菌无法培养,目前暂无抗黄龙病柑橘品种,故药剂防治传播介体是目前有效的黄龙病防治方法。即便如此,使用药剂直接防治病原菌依然是目前黄龙病研究热点之一。研究表明树干注射0.1 g/株土霉素能够有效治疗感染黄龙病 4年的夏橙[18],树干注射青霉素和链霉素可有效缓解柑橘植株黄龙病症状和病菌含量[19]。本研究结果进一步揭示,采用氨苄青霉素灌根在一定程度上能有效抑制脐橙植株体内黄龙病菌含量,而磺胺二甲氧嘧啶钠盐的抑制效果较差。
针对上述研究结果,进一步结合宏基因组测序技术,比较药剂处理前后患病脐橙植株根际细菌群落结构差异。目前越来越多研究证明植物和微生物在长期进化过程中可以达到一种高度密切的共生关系,进而帮助植物完成营养吸收、加速生长和增强抗逆性[2022]。研究表明黄龙病与根际细菌群落密切相关,柑橘患黄龙病后其根际微生物群落结构和基因功能均发生变化[2324]。本研究中,门水平上分析发现处理前健康脐橙中酸杆菌门的相对丰度高于患病脐橙,变形菌门相对丰度低于患病脐橙,与先前研究结果存在差异,分析原因可能是地理位置或者柑橘品种不同导致[25]。灌根处理后,AMP和SDM处理组酸杆菌门、拟杆菌门的相对丰度均高于QHLB对照。慢生根瘤菌属相对丰度在AMP和SDM处理前后均差异显著,其中SDM对根际有益微生物的影响大于AMP。已有研究表明土壤中的酸杆菌、根瘤菌在植物生长过程中具有重要作用,具有明显的生物降解和生物合成能力,可以抵抗多种病原菌、促进根际营养吸收,保持植株土壤氮磷平衡以及促进植物的生长[2627]。Trivedi等
对患黄龙病柑橘根际微生物进行溶磷、固氮等能力测试,发现假单胞菌属、沙雷氏菌属、伯克氏菌属Burkholderia对患黄龙病柑橘生长具有有益作用[28]。而在本研究中发现慢生根瘤菌属可能对黄龙病防治和根际土壤物质循环及生态环境构建中具有重要作用。磷循环相关功能基因对根际微生物维持植物磷代谢平衡具有重要作用,与轮作花生相比,轮荒后杨树林磷循环功能基因升高,解磷微生物活性增强;pstA、pstC组成pst系统有助于根际细菌完成对Pi 的吸收和利用[2933]。本研究中基因功能分析表明患病脐橙经过药剂处理后部分磷循环关键功能基因和磷酸酶基因相对丰度存在差异,说明药剂处理对磷循环功能基因具有影响,可能改变了磷循环代谢能力,因此后期可结合传统分离培养方法和高通量测序方法,准确掌握药剂处理后脐橙根际细菌群落功能,改善解磷微生物活性,提高患病植株抗病能力。
综上,本试验中1 g/L的氨苄青霉素在一定程度上能抑制脐橙植株内黄龙病原菌,而0.5 g/L磺胺二甲氧嘧啶钠盐不能有效防治黄龙病。在各分类水平上微生物表现出明显差异,这些微生物在植物生长和物质循环过程中具有重要作用。因试验期间赣州市正值雨季,细菌群落结构组成与土壤、季节等环境因素共同决定[34],因此后期试验将结合环境因子进行详细的数据分析。
参考文献
[1] WANG Nian, STELINSKI L L, PELZ-STELINSKI K S, et al. Tale of the Huanglongbing disease pyramid in the context of the citrus microbiome [J]. Phytopathology, 2017, 107(4): 380387.
[2] JOHN V, DOUHAN G W, HALBERT S E, et al. Huanglongbing: an overview of a complex pathosystem ravaging the world’s citrus [J]. Journal of Integrative Plant Biology, 2016, 58(4): 373387.
[3] 程春振, 曾繼吾, 钟云, 等. 柑橘黄龙病研究进展[J]. 园艺学报, 2013, 40(9): 16561668.
[4] 龙钦贤, 庄贤兰, 邱柱石, 等. 加压注射四环素族抗生素治疗甜橙黄龙病树的效果[J]. 中国南方果树, 1981(1): 2932.
[5] 王圣通. 黄龙病对柑橘果实品质的影响及其防治药剂的初步筛选[D]. 广州: 华南农业大学, 2016.
[6] YANG Chuanyu, POWELL C A, DUAN Yongping, et al. Deciphering the bacterial microbiome in Huanglongbing-affected citrus treated with thermotherapy and sulfonamide antibiotics [J/OL]. PLoS ONE, 2016, 11(5): e0155472. DOI: 10.1371/journal.pone.0155472.
[7] WILLIAM F S, PAULITZ T C. Natural suppression of rhizoctonia bare patch in a long-term no-till cropping systems experiment [J]. Plant Disease, 2014, 98(3): 389394.
[8] BERENDSEN R L, VISMANS G, YU Ke, et al. Disease-induced assemblage of a plant-beneficial bacterial consortium [J]. The ISME Journal, 2018, 12(6): 14961507.
[9] SHI Wencong, LI Mingcong, WEI Guangshan. The occurrence of potato common scab correlates with the community composition and function of the geocaulosphere soil microbiome [J/OL]. Microbiome, 2019, 7(1): 14. DOI: 10.1186/s40168-019-0629-2.
[10]VESPERMANN A, KAI M, PIECHULLA B. Rhizobacterial volatiles affect the growth of fungi and Arabidopsis thaliana [J]. Applied and Environmental Microbiology, 2007, 73(17): 56395641.
[11]ZAMIOUDIS C, PIETERSE C M. Modulation of host immunity by beneficial microbes [J]. Molecular Plant-Microbe Interactions, 2012, 25(2): 139150.
[12]VAN DE MORTEL J E, DE VOS R C H, DEKKERS E, et al. Metabolic and transcriptomic changes induced in Arabidopsis by the rhizobacterium Pseudomonas fluorescens SS101[J]. Plant Physiology, 2012, 160(4): 21732188.
[13]ZHANG Muqing, GUO Ying, POWELL C A. Effective antibiotics against ‘Candidatus Liberibacter asiaticus’ in HLB-affected citrus plants identified via the graft-based evaluation [J/OL]. PLoS ONE, 2014, 9(11): e111032. DOI: 10.1371/journal.pone.0111032.
[14]李智鹏, 关巍, 黄洋, 等. 柑橘黄龙病菌在寄主体内含量动态变化研究[J]. 果树学报, 2019, 36(11): 15401548.
[15]LI W B,HARTUNG J,LEVY L. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species
associate with citrus huanglongbing [J]. Journal of Microbiological Methods,2006,66(1):104115.
[16]ZELLER G, TAP J, VOIGT A Y, et al. Potential of fecal microbiota for early-stage detection of colorectal cancer [J/OL]. Molecular Systems Biology, 2014, 10(11): 766. DOI: 10.15252/msb.20145645.
[17]BUCHFINK B, XIE Chao, HUSON D H. Fast and sensitive protein alignment using DIAMOND [J]. Nature Methods, 2014, 12(1): 5960.
[18]姚廷山, 周彦, ACHOR D, et al. 土霉素处理对柑橘黄龙病的防治效果及PP2基因表达的影响[J]. 中国农业科学, 2019, 52(7):114123.
[19]ZHANG Muqing, POWELL C A, GUO Ying, et al. Characterization of the microbial community structure in Candidatus Liberibacter asiaticus-infected citrus plants treated with antibiotics in the field [J/OL]. BMC Microbiology,2013,13: 112. DOI: 10.1186/1471-2180-13-112.
[20]MENDES R, KRUIJT M, DE BRUIJN I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria [J]. Science, 2011, 332(6033): 10971100.
[21]GEDDES B A, PARAMASIVAN P, JOFFRIN A, et al. Engineering transkingdom signaling in plants to control gene expression in rhizosphere bacteria [J/OL]. Nature Communications, 2019, 10(1): 3430. DOI: 10.1038/s41467-019-10882-x.
[22]ZHANG Jingying, LIU Yongxin, ZHANG Na, et al. NRT1.1B is associated with root microbiota composition and nitrogen use in field-grown rice [J]. Nature Biotechnology, 2019, 37(6): 676684.
[23]ZHANG Yunzeng, XU Jin, RIERA N, et al. Huanglongbing impairs the rhizosphere-to-rhizoplane enrichment process of the citrus root-associated microbiome [J/OL]. Microbiome, 2017, 5(1): 97. DOI: 10.1186/s40168-017-0304-4.
[24]XU Jin, ZHANG Yunzeng, ZHANG Pengfan, et al. The structure and function of the global citrus rhizosphere microbiome [J/OL]. Nature Communications, 2018, 9(1): 4894. DOI: 10.1038/s41467-018-07343-2.
[25]TRIVEDI P, HE Zhili, VAN NOSTRAND J D. Huanglongbing alters the structure and functional diversity of microbial communities associated with citrus rhizosphere [J]. The ISME Journal, 2012, 6(2): 363383.
[26]陈文新, 汪恩涛. 中国根瘤菌[M]. 北京:科学出版社, 2011.
[27]常安然, 李佳, 张耸, 等. 基于宏基因组学16S rDNA测序对烟草根际土壤细菌群落组成分析[J]. 中国农业科技导报, 2017, 19(2): 4956.
[28]TRIVEDI P, SPANN T, WANG Nian. Isolation and characterization of beneficial bacteria associated with citrus roots in Florida [J]. Microbial Ecology, 2011, 62(2): 324336.
[29]LEBRUN E S, KANG S. A comparison of computationally predicted functional metagenomes and microarray analysis for microbial P cycle genes in a unique basalt-soil forest [J]. F1000 Research, 2018, 7: 179. DOI: 10.12688/f1000research.13841.1.
[30]马雪松. 连作与轮作对杨树人工林土壤解磷微生物类群特征及磷代谢的影响[D].泰安: 山东农业大学, 2017.
[31]马雪松, 王文波, 王延平, 等. 杨树人工林连作与轮作对土壤解磷微生物类群的影响[J]. 应用生态学报, 2016, 27(6): 18771885.
[32]RAGOT S A, KERTESZ M A, VA MSZROS, et al. Soil phoD and phoX alkaline phosphatase gene diversity responds to multiple environmental factors [J]. FEMS Microbiology Ecology, 2016, 93(1): 118120.
[33]BROKAW A M, EIDE B J, MURADIAN M, et al. Mycobacterium smegmatis PhoU proteins have overlapping functions in phosphate signaling and are essential [J/OL]. Frontiers in Microbiology, 2017, 8: 2523. DOI: 10.3389/fmicb.2017.02523.
[34]RODRIGUEZ P A, ROTHBALLER M, CHOWDHURY S P, et al. Systems biology of plant-microbiome interactions [J]. Molecular Plant, 2019, 12(6): 804821.
(責任编辑:杨明丽)

