89份河北、山西小麦品种抗条锈性评价及抗条锈病基因检测
庞云星 崔宏梅 蔺瑞明 杨慧 冯晶 马东方 徐世昌 王凤涛



摘要 :为明确北部麦区河北、山西育成品种对中国小麦条锈病的抗性水平及部分已定位抗条锈病基因的分布状况,利用小麦条锈菌当前优势小种CYR32、CYR33和CYR34对89份来自河北、山西的小麦品种在温室进行苗期分小种抗性鉴定,在小麦条锈病不同流行区甘肃清水、四川郫县、湖北荆州设置鉴定圃进行成株期抗性鉴定;采用与部分已知基因紧密连锁的分子标记进行抗病基因检测。结果显示,苗期仅‘长4640’‘晋麦91号’‘科农2009’3份品种对CYR32、CYR33和CYR34均表现抗性;在甘肃清水、四川郫县、湖北荆州鉴定圃中抗病材料的比例分别为39.33%、24.72%和58.43%,‘长4640’和‘晋麦91号’为全生育期抗性。通过6个已知抗条锈基因Yr5、Yr9、Yr10、Yr15、Yr18 和Yr26 对89份小麦品种进行分子标记检测,结果表明,13份品种检测到Yr9标记,2份检测到Yr18标记,未检测到Yr5、Yr10、Yr15和Yr26。以上结果表明,河北、山西小麥品种对越冬菌源基地的条锈菌的抗性水平很低,同时成株期抗性基因的利用率低,今后应加强对新抗病基因的利用,育种过程中尽可能在不同流行区进行异地鉴定。
关键词 :小麦条锈病; 抗性鉴定; 成株抗性; 全生育期抗性; 分子检测
中图分类号:
S 435.121.42
文献标识码: A
DOI: 10.16688/j.zwbh.2020507
Resistance evaluation and detection of the resistance genes in 89 wheat cultivars from Hebei and Shanxi provinces to stripe rust
PANG Yunxing1, CUI Hongmei1, LIN Ruiming2,3, YANG Hui4, FENG Jing2,3,
MA Dongfang1, XU Shichang2,3, WANG Fengtao2,3*
(1.Hubei Collaborative Innovation Center for Grain Industry, College of Agriculture, Yangtze University,
Jingzhou 434025, China; 2.State Key Laboratory for Biology of Plant Diseases and Insect Pests,
Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3.National Agricultural Experimental Station for Plant Protection in Gangu, Ministry of Agriculture
and Rural Affairs, Tianshui 741000, China; 4.College of Agricultural Science and Technology,
Shandong Agriculture and Engineering University, Jinan 250100, China)
Abstract
In order to clarify the resistance level and the distribution of mapped resistance genes in cultivars from Hebei and Shanxi provinces, 89 wheat varieties from Hebei and Shanxi were inoculated with the epidemic wheat stripe rust races CYR32, CYR33 and CYR34 in greenhouses.Disease nurseries were set up in different epidemic areas of wheat stripe rust, including Qingshui of Gansu, Pixian of Sichuan and Jingzhou of Hubei to evaluate their resistance levels at adult-plant stage.The linked molecular markers of stripe rust resistance genes were detected in these cultivars.The results showed that only three cultivars (‘Chang 4640’‘Jinmai 91’‘Kenong 2009’) showed resistance to CYR32, CYR33 and CYR34 at seedling stage.The proportions of resistant plants in the nurseries at adult stage were 39.33%, 24.72% and 58.43%, respectively.‘Chang 4640’ and ‘Jinmai 91’ showed all-stage resistance.The 89 wheat varieties were detected with the closely linked molecular markers of stripe rust resistance genes Yr5, Yr9, Yr10, Yr15, Yr18 and Yr26.The results showed that Yr9 and Yr18 were detected in 13 and two cultivars, respectively, while Yr5, Yr10, Yr15 and Yr26 were not detected.These results indicated that the resistance level of Hebei and Shanxi cultivars to stripe rust in the overwintering epidemic base was very low, and the utilization rate of adult resistance genes was low.In the future, more new resistance genes should be utilized, and resistance evaluation of advanced lines in different epidemic areas should be carried out in the breeding process.
Key words
wheat stripe rust; resistance evaluation; adult-plant resistance; all stage resistance; molecular detection
小麦是我国乃至世界上重要的粮食作物。河北省是中国小麦的主产区和商品粮基地之一,总产量仅次于河南、山东和安徽,位居全国第4位;2018年河北和山西两省小麦播种面积和产量分别为234.79万hm2、1 446.1万t和56.03万hm2、228.6万t[12]。山西被称为“面食之乡”,对小麦的需求量大,每年从外省引进量占总消费量的40%左右。因此,维持河北、山西小麦的高产稳产及可持续发展对确保国家粮食安全生产和食品安全均有战略意義。由小麦条锈菌Puccinia striiformis f.sp.tritici引起的小麦条锈病是我国小麦生产上的主要病害,具有发生范围广、流行频率高、病原菌毒性变异快和危害损失重等特点,严重影响小麦的安全生产[34]。小麦条锈病在世界范围内平均造成5%~10%的产量损失[4],感病品种可造成100%的产量损失[5]。近年来随着气候的变化,河北和山西南部的小麦条锈病呈上升趋势,部分年份形成局部大流行。
种植和选育抗病品种,实施基因轮换、基因布局等策略是控制小麦条锈病最经济、安全和环保的措施[56]。目前国际已正式命名抗条锈基因83个(Yr1~Yr83)[7],我国育种家利用条锈病抗源材料培育了许多抗病、高产品种,但是,由于条锈菌高度变异,新致病小种不断产生,小麦品种也相继“丧失”抗性[89]。如2009年,CYR34成为主要流行小种,其毒性谱在CYR32和CYR33的基础上又增加了对Yr24/Yr26基因的致病性,造成在四川、甘肃等地广泛种植的川麦系、小偃系、兰天系、棉农系、洮字系等抗病品种丧失抗性[1011]。Yr5对我国当前流行小种CYR32、CYR33和CYR34均表现为全生育期抗性[12],继澳大利亚发现Yr5的亲和小种(AU85569)之后[13],我国首次在陕西发现对Yr5表现亲和的小种TSA-6[14]。此外,抗病品种的不合理布局和品种抗病性的遗传分化也为新的毒性小种提供了哺育环境。因此,为实现小麦品种抗病的持久性,合理利用抗病品种和抗病基因的布局始终为根本措施。
根据前人的系统研究,中国小麦条锈病的流行区域可以划分为3部分:越夏易变区、冬季繁殖区和春季流行区(包括河南、河北、山东、安徽、江苏等冬小麦种植的主要区域)[15]。河北、山西属于条锈病的东部流行区,品种在审定时虽然进行小麦条锈病的抗性评价,但是由于条锈菌的致病性变异和大区流行的特点,尤其是审定的品种对不同菌源地条锈菌的抗性水平尚不清楚,增加了小麦条锈病治理的难度。本研究选择89份来自河北、山西不同年份审定的小麦品种,苗期利用我国小麦条锈菌3个优势小种CYR32、CYR33和CYR34进行温室接种鉴定,成株期在西部条锈病菌源地的甘肃清水、四川郫县及位于鄂西北冬繁区的湖北荆州设置鉴定圃进行抗性鉴定,综合苗期和成株期抗条锈性评价并结合抗病位点的分子标记检测,明确供试品种抗性特点及可能携带的抗条锈病基因,为河北、山西小麦抗条锈病育种及品种布局提供理论指导。
1 材料与方法
1.1 材料
供试材料为河北、山西不同年份审定的89份小麦品种及系谱(表1),主要种植在河北、山西的南部和中部;感病对照品种为‘铭贤169’。用于分子检测的抗病单基因系包括‘Avocet S*6/Yr5’‘Avocet S*6/Yr9’‘Avocet S*6/Yr10’‘Avocet S*6/Yr15’‘Avocet S*6/Yr18’和‘Avocet S*6/Yr26’,阴性对照为‘Avocet S’。苗期供试菌系为当前小麦条锈菌主要流行小种CYR32、CYR33、CYR34,采自甘肃小麦种植区。以上材料均由中国农业科学院植物保护研究所麦类真菌病害研究组提供。
1.2 89份小麦品种的抗条锈性鉴定
1.2.1 苗期抗性鉴定
苗期抗性鉴定在中国农业科学院植物保护研究所人工气候室进行。将供试材料播于直径为9 cm的花盆,每盆播种5个品种,每个品种5~6粒,置于育苗间培养。待麦苗第1片叶完全展开时,利用电子氟化液(NovecTM 7100)将CYR32、CYR33和CYR34的新鲜夏孢子分别配制成4 mg/mL的孢子悬浮液进行喷雾接种,接种后置于10℃接种间黑暗保湿24 h,然后转到人工气候室,于昼15~18℃/夜11~14℃。光照时间12~14 h/d,光强5 000~6 000 lx条件下培养。待感病对照‘铭贤169’充分发病后,依据农业农村部行业标准(NY/T 2953-2016)《小麦区域试验品种抗条锈病鉴定技术规程》的0~4级标准记载侵染型。0~2级为抗病类型(R),3~4级为感病类型(S)(表2)。
1.2.2 成株期抗性鉴定及条锈菌致病类型鉴定
于2018年-2019年度在甘肃清水县、四川郫县、湖北荆州设置鉴定圃,采用自然发病鉴定方法进行成株期抗性鉴定。采用等行距穴播方式,行长2 m,行距30 cm,株距25 cm,依据播种编号每行播种5个品种,每个品种约15株。共18行。鉴定圃两端分别播种2行感病品种‘铭贤169’作为保护行,鉴定圃边缘种植1行‘铭贤169’作为诱发行。待‘铭贤169’发病严重度达80%以上时,记载侵染型和严重度。侵染型和严重度的划分标准参照农业农村部行业标准(NY/T 2953-2016)《小麦区域试验品种抗条锈病鉴定技术规程》,其中侵染型调查按照0~4级标准,严重度按0、1%、5%、10%、20%、40%、60%、80%、100% 9级标准划分。0级为免疫;0;~1级为高抗;2级为中抗;3级且病情指数>25为中感;4级且病情指数>25为高感(表2)。
甘肃清水、四川郫县鉴定圃周围诱发行‘铭贤169’的条锈病普遍率达到30%和60%左右时,在鉴定圃不同位置采集发病叶片,经温室分离、扩繁后接种中国小麦条锈病鉴别寄主‘Trigo Eureka’‘Fuhard’‘保春128’‘南大2419’‘维尔’‘阿勃’‘早洋’‘阿夫’‘丹麦1号’‘尤皮II号’‘丰产3号’‘洛夫林13’‘抗引655’‘水源11’‘中四’‘洛夫林10’‘Hybrid46’‘Triticum spelta album’‘贵农22’‘铭贤169’进行条锈菌生理小种和致病类型鉴定。
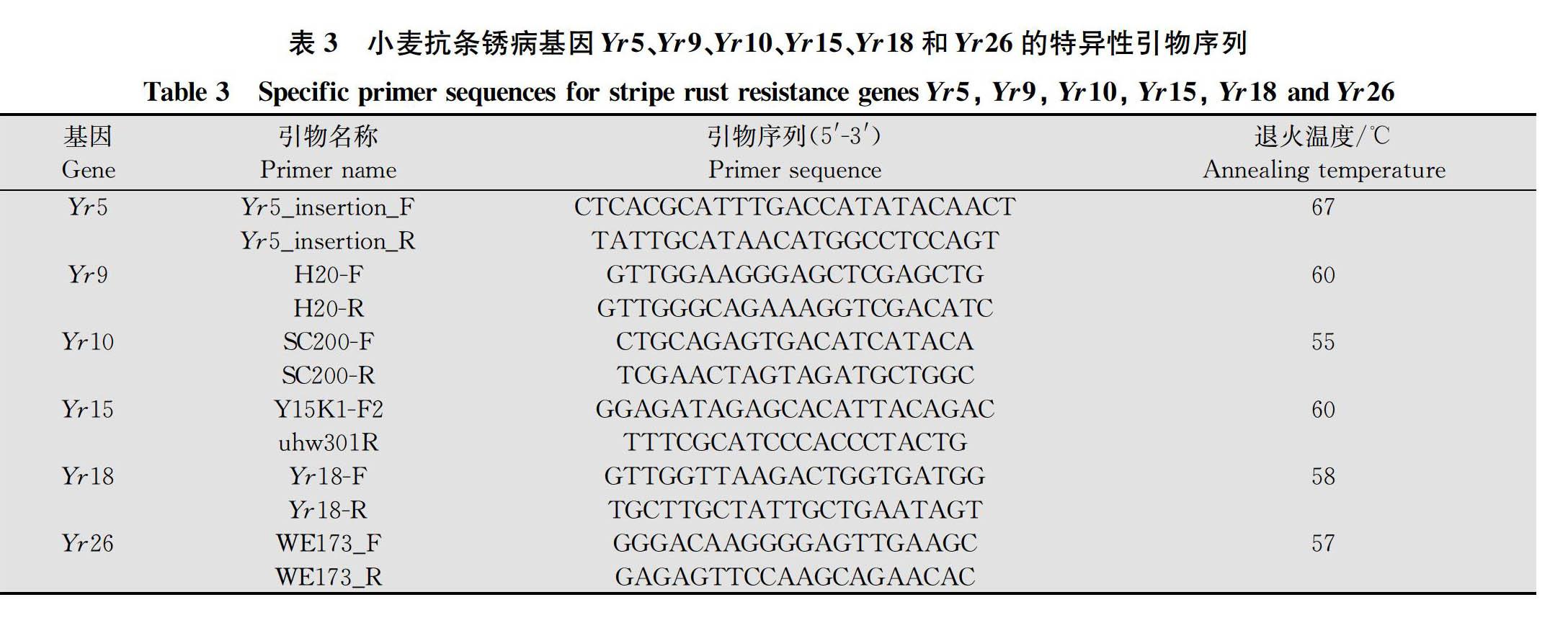
1.3 89份小麦品种的抗病基因分子标记检测
在小麦苗期取新鲜叶片,采用改良的CTAB法提取DNA[16]。选用Yr5[17]、Yr9[18]、Yr10[19]、Yr15[20]、Yr18[21]和Yr26[22]抗条锈病基因的标记及检测方法对供试材料进行分子标记的检测(表3),引物由北京擎科新业生物技术有限公司合成。以‘Avocet S*6/Yr5’‘Avocet S*6/Yr9’‘Avocet S*6/Yr10’‘Avocet S*6/Yr15’‘Avocet S*6/Yr18’和‘Avocet S*6/Yr26’为阳性对照,‘Avocet S’为阴性对照。阳性对照和阴性对照均为本实验室保存。
2 结果与分析
2.1 89份小麦品种抗条锈性鉴定
2.1.1 苗期抗性鉴定
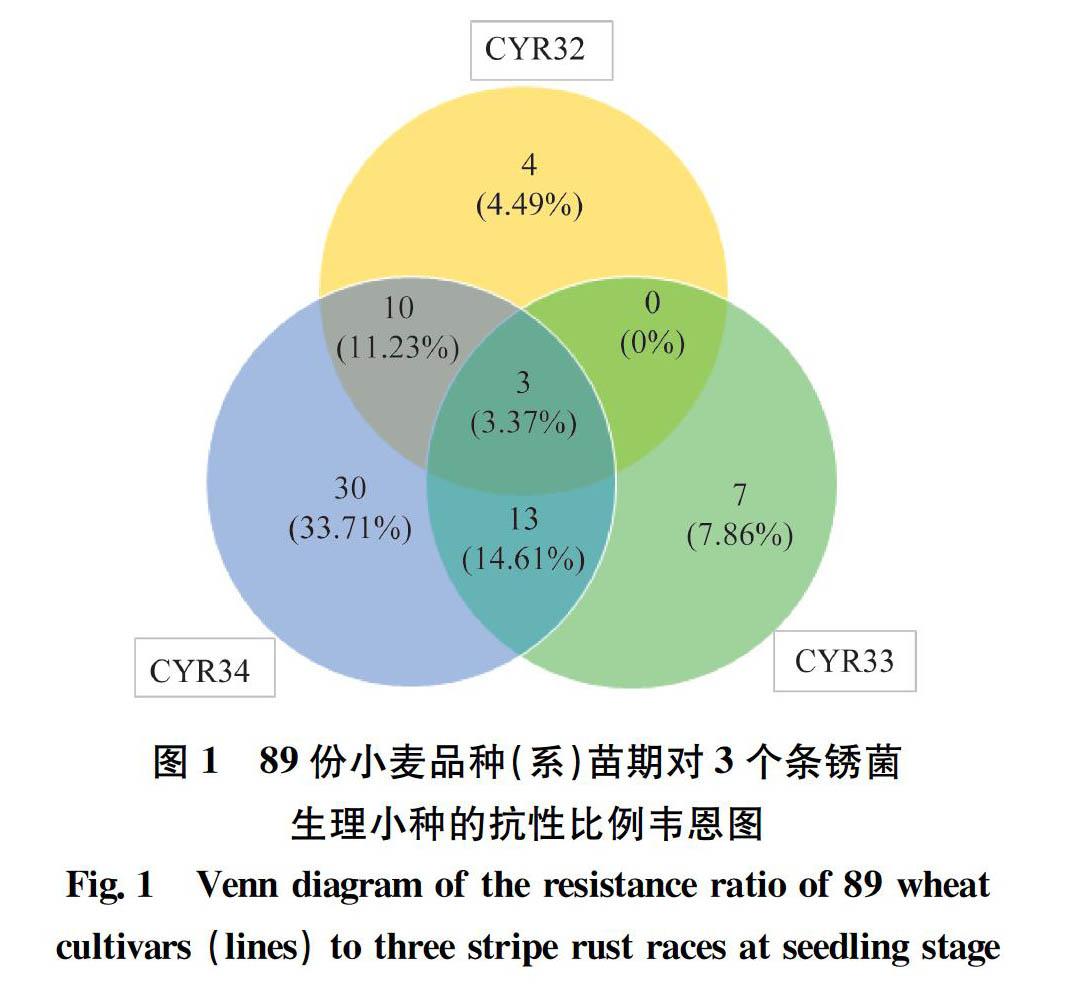
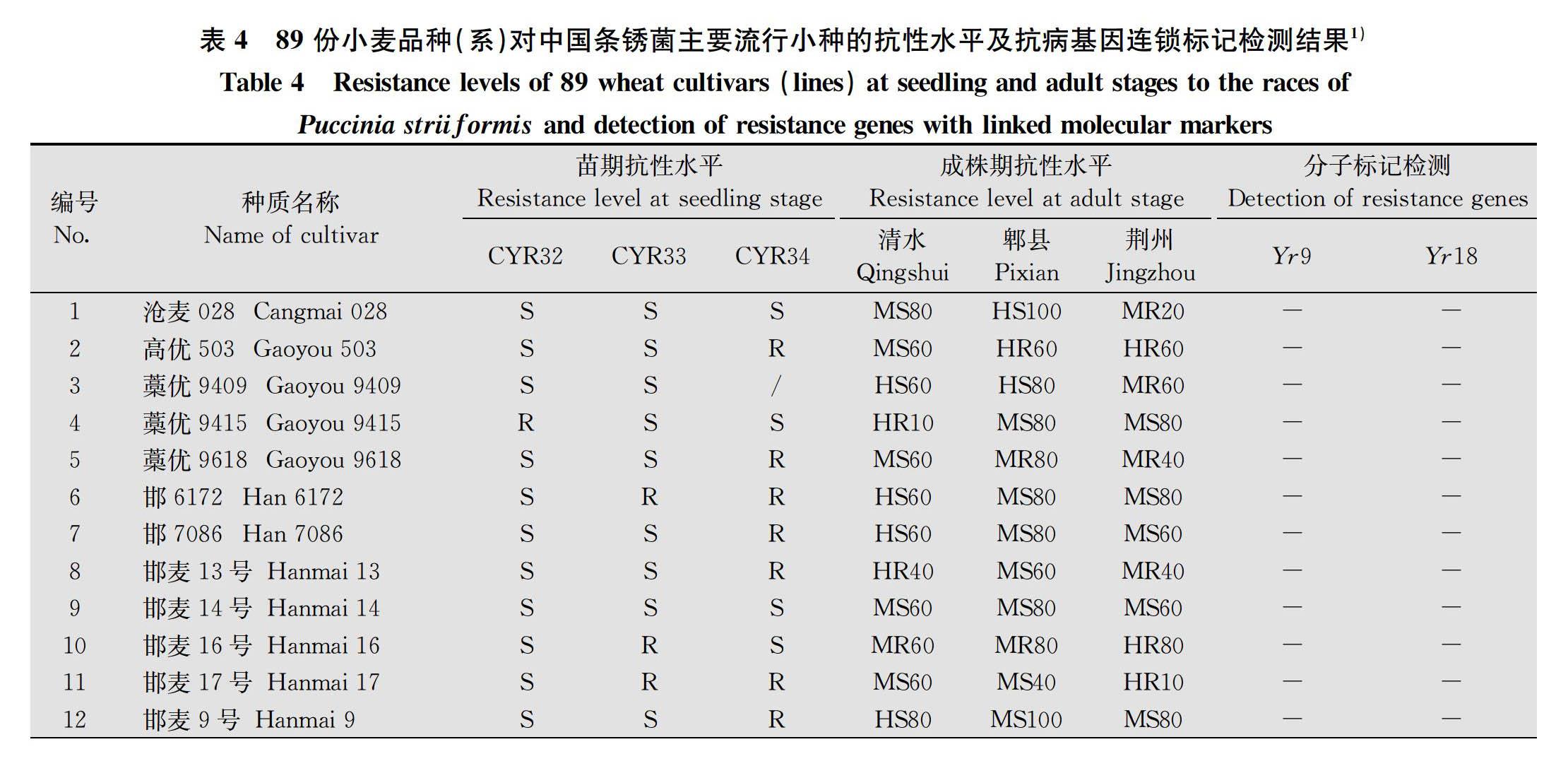
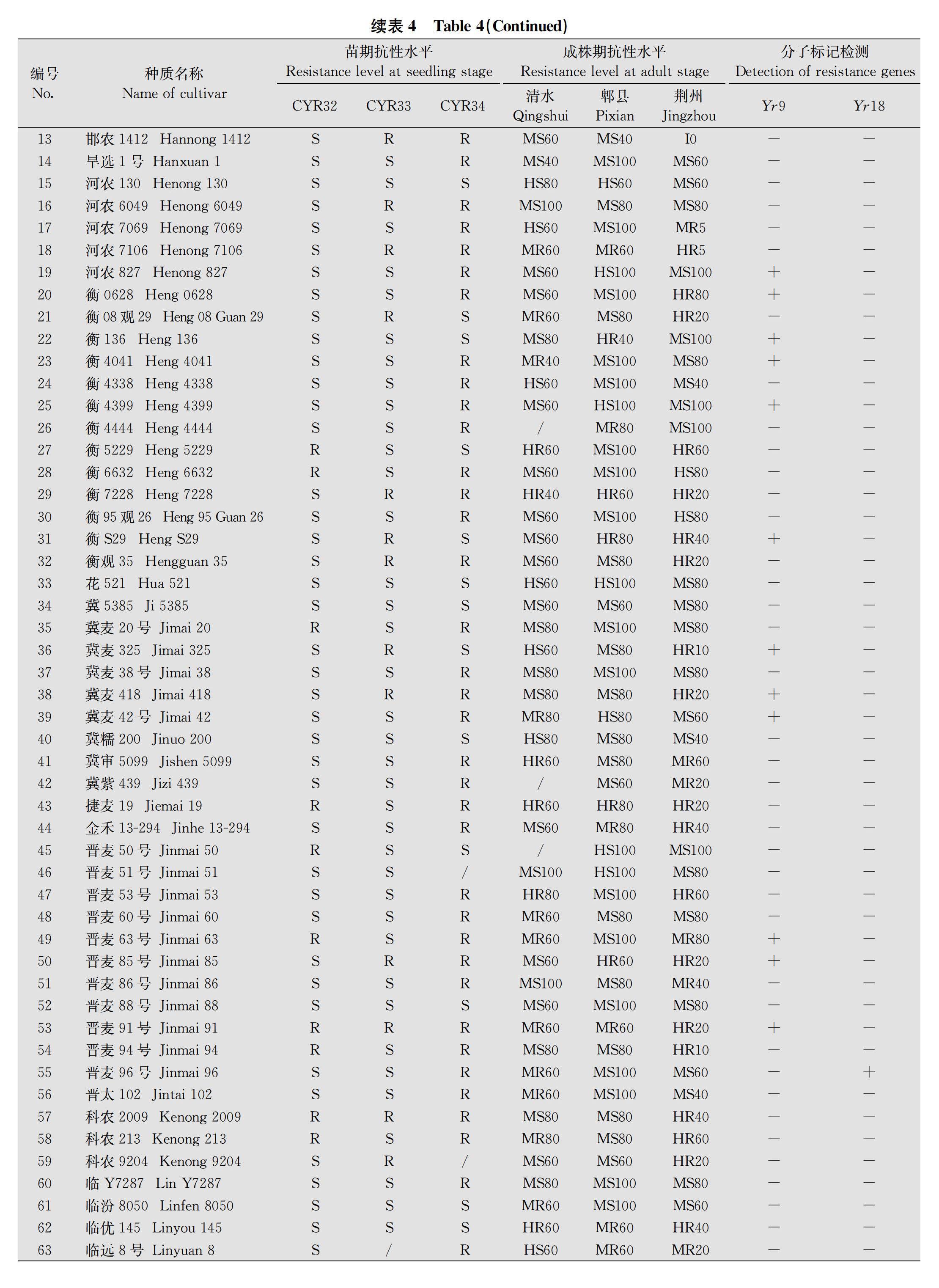
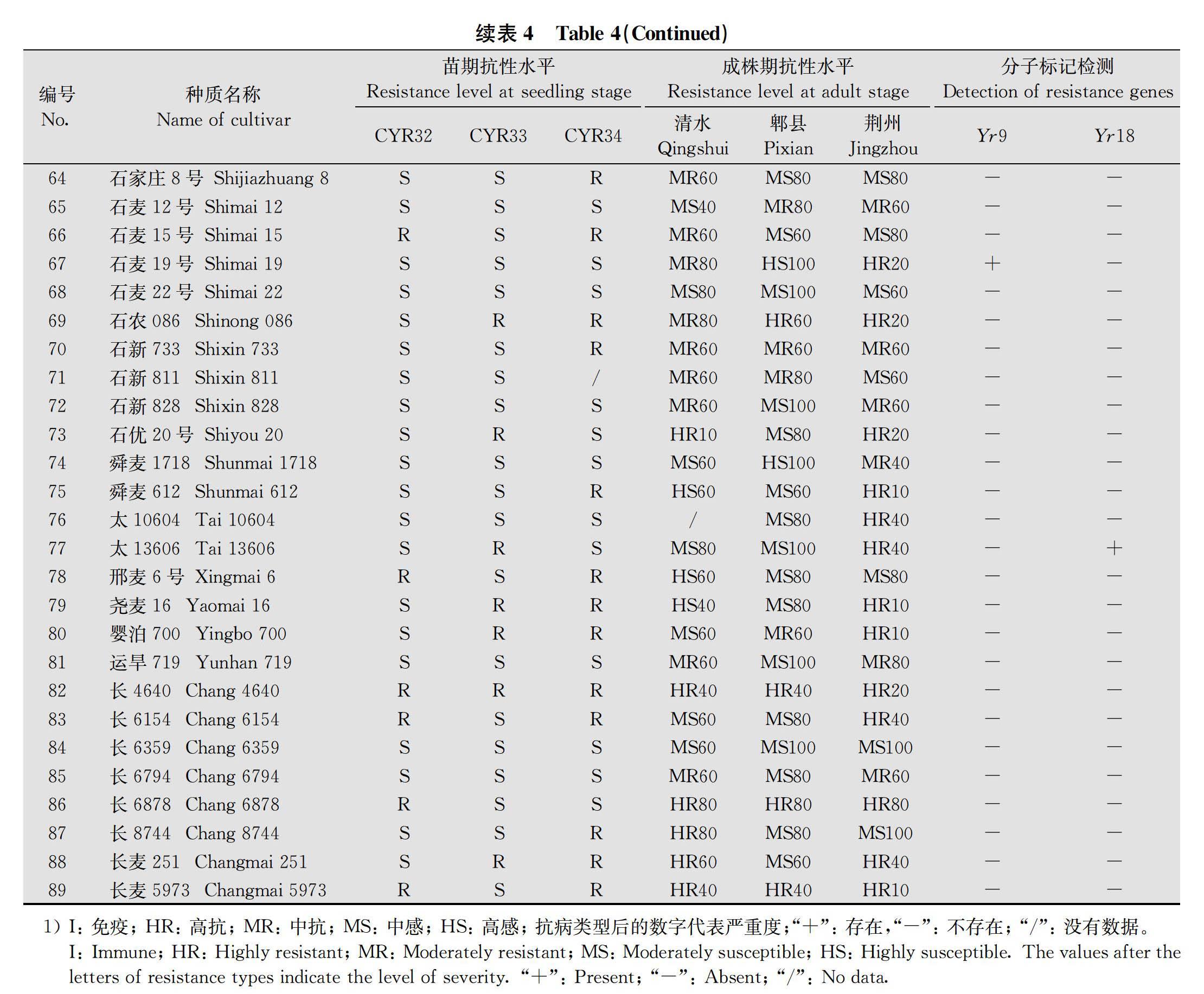
在苗期,将小麦条锈菌流行小种CYR32、CYR33和CYR34分别接种89份小麦品种进行抗性鉴定(表4)。结果表明,89份小麦品种中,对CYR32、CYR33和CYR34表现抗性的品种分别有17份(19.10%)、23份(25.84%)和56份(62.92%);其中对CYR32和CYR33均表现抗性的有3份,占3.37%;对CYR32和CYR34均表现抗性的有13份,占14.61%;对CYR33和CYR34均表现抗性的有16份,占17.98%;仅‘长4640’‘晋麦91号’和‘科农2009’ 3个品种对CYR32、CYR33和CYR34均表现抗性,约占3.37%(图1)。
2.1.2 成株期抗性鉴定
成株期抗性鉴定分别在甘肃清水、四川郫县和湖北荆州进行。条锈菌小种和致病类群包括:CYR32、CYR33、CYR34、Hybrid 46类群、水源11类群和G22类群。
成株期抗性评价结果(表4)显示,在甘肃清水鉴定圃参试品种无免疫材料,表现高抗、中抗、中感和高感的材料分别有14份(15.73%)、21份(23.60%)、36份(40.45%)和14份(15.73%);四川郫县鉴定圃也未发现有免疫材料,高抗、中抗、中感和高感的材料分别有10份(11.23%)、12份(13.48%)、56份(62.92%)和11份(12.4%);在湖北荆州鉴定圃,‘邯农1412’表现免疫,高抗、中抗、中感和高感的材料分别有35份(39.32%)、16份(17.98%)、35份(39.32%)和2份(2.25%)。
‘河农7106’‘捷麦19’‘石农086’‘衡7228’‘邯麦16号’‘石新733’‘长4640’‘临优145’‘晋麦91号’‘长6878’和‘长麦5973’ 11个品种在3个鉴定圃中均表现较好的成株期抗性,其中‘衡7228’ ‘捷麦19’ ‘长4640’ ‘长6878’ 和 ‘长麦5973’5个品种在3地均表现高抗水平。苗期感病而成株期抗病的品种认为其具有成株抗性,苗期和成株期均表现抗病的品种认为其具有全生育期抗性。根据甘肃清水、四川郫县和湖北荆州鉴定圃和温室苗期分小种鉴定结果,‘长4640’和‘晋麦91号’具有全生育期抗性。
2.2 89份小麦品种的抗病基因分子检测
利用与已知抗病基因Yr5、Yr9、Yr10、Yr15、Yr18和Yr26连锁的分子标记,对89份材料进行基因检测。结果表明,在供试品种中,有13个品种(‘河农827’‘衡0628’‘衡136’‘衡4041’‘衡4399’‘衡S29’‘冀麦325’‘冀麦418’‘冀麦42号’‘晋麦63号’‘晋麦85号’‘晋麦91号’‘石麦19号’)与Yr9的阳性对照均扩增出一条1 598 bp的特异性条带,占14.61%(图2)。含有Yr9的13份材料中多个品种已丧失抗性,只有‘晋麦91号’三地均表现抗病,推测‘晋麦91号’除Yr9外还携带有本试验未进行分子标记鉴定的其他抗条锈基因。
89份材料中,‘晋麦96号’和‘太13606’检测到Yr18的连锁标记,检出比例为2.25%;其中‘晋麦96号’在四川郫县和湖北荆州表现中感,在甘肃清水表现中抗;‘太13606’在甘肃清水和四川郫县表现中感而在湖北荆州表现高抗,说明‘太13606’可能還带有其他抗病基因,但抗性也在逐步丧失。此外,89份材料均没有检测到Yr5、Yr10、Yr15和Yr26基因的连锁标记。
2.3 河北、山西不同审定时期品种在不同地点鉴定的抗性表现
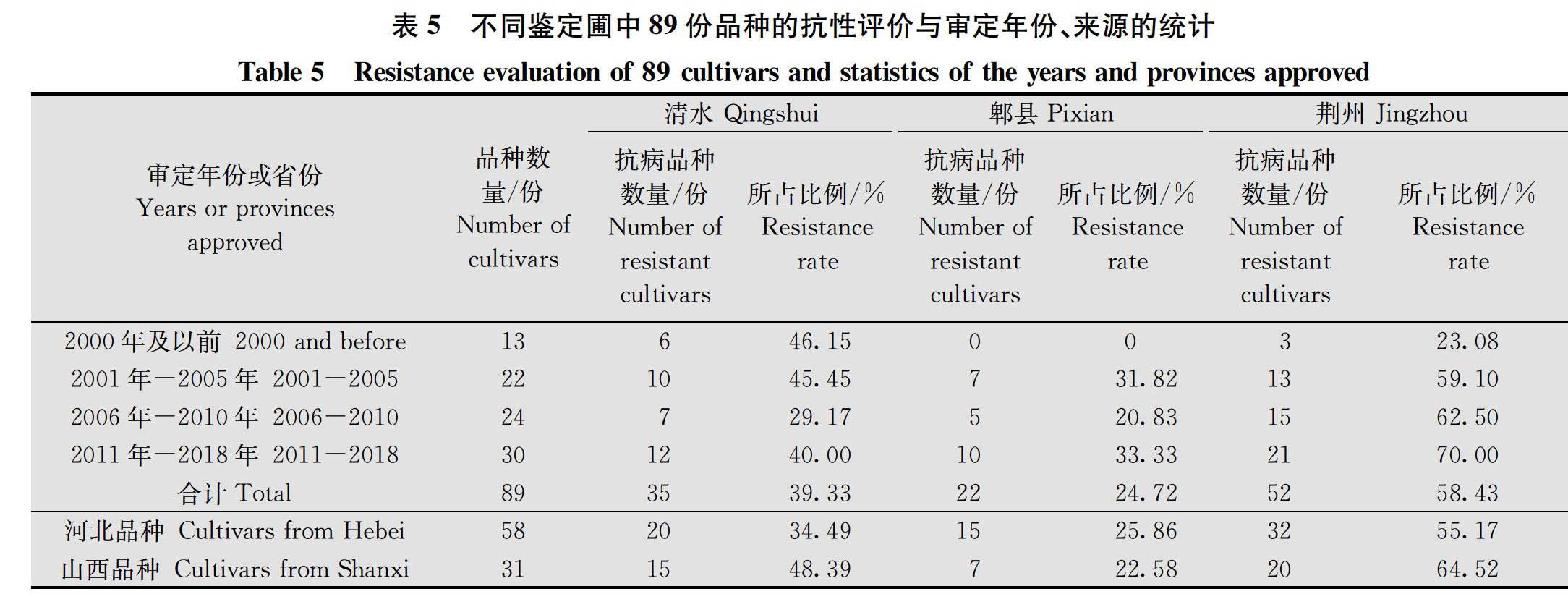
89份品种的审定时期包括1970年至2018年,分析品种的审定时期将其划分为4个时间阶段。2000年及以前审定的品种13个,2001年-2005年审定的品种22个,2006年-2010年审定的品种24个,2011年-2018年审定的品种30个。4个不同审定时期的品种在清水、郫县和荆州的抗性水平统计见表5。表明不同时期审定品种的抗性丧失并没有因育成时间的早晚而表现出抗病品种比例有规律性的增减。
比较河北、山西品种在清水、郫县、荆州的抗性水平发现,河北育成品种与山西品种在郫县鉴定圃中抗病品种的比例相近,分别为25.86%和22.58%。而在清水和荆州鉴定圃,山西育成品种整体抗性表现要明显好于河北品种,48.39%>34.49%,64.52%>55.17%。89份品种在陇南川西北菌源地的甘肃清水、四川郫县和位于鄂西北冬繁区的湖北荆州3个鉴定圃的抗病品种所占比例不同,湖北荆州(58.43%)>甘肃清水(39.33%)>四川郫县(24.72%),这可能与不同地区条锈菌群体毒性结构不同有关(表5)。
3 讨论
我国小麦条锈病流行体系研究表明,来自西北越夏区的夏孢子,经过四川、重庆、陕南、湖北西北部等越冬区域实现初始菌源的哺育繁殖增多,然后向东部传播到达东部流行区对我国冬小麦的主产区造成危害。准确把握种质资源在流行区的抗病性以及明确抗病基因的分布情况,可对条锈病的流行进行有效防御。
河北、山西属于小麦条锈菌的春季流行区,一般在小麦拔节期后发病,而成株期抗性常表现出苗期感病而成株期抗病的特点。因此成株期抗性的利用对于河北、山西麦区条锈病的防控具有重要意义。本研究对89份来自河北、山西的品种在甘肃清水、四川郫县和湖北荆州进行成株期抗性鉴定并进行温室苗期分小种鉴定,结果显示,‘长4640’和‘晋麦91号’具有全生育期抗性,这2个小麦品种对条锈病的抗性遗传尚未见报道,值得进一步分析。
抗病基因分子标记检测是当前基因鉴定的简便、快捷手段,是基因快速检测的常用方法之一。本研究利用与目的基因连锁的分子标记为探针检测供试品种的目的基因。Yr18是具有成株抗性的慢条锈基因,与抗叶锈病基因Lr34、抗秆锈病基因Sr57、抗白粉病基因Pm38、抗黄矮病基因Bdv1和控制叶尖坏死基因Ltn1紧密连锁,因而在小麦育种中应该受到重视[23]。在‘晋麦96号’和‘太13606’中均扩增出与含Yr18阳性对照相同的1条特异性条带,但田间鉴定显示2个品种在四川郫县自然发病条件下均感病,根据成株抗性基因Yr18的抗性特点,推测田间菌源丰富,致使个别品种难以克服多个混合小种。
Yr9源自黑麦1BL/1RS易位系,由于该易位系同时含有抗叶锈、秆锈和白粉病的抗性基因Lr26、Sr31和Pm8,因此在生产上得以广泛应用。周阳等[24]、李峰奇等[25]和尉法刚等[26]曾分别对1980年-2002年黄淮冬麦区育成的89个主栽品种(系)和2003年-2007年黄淮麦区生产上的126份主栽品种和后备品种以及144份黄淮等北方冬麦区品种(系)检测,发现Yr9的分布频率分别为42%、41.3%和23.6%。供试品种‘河农827’‘衡0628’‘衡136’‘衡4041’‘衡4399’‘衡S29’‘冀麦325’‘冀麦418’‘冀麦42号’‘晋麦63号’‘晋麦85号’‘晋麦91号’和‘石麦19号’共13个品种扩增出与含Yr9阳性对照相同的1条特异性条带。此次检测发现Yr9的检出比例较低,主要集中在2008年以后审定的品种中。根据苗期和成株期抗性鉴定结果,以上品种对我国当前流行小种多数表現为感病,在今后小麦育种中应减少Yr9的利用。
89个品种在清水、郫县鉴定圃的鉴定结果显示,有32个品种出现抗病感病的地区差异,推测是由于西部菌源地的四川郫县条锈菌群体毒性结构比甘肃清水复杂,尽管两地有菌源交流,但两地条锈菌群体毒性结构差异仍较大,而位于鄂西北冬繁区的湖北荆州条锈菌群体毒性多样性远低于位于西部菌源地的四川郫县和甘肃清水。这些结果启示我们在抗源筛选及利用中要考虑条锈病流行的区域性特点,有针对性地选育抗病品种。研究还发现,不同审定时期的品种对当前主要流行小种的抗病性丧失并没有因审定时间的早晚而表现出抗病比例有规律性的增减,凸显出基因轮换的重要性。建议通过基因轮换以提高抗源的利用效率。
4 结论
对89份来自河北、山西的育成品种进行苗期和成株期的抗性评价,发现两省小麦品种对越冬菌源基地的条锈菌的抗性水平很低,同时成株抗性基因的利用仍较少,从病原菌大区流行角度来看仍需加强新抗源的利用,尤其是利用与越冬、越夏菌源基地主栽品种不同的抗病基因,以避免病害的流行。在今后育种过程中加强对成株期抗病材料的选择利用,高代品系及育成品种尽可能在不同流行区进行异地鉴定,及时淘汰感病品系。
参考文献
[1] 裴自友, 程天灵, 温辉芹, 等. 山西省小麦生产时空变化分析——2005-2018年[J]. 农业与技术, 2020, 40(5): 1417.
[2] 王亚楠, 冯立辉, 李明远, 等. 河北省小麦产业发展现状及未来展望[J]. 河北农业科学, 2020, 24(2): 14.
[3] CHEN Wanquan, WELLINGS C, CHEN Xianming, et al. Wheat stripe (yellow) rust caused by Puccinia striiformis f. sp. tritici [J]. Molecular Plant Pathology, 2014, 15(5): 433446.
[4] WELLINGS C R. Global status of stripe rust: a review of historical and current threats [J]. Euphytica, 2011, 179(1): 129141.
[5] LINE R F. Stripe rust of wheat and barley in North America: a retrospective historical review [J]. Annual Review of Phytopathology, 2002, 40: 75118.
[6] 吴立人, 牛永春. 我国小麦条锈病持续控制的策略[J]. 中国农业科学, 2000, 33(5): 4654.
[7] LI Jianbo, DUNDAS I, DONG Chongmei, et al. Identification and characterization of a new stripe rust resistance gene Yr83 on rye chromosome 6R in wheat [J]. Theoretical and Applied Genetics, 2020, 133: 10951107.
[8] LINE R F, CHEN Xianming. Successes in breeding for and managing durable resistance to wheat rusts [J]. Plant Disease, 1995, 79(12): 12541255.
[9] 万安民, 袁文焕. 1991-1996年我国小麦条锈菌生理专化研究[J]. 植物病理学报, 1999, 29(1): 35.
[10]HAN D J, WANG Q L, CHEN X M, et al. Emerging Yr26-virulent races of Puccinia striiformis f. tritici are threatening wheat production in the Sichuan basin, China [J]. Plant Disease, 2015, 99(6): 754760.
[11]刘博, 刘太国, 章振羽, 等. 中国小麦条锈菌条中34号的发现及其致病特性[J]. 植物病理学报, 2017, 47(5): 681687.
[12]曾庆东, 沈川, 袁凤平, 等. 小麦抗条锈病已知基因对中国当前流行小种的有效性分析[J]. 植物病理学报, 2015, 45(6): 8392.
[13]WELLINGS C R. Puccinia striiformis in Australia: A review of the incursion, evolution, and adaptation of stripe rust in the period 19792006 [J]. Australian Journal of Agricultural Research, 2007, 58(6): 567575.
[14]ZHANG Gensheng, ZHAO Yuanyuan, KANG Zhensheng, et al. First report of a Puccinia striiformis f. sp. tritici race virulent to wheat stripe rust resistance gene Yr5 in China [J]. Plant Disease, 2020, 104(1): 284.
[15]李振岐, 曾士迈. 中国小麦锈病[M]. 北京: 中国农业出版社, 2002: 302.
[16]HILLAMBROZ K L, BROWNGUEDIRA G L, FELLERS J P. Modified rapid DNA extraction protocol for high throughput microsatellite analysis in wheat [J]. Cropence, 2002, 42(6): 20882091.
[17]MARCHAL C, ZHANG Jianping, PENG Zhang, et al. BED-domain containing immune receptors confer diverse resistance spectra to yellow rust [J]. Nature Plants, 2018, 4(9): 662668.
[18]LIU Cheng, YANG Zujun, LI Guangrong, et al. Isolation of a new repetitive DNA sequence from Secale africanum enables targeting of Secale chromatin in wheat background [J]. Euphytica, 2007, 159: 249258.
[19]邵映田, 牛永春, 朱立煌, 等. 小麥抗条锈病基因Yr10的AFLP标记[J]. 科学通报, 2001, 46(8): 669672.
[20]KLYMIUK V, YANIV E, HUANG Lin, et al. Cloning of the wheat Yr15 resistance gene sheds light on the plant tandem kinase-pseudokinase family [J/OL]. Nature Communications, 2018, 9(1): 3735. DOI: 10.1038/s41467-018-06138-9.
[21]LAGUDAH E S, MCFADDEN H, SINGH R P, et al. Molecular genetic characterization of the Lr34/Yr18 slow rusting resistance gene region in wheat [J]. Theoretical Applied Genetics, 2006, 114(1): 2130.
[22]WANG Chunmei, ZHANG Yiping, HAN Dejun, et al. SSR and STS markers for wheat stripe rust resistance gene Yr26 [J]. Euphytica, 2008, 159(3): 359366.
[23]LILLEMO M, ASALF B, SINGH R P, et al. The adult plant rust resistance loci Lr34/Yr18 and Lr46/Yr29 are important determinants of partial resistance to powdery mildew in bread wheat line Saar [J]. Theoretical Applied Genetics, 2008, 116(8): 11551166.
[24]周阳, 何中虎, 张改生, 等. 1BL/1RS易位系在我国小麦育种中的应用[J]. 作物学报, 2004, 30(6): 531535.
[25]李峰奇, 韩德俊, 魏国荣, 等. 黄淮麦区126个小麦品种(系)抗条锈病基因的分子检测[J]. 中国农业科学, 2008, 41(10): 30603069.
[26]尉法刚, 王光浩, 王长有, 等. 400份小麦品种(系)条锈病成株期抗性鉴定与评价[J]. 植物遗传资源学报, 2020, 21(4): 846854.
(责任编辑:杨明丽)

