Ni3S2-多孔镍@泡沫镍电极制备及其赝电容性能
赵少飞,刘 鹏,李婉萍,曾小红,余 林*,曾华强,2*
(1. 广东工业大学轻工化工学院,广州 510006; 2. 纳米生物实验室,新加坡 138669)
在各种储能装置中,超级电容器由于循环性能优异和功率密度高而受到广泛关注[1]. 根据储能机理不同,超级电容器可分为电化学双电层电容和赝电容[2],其中赝电容超级电容器通过电极表面活性材料发生快速可逆的氧化还原反应,相较于电化学双电层电容,表现出更优的比电容性能[3],因此活性材料成为影响赝电容性能的关键因素. 诸如过渡金属氧化物/氢氧化物/硫化物[4-6]、导电高分子材料[7]等得到广泛研究. 由于S比O具有更低的电负性,过渡金属的硫化物(如NiSx[8-9]、CoSx[10-11]、NiCo2S4[12]等)相比其氧化物具有更高的导电性[13],过渡金属硫化物成为电极材料研究的热点. 其中,Ni3S2因其理论比电容高、倍率性能好、成本较低等优势受到格外关注[14].
传统的电极制备过程需要使用粘结剂,由此带来一系列缺陷,如电极整体质量增大,活性材料电阻升高,比电容降低等,在集流体上原位制备活性材料有望解决上述问题. 泡沫镍(Ni Foam,NF)是一种常用的集流体材料,其孔隙率高达90%[2],有利于电解质离子的传输和活性材料的负载. 目前,研究者主要采用溶剂热法、电沉积法将硫化镍材料原位制备在泡沫镍上,如KRISHNAMOORTHY等[15]以泡沫镍为镍源、硫脲为硫源,采用一步水热法在泡沫镍集流体上制备了网状Ni3S2材料,在5 mA/cm2电流密度下比电容达到1 293 F/g;CHEN等[16]利用二甲基咪唑为导向剂,首先在泡沫镍上采用湿化学法合成了α-Ni(OH)2纳米片,然后采用溶剂热法将α-Ni(OH)2硫化为Ni3S2. 该Ni3S2纳米片在2 A/g电流密度下的比电容高达2 885 F/g,且在50 A/g大电流密度下,循环20 000次后,比电容仍能达到1 000 F/g. 本课题组[17]采用一步电沉积法在泡沫镍上制备了3D 结构Ni3S2材料,在1 A/g电流密度下比电容高达2 850 F/g;将电流密度提高至10 A/g,比电容仍能达到1 972 F/g.
为进一步提高电沉积法制备Ni3S2材料的比电容性能,本文在前期研究基础上[17],对泡沫镍集流体进行改性,预先利用氢气鼓泡法在泡沫镍表面沉积一层多孔镍,然后利用电沉积法在其表面原位制备Ni3S2材料. 电化学测试结果表明,改性后材料的赝电容性能得到有效提升.
1 实验部分
1.1 试剂与仪器
主要试剂和材料:六水合氯化镍(NiCl2·6H2O,分析纯,阿拉丁试剂有限公司)、氯化铵(NH4Cl,分析纯,广州化学试剂厂)、硫脲(CH4N2S,分析纯,广州化学试剂厂)、泡沫镍(苏州泰立泡沫金属厂).
主要仪器:X射线衍射仪(XRD,Panalytical Aeris,荷兰帕纳科)、扫描电子显微镜(SEM,Phenom Pro,荷兰飞纳)、拉曼光谱仪(Raman,LabRAM HR Evolution,法国HORIBA),X射线光电子能谱(XPS,Escalab 250Xi,英国Thermo Fisher)、电化学工作站(CHI660E,上海辰华).
1.2 多孔镍的制备
通过氢气鼓泡法在泡沫镍表面制备多孔镍材料. 两片泡沫镍(1 cm×1 cm)分别为阴极和阳极,电解液含0.1 mol/L NiCl和2 mol/L NH4Cl. 在电沉积开始之前,预先将泡沫镍在2 mol/L的稀盐酸中浸泡10 min,然后用乙醇超声10 min,经水洗后,在真空干燥箱中60 ℃下干燥12 h. 电沉积反应在2 A/cm2的电流密度下进行60 s,产物标记为Ni@NF,经多次乙醇洗、水洗,在真空干燥箱中60 ℃下干燥12 h.
1.3 Ni3S2-多孔镍@泡沫镍的制备
在三电极体系中通过简单的电化学沉积法将Ni3S2沉积在多孔镍@泡沫镍表面,每次电沉积反应量取50 mL电解液,其中NiCl2·6H2O和硫脲的浓度分别为0.02和1 mol/L. 采用循环伏安法以10 mV/s的扫速在-1.2~0.2 V的电压范围内扫描10次循环,所得材料记为Ni3S2-Ni@NF. 在电化学沉积后,将所制备材料经过多次水洗,在真空干燥箱中60 ℃下干燥12 h. 使用精确度为0.01 mg的电子天平称量,减去反应前多孔镍@泡沫镍的质量得到电沉积Ni3S2的质量. 10次循环后Ni3S2的沉积质量为0.84 mg. 为对比,采用相同参数将Ni3S2直接电沉积在泡沫镍上,洗涤烘干后备用,产物标记为Ni3S2@NF.
1.4 材料的表征
实验所制备材料的物相结构分别采用X射线衍射仪(辐射源为Cu Kα,扫描范围20°~60°)、扫描电子显微镜、拉曼光谱仪(激光波长532 nm)、X射线光电子能谱(Al Kα,电压和电流分别为15 kV和15 mA)进行表征.
1.5 电化学测试
电化学测试采用传统的三电极体系,分别以铂片为辅助电极,Hg/HgO电极为参比电极,3 mol/L的KOH溶液为电解液,所有测试均在室温下进行. 采用电化学工作站对材料进行循环伏安(CV)、恒电流充放电(GCD)测试. CV测试在不同扫描速率下的扫描电压范围为0.1~0.7 V;GCD测试在不同的电流密度下充放电电压范围为0~0.5 V,并在10 mA/cm2的电流密度下对材料进行循环稳定性测试. 材料的比电容通过GCD放电曲线计算得到:
C=IΔt/(SΔE).
(1)
2 结果与讨论
2.1 形貌和物相分析
图1为Ni@NF和Ni3S2-Ni@NF的SEM图,在泡沫镍表面负载了一层多孔Ni颗粒,粒径在2~5 μm之间(图1A、B). 在较高的电流密度下氢气泡从泡沫镍表面析出,阻碍了金属镍的沉积,因此在泡沫镍表面形成大的孔洞. Ni颗粒之间存在纳米级的裂缝,这是由H2在新沉积的Ni颗粒上析出造成的. 在沉积Ni3S2之后,Ni颗粒表面变得粗糙,均匀负载了直径200~400 nm的Ni3S2颗粒(图1D). 由图1E~F可知,Ni3S2的沉积并未改变Ni@NF的结构. 将Ni3S2沉积到多孔镍表面,进一步提高其与电解液的接触面积,有利于电子和电解液离子的传输.
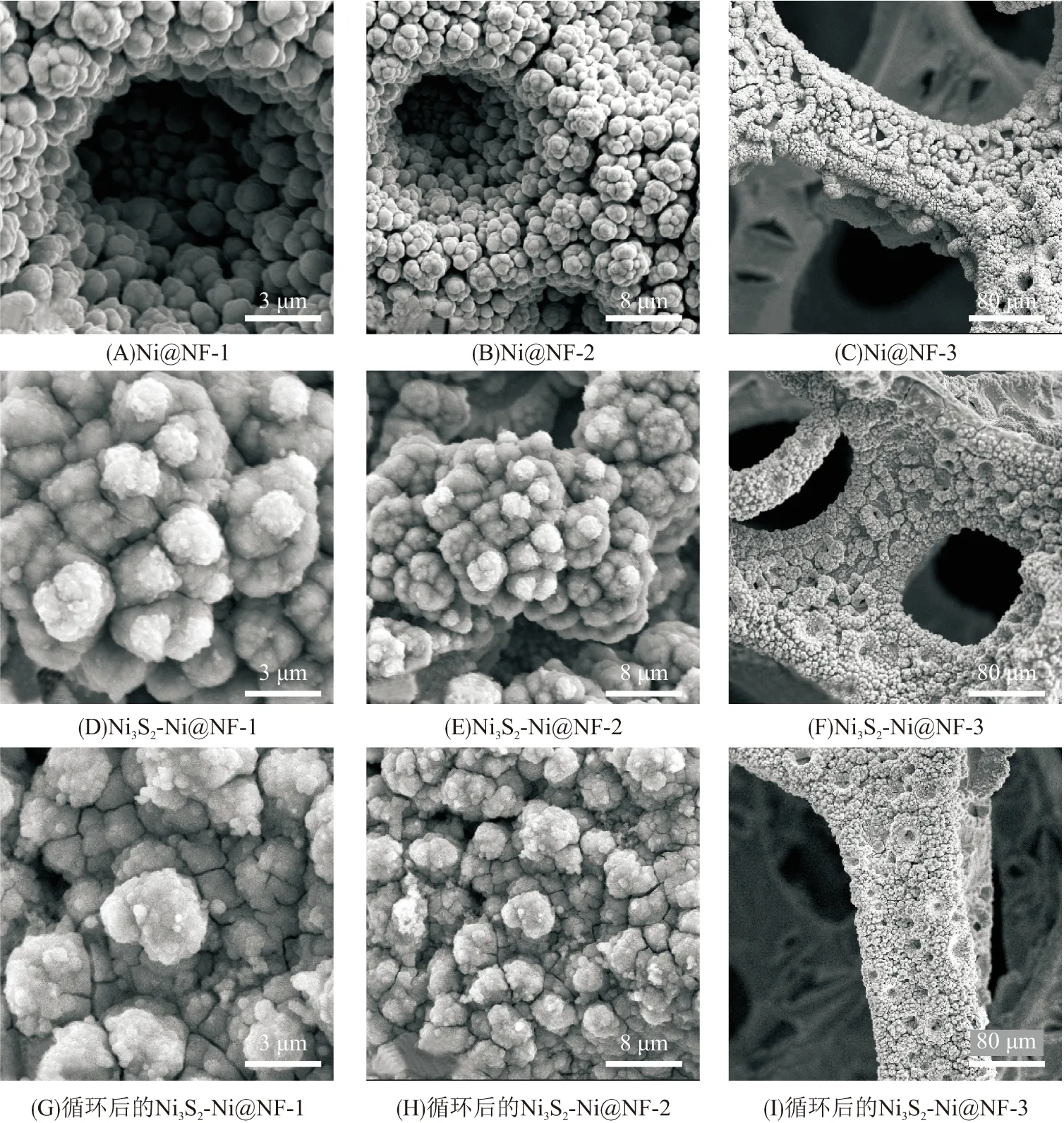
图1 不同材料的SEM图
图2A为不同材料的XRD图谱,在2θ=44.4°和51.7°处出现的衍射峰分别对应于金属Ni(JCPDS No. 0490850)的(111)和(200)晶面. Ni3S2-Ni@NF与Ni3S2@NF材料中Ni3S2的衍射峰不明显,这与其较少的负载量[17]和较低的峰强度有关[6]. 为进一步验证制备材料的结构,对Ni3S2-Ni@NF材料进行了拉曼光谱测试(图2B). 图中存在6个明显的拉曼位移,其中184(A1)、198(E)、219(E)、300(E)、319(A1)和348 cm-1(E)分别对应Ni3S2的2个A1和4个E振动模型[18]. Ni3S2-Ni@NF与Ni3S2@NF材料的拉曼位移基本相同,证明成功制备了Ni3S2.
为进一步表征材料的构成,对Ni3S2-Ni@NF材料进行XPS测试(图2A~B). 图2A为Ni 2p的高分辨图谱,在结合能为855.7、873.4 eV处的峰分别对应于Ni 2p3/2和Ni 2p1/2,同时伴随着2个卫星峰(861.6和879.7 eV). 图2B为S 2p的高分辨图谱,在162.1和163.5 eV处的峰分别对应于S 2p3/2和S 2p1/2,在168.2 eV处的峰表明材料表面的S元素具有高的氧化价态[17]. 通过XPS测试进一步表明在Ni@NF上成功沉积了Ni3S2.
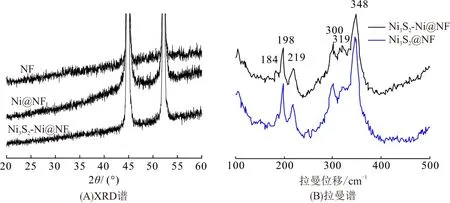
图2 不同材料的XPS谱
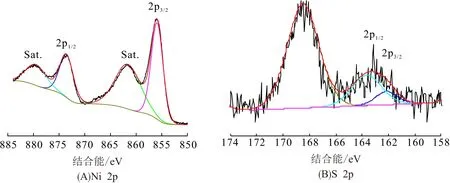
图3 Ni3S2-Ni@NF的XPS谱
2.2 电化学性能分析
采用循环伏安法和恒流充放电法对比研究Ni@NF和Ni3S2-Ni@NF材料的电化学性能. 图4为不同材料在5 mV/s扫速下的CV曲线,所有样品均出现了明显的氧化还原峰,具有赝电容特性.
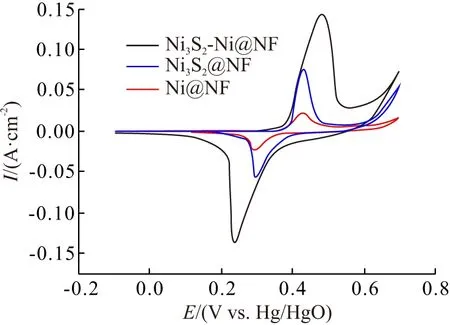
图4 不同材料在5 mV/s扫速下的CV曲线
Ni@NF也出现弱的氧化还原峰,这是由于Ni@NF在碱性溶液中发生腐蚀,从而原位产生Ni(OH)2[2,19]. Ni@NF表面发生的氧化还原反应为
Ni(OH)2+OH-↔NiOOH+H2O+e-;
(2)
Ni3S2-Ni@NF中Ni3S2发生的氧化还原反应[15]为
Ni3S2+3OH-↔Ni3S2(OH)3+3e-.
(3)
从图4还可以看出,Ni3S2-Ni@NF材料的CV曲线所围面积远大于Ni3S2@NF和Ni@NF的面积,表明其比电容更高.
图5A为Ni3S2-Ni@NF在不同扫速下的CV曲线,随着扫速从5 mV/s增大至40 mV/s,CV曲线未发生明显变化,这与其优异的导电性有关,表现出快速的充放电响应. 另外,可以看出,随着扫速的增大,阳极峰和阴极峰的电位分别向高和低电位方向移动,通过计算峰电位与扫速的关系(图5B),可知氧化峰和还原峰电流与扫速的平方根呈现线性关系,说明该材料的氧化还原反应主要受扩散控制[20].
为进一步测试Ni3S2-Ni@NF的比电容性能,对其进行了恒电流充放电测试(图6A),各曲线均出现明显的放电平台,证明其为赝电容超级电容器. 根据式(1)计算得到各材料的比电容(图6B). Ni3S2-Ni@NF的比电容远远高于Ni@NF和Ni3S2@NF,在2、5、8、10、20 mA/cm2的电流密度下,比电容分别为4.56、4.32、4.22、4.29、4.06 F/cm2; 在20 mA/cm2的电流密度下,比电容保持率高达89%.
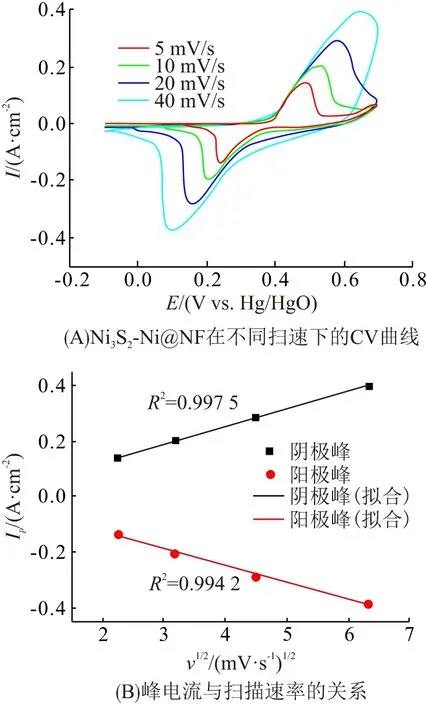
图5 Ni3S2-Ni@NF在不同扫速下的CV曲线及峰电流与扫速的关系
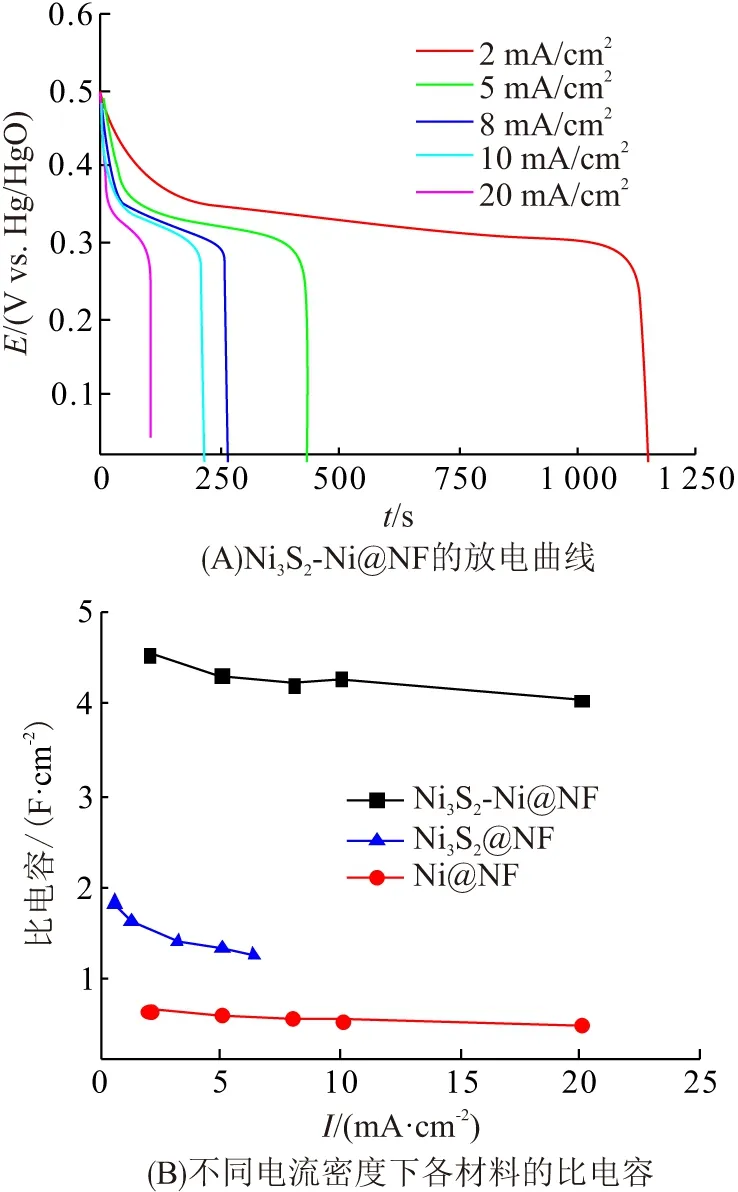
图6 Ni3S2-Ni@NF在不同电流密度下的放电曲线及比电容
电极材料的循环性能是材料电化学性能的重要指标. Ni3S2-Ni@NF材料在前400次循环中,比电容从3.55 F/cm2持续下降至2.27 F/cm2. 然而,在后续的600次循环中,比电容逐渐升高,在1 000次循环结束后,比电容达到2.59 F/cm2,比电容保持率约73%,比Ni3S2@NF(42%)和Ni@NF(51%)的比电容高. Ni3S2-Ni@NF比电容的先降后升归因于预先沉积的多孔Ni[2]. 分析循环后Ni3S2-Ni@NF的SEM图(图1G~I)可知,与循环前的材料对比,多孔镍表面负载的活性材料颗粒增大且相对稀疏,多孔镍基底出现明显的裂缝. 因此,在充放电循环初期,活性材料由于电解质离子的嵌入和脱出,不稳定部分的结构发生一定程度的坍塌,比电容下降,然而,多孔镍在循环过程中,由于碱性电解液的作用,根据反应方程式(2),不断形成Ni(OH)2,且新形成的Ni(OH)2在充放电循环中不断溶解和循环重新沉积,与Ni3S2形成共沉积产物,提高了活性材料的质量,从而提升了电极材料的比电容性能.
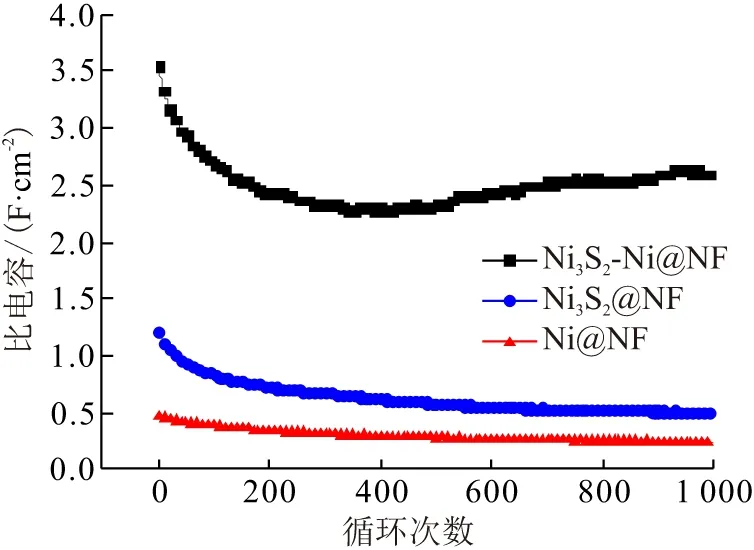
图7 不同材料的循环曲线
3 结论
采用氢气鼓泡法预先处理泡沫镍集流体,在其表面电沉积多孔镍,然后电沉积Ni3S2,原位制备了Ni3S2-Ni@NF电极. 结果表明:相对于在泡沫镍上直接Ni3S2沉积,Ni3S2-Ni@NF电极具有更高的比电容(在2 mA/cm2的电流密度下,比电容达到4.56 F/cm2),且循环性能和倍率性能均得到提升. 这是由于多孔镍的沉积有效增大了集流体的比表面积,有利于电解质离子和电子的传输,增大了活性材料的接触面积;且在充放电循环过程中,多孔镍可与Ni3S2材料产生协同作用,提高了电极的循环性能.

