重组鸭瘟病毒载体中筛选高效表达鸭坦布苏病毒E蛋白启动子
陈柳,倪征,余斌,华炯钢,叶伟成,云涛,刘可姝,朱寅初,张存
重组鸭瘟病毒载体中筛选高效表达鸭坦布苏病毒E蛋白启动子
陈柳,倪征,余斌,华炯钢,叶伟成,云涛,刘可姝,朱寅初,张存
(浙江省农业科学院畜牧兽医研究所,杭州 310021)
鸭瘟和鸭坦布苏病毒是鸭的两种重要传染病,鸭瘟属于疱疹病毒科,具有开发成病毒载体的优势。为了优化鸭坦布苏病毒E基因在重组鸭瘟病毒载体中的表达,之前探讨了不同形式鸭坦布苏病毒E蛋白在重组鸭瘟病毒载体中的表达,发现以鸭为宿主进行密码子优化的E基因C端截短形式(E451-dk,简称为Es)表达量最高。【】探讨不同启动子对Es 在重组鸭瘟病毒载体中表达的影响,为鸭瘟病毒—坦布苏病毒二联苗的研制奠定基础。将pCAG、 pSV40、pRSV、p1.8k(MDV)和pgB(MDV)启动子通过常规基因克隆的方法替换转移载体pEP-BGH-Es中的pCMV启动子,构建不同启动子调控Es表达的重组表达框pro-Es-BGH-pA。在鸭瘟病毒(DEV)疫苗株细菌人工染色体克隆pDEV-EF1的基础上,将5个重组表达框分别通过“Red E/T两步重组”克隆至pDEV-EF1突变体的US7和US8基因之间,构建了携带不同启动子调控的Es突变体克隆pDEV-pro-Es。用磷酸钙法转染鸡胚成纤维细胞(CEFs)拯救获得相应重组病毒rDEV-pro-Es,并对重组病毒感染细胞蚀斑大小和Es蛋白表达情况进行测定。将重组突变体克隆转染细胞拯救获得了5株重组病毒rDEV-pro-Es。Western blotting分析表明外源蛋白Es在 pRSV调控下表达量最高,其表达量较rDEV-Es提高了169.12%。完成了Es在重组鸭瘟病毒载体中高效表达启动子的筛选,获得了一种调控Es高效表达的启动子pRSV。同时也获得了一株高效表达鸭坦布苏病毒外源基因Es的重组鸭瘟病毒rDEV-pRSV-Es。
鸭瘟病毒;鸭坦布苏病毒;E蛋白;细菌人工染色体;病毒载体;启动子
0 引言
【研究意义】自从2010年发生以来,鸭坦布苏病毒(DTMUV)给我国养鸭业带来了巨大的经济损失。因为其黄病毒属性,鸭坦布苏病毒及其他的水禽TMUV可能纳入公共健康关注。因此,关于DTMUV疫苗的研制是非常迫切的。目前,已有商品化的DTMUV灭活疫苗(HB株)和减毒疫苗(WF100株)。这些疫苗各有优缺点,灭活苗安全性高、但价格高,而减毒疫苗存在一定安全隐患。鸭瘟是鸭、鹅和其他雁形目禽类的一种急性、热性、败血性传染病。该病流行广泛,传播迅速,发病率和死亡率都高,曾给禽类养殖业带来了巨大的经济损失。鸭瘟的防控目前主要靠传统鸭瘟鸡胚化弱毒活疫苗,在水禽生产上广泛应用,具有免疫效果好、安全性高的特点,还能突破母源抗体的干扰。但不能区分免疫鸭和自然感染鸭,影响该病的免疫检测及监控。这也是疫苗研究工作者急需解决的问题。分子生物学技术的发展,疫苗的研究出现了根本性的变化,目前研发的新型的疫苗主要有基因疫苗、亚单位疫苗、合成肽疫苗和载体疫苗等。重组载体疫苗除具有弱毒疫苗的优点外,还具有遗传标记易区别于野毒、容易研发新型多联多价疫苗的特点,深受研究者的青睐,成为新型兽用疫苗研究的热点。【前人研究进展】目前,痘病毒、腺病毒、疱疹病毒、慢病毒、腺联相关病毒已被广泛用于疫苗载体的研发[1-11]。鸭瘟病毒(DEV)除了具有疱疹病毒特性之外,商品化的DEV弱化疫苗株已被广泛用于DEV的防控。因此,DEV是极佳的用于研发水禽疫苗的病毒载体候选者。迄今为止,研究者已尝试以DEV为载体,分别将传染性法氏囊病病毒、鸭病毒性肝炎病毒I型和III型、新城疫病毒、H5N1亚型禽流感病毒(AIV)、H5N6亚型AIV、H5N8亚型AIV、H9N2亚型AIV、DTMUV、鹅细小病毒、鹅H5亚型禽流感病毒的抗原基因插入至DEV基因组中,用于研发相关的二联疫苗[12-26]。CHEN等分别将前缀信号肽tPAS的DTMUV截短形式的E蛋白(TE)、和与prM串联表达的E截短体(prM/TE)插入到DEV疫苗株基因组的US7/US8间,获得了两株重组鸭瘟病毒,该病毒感染鸡胚成纤维细胞能表达外源蛋白,并能诱导鸭体产生E蛋白抗体,经过两次免疫,rDEV-PrM/TE能完全保护鸭免受DTMUV的攻击,而rDEV-TE只能保护部分鸭子遭受DTMUV攻毒。该研究显示,tTPA信号肽的加入增加了E蛋白的表达量及分泌型蛋白的产生[24]。ZOU等以DEV作为载体表达DTMUV全长E基因也取得了成功。重组病毒C-KCE-E能保护鸭免于DEV强毒攻击,且能产生DTMUV E蛋白中和性抗体[25]。之后,ZOU等又同时将H5N1亚型禽流感病毒 HA和DTMUV prM-E克隆至DEV疫苗株基因组,获得了重组病毒C-KCE-HA/ PrM-E,该病毒能诱导部分鸭产生针对H5N1亚型AIV和DTMUV的中和性抗体,但同时也能诱导机体产生体液免疫,接种重组病毒能保护鸭免于DEV、H5N1亚型AIV和DTMUV强毒的攻击[15]。虽然这些研究取得了不错的成绩,但没有系统性地研究影响外源E基因在重组DEV载体中的因素,前期我们摸索了DTMUV的抗原形式(包括前缀信号肽的E基因、去除跨膜区的截短的E基因),并对外源抗原密码子进行优化,选中了一种较为优化的抗原形式E451-dk (简称为Es)。【本研究切入点】虽然课题组已针对DTMUV E蛋白进行了多方面的优化研究,但对于调控蛋白表达的关键因素——启动子这部分工作还没有开展。外源基因序列及调控表达的启动子等对于调控外源基因的表达至关重要。LI等以马立克氏病毒MDV作为活病毒载体表达了传染性法氏囊病病毒IBDV的VP2蛋白,发现在Pec启动子调控下的VP2表达量较pCMV调控下的高,且rDEV-Pec-VP2产生的免疫保护能力较rDEV-CMV-VP2更好,说明重组MDV疫苗对IBDV的保护效率与该病毒外源蛋白VP2的表达水平密切相关[27]。【拟解决的关键问题】为了控制和预防鸭坦布苏病毒感染,本研究拟在前期工作的基础上,通过更换调控外源E451-dk(简称为Es)蛋白表达的启动子,从而筛选出一株以鸭瘟病毒疫苗株作为载体Es基因更高效表达的重组鸭瘟病毒,期望获得一株可以诱导鸭产生DEV和DTMUV两种病毒中和抗体和对病毒产生免疫保护作用的重组鸭瘟病毒,为研究鸭瘟病毒和鸭坦布苏病毒二联活疫苗奠定基础。
1 材料与方法
试验于2016年6月至2017年10月在浙江省农业科学院畜牧兽医研究所完成。
1.1 菌株、质粒和病毒
pCDNA3.1+、pCAGGS-NLS-Cre质粒由浙江省农业科学院畜牧兽医研究所保存;pBS448 RSV-gfp-Cre质粒购自Addgene公司;pDEV-EF1/GS1783菌株(为携带有鸭瘟病毒疫苗株感染性BAC克隆的菌株)和对应的rDEV-EF1病毒株由浙江省农业科学院畜牧兽医研究所禽病组研究室构建并保存[28-29];携带以鸭为宿主进行密码子优化的DTMUV E451基因(简称为Es)的重组质粒pEP-BGH-E451-dk(即pEP-BGH-Es)和重组鸭瘟病毒rDEV-Es(即rDEV-pCMV-Es)由浙江省农业科学院畜牧兽医研究所禽病组研究室构建并保存[30]。MDV RISPEN疫苗株购自乾元浩生物股份有限公司。
1.2 主要试剂
KOD酶购自东洋纺(上海)生物科技有限公司;限制性内切酶、凝胶纯化试剂盒、快速连接试剂盒、Western BLoT Chemiluminescence HRP Substrate化学发光底物购自于宝生物工程(大连)有限公司;质粒提取试剂盒为Omega公司产品;Trans-T1化学感受态细胞、蛋白分子量Marker(EasySee Western Marker)购自于北京全式金生物技术有限公司;胎牛血清为Gibco BRL公司产品;磷酸钙转染试剂盒为Promega公司产品;DMEM高糖培养基购自于上海吉诺生物医药有限公司;酶标二抗(HRP标记的山羊抗小鼠IgG、HRP标记的山羊抗兔IgG)购于Santa Cruz公司;GFP单抗购于碧云天生物技术公司。蛋白浓缩超滤管(30k)购于millipore公司;小鼠抗鸡beta-actin单克隆抗体购自Sigma。
1.3 细胞
取9—11日龄SPF鸡胚采用胰蛋白酶消化法[31]制备鸡胚成纤维细胞(CEFs)。SPF鸡胚由浙江省农业科学院良种家禽孵化基地提供。
1.4 TUMV E蛋白DIII结构域多克隆抗体的制备
TUMV E蛋白DⅢ结构域抗原由本课题组制备[32],按常规方法免疫兔制备兔抗DIII多克隆抗体,以纯化的DIII蛋白作为抗原包被酶标板,采用间接ELISA方法测定抗体效价。DEV UL44多克隆抗体制备方法同上,采用原核表达法制备抗原,所用引物为Dev UL44(BamHI+)和Dev UL44 (XhoI-)引物对(表1)。纯化抗原免疫小鼠制备鼠抗UL44多克隆抗体,采用间接ELISA方法测定抗体效价。
1.5 引物设计及合成
本文所用引物见表1:pCAG(MluI+)/ PCAG (NheI-)引物对用于以pCAGGS-NLS-Cre为模板扩增pCAG基因;pRSV(BglII+)/pRSV(NheI-)用于以pBS448 RSV-gfp-Cre质粒为模板扩增pRSV基因;pSV40(MluI+)/pSV40((NheI-)用于以pCDNA3.1+为模板扩增pSV40基因;F(MDV p1.8k BglII+)/R(MDV p1.8k NheI-)用于以MDV RISPEN病毒DNA为模板扩增MDV 1.8k基因启动子(p1.8k);F(MDV gB BglII+)/ R(MDV gB NheI-)用于以MDV RISPEN病毒DNA为模板扩增MDV gB启动子(pgB)。pDEV vac-in-s和pDEV vac-in-as用于分别将表达框pCAG- Es-BGH-pA、pRSV-Es-BGH-pA和pSV40-Es-BGH-pA插入到DEV基因组的US7和US8基因之间;pDEV vac-in-s(p1.8k,pgB)和pDEV vac-in-as用于分别将表达框p1.8k(MDV)-Es-BGH-pA、pgB(MDV)-Es-BGH- pA插入到DEV基因组的US7和US8基因之间。下划线部分与pEP-pro-Es上序列同源,可以从pEP-pro-Es扩增出含有外源基因表达框及Kan筛选基因的片段,加粗序列分别与位于DEV US7和US8基因间插入位点上、下游序列同源,用于引入同源重组臂。DEV-tk-F/DEV-tk-R和JD-F/JD-R为鉴定引物对,前者用于扩增DEV基因、后者用于验证外源基因是否正确插入到BAC基因组中。
1.6 pEP-pro-Es质粒的构建
采用表1引物进行PCR扩增获得的pCAG、pSV40、pRSV、pgB(MDV)和p1.8k(MDV)基因,在5′和3′端分别引入了酶切位点,将片段用对应的酶进行双酶切之后插入到pEP-BGH-Es相应的酶切位点中,从而分别用pCAG、pSV40、pRSV、pgB(MDV)和p1.8k(MDV)替换pEP-BGH-Es上的pCMV启动子,构建不同启动子调控Es基因的质粒。通过PCR和酶切鉴定筛选获得阳性克隆,送上海博尚生物公司测序,获得阳性克隆分别命名为pEP-pCAG-Es、pEP-pSV40-Es、pEP-pRSV-Es、pEP-pgB(MDV)-Es和pEP-p1.8k(MDV)- Es(总称为pEP-pro-Es)。

表1 本文所用引物
加粗序列分别与位于DEV US7和US8基因间插入位点上、下游序列同源,用于引入同源重组臂;下划线部分与pEP-pro-Es上序列同源;斜体部分为引入酶切位点
The bold sequences are homologous to the sequences located at the intergene insertion sites of DEV US7 and US8, which introduces homologous recominant arms; the underlined sequences are homologous to the sequence on pEP-pro-Es;and the restriction enzyme recognition sequences are italicized
1.7 重组鸭瘟病毒突变体BAC克隆的构建
各重组鸭瘟突变体BAC克隆通过“Red E/T两步重组”[33-34]获得。以pEP-pro-E451-dk质粒为模板,用引物对pDEV vac-in-s/pDEV vac-in-as或pDEV vac-in-s(p1.8k,pgB)/pDEV vac-in-as (序列见表1)扩增长度为3 191—4 493 bp不等的PCR片段,将PCR片段电转化至pDEV-EF1/GS1783感受态细胞,PCR片段通过自身序列上的DEV基因组同源臂将pro-Es-BGH-pA表达框和筛选基因卡那霉素(Kan)插入到pDEV-EF1。获得的重组BAC克隆用I酶切鉴定,筛选到含Kan标记的重组BAC克隆中间体pDEV-pro-kan.Es。之后通过pEP-BGH-Es质粒载体上自身携带的同源序列将Kan基因去除,获得只含有pro-Es-BGH-pA表达框的重组子。抽提重组子BAC DNA,通过I酶切,筛选出正确克隆(pDEV-pro- Es)。最后采用鉴定引物对DEV-tk-F/DEV-tk-R和JD-F /JD-R(序列见表1)进行PCR扩增,将扩出片段送出测序。
1.8 重组病毒的拯救
采用碱裂解法抽提各个pDEV-pro-Es,依照磷酸钙转染试剂盒操作说明转染CEFs,置于37℃ 5% CO2培养箱中培养,待出现70%—80%荧光斑之后收集细胞及上清,即为拯救的病毒液,分别命名为rDEV-pCAG-Es、rDEV-pSV40-Es、rDEV-pRSV-Es、rDEV-pgB(MDV)-Es、rDEV-p1.8k(MDV)-Es(总称为rDEV-pro-Es)。
1.9 重组病毒蚀斑大小的测定
将rDEV-pCAG-Es、rDEV-pSV40-Es、rDEV-pRSV- Es、rDEV-pgB(MDV)-Es、rDEV-p1.8k(MDV)-Es、rDEV-Es及rDEV-EF1病毒液稀释接种于单层CEFs上,90 min后用PBS(pH7.2)洗涤一次,铺上1.5%的甲基纤维素,置于细胞培养箱培养48 h,在荧光显微镜下将每种病毒荧光蚀斑各拍100张,用Image J软件测量病毒的蚀斑面积,并计算出平均值,以rDEV-EF1病毒株蚀斑面积为参考,将其面积设定为100%,以之为标准将其他株病毒蚀斑面积换算成百分比。用SPSS11.5软件对这些数据进行统计学分析。
1.10 TUMV E蛋白DIII和DEV UL44多克隆抗体效价测定
经间接ELISA法测得兔抗TUMV E蛋白DIII结构域多克隆抗体效价和小鼠抗DEV UL44多克隆抗体效价皆为1﹕64 000。
1.11 蛋白表达分析
分别接种rDEV-pCAG-Es、rDEV-pSV40-Es、rDEV-pRSV-Es、rDEV-pgB(MDV)-Es、rDEV-p1.8k (MDV)-Es和rDEV-Es及对照毒株rDEV-EF1[2]于CEFs细胞中,培养至细胞出现90%以上荧光,收集细胞培养液上清,同时用PBS(pH7.2)洗涤细胞,收获细胞沉淀。收集的培养液上清采用millipore的蛋白超滤管(30k)进行100倍浓缩,将收集的细胞及上清样品用上样缓冲液处理后,进行SDS-PAGE电泳并转移至硝酸纤维素NC膜上,转膜样品制备3份。取出NC膜,放入含10%脱脂牛奶的封闭液中4 ℃过夜。一份以兔抗TUMV E蛋白DIII结构域多克隆抗体(1﹕500稀释)和鼠源GFP单抗(1﹕1 000稀释)作为一抗,一份以小鼠抗DEV UL44多克隆抗体(1﹕500稀释),另一份以小鼠抗beta-actin单克隆作为一抗(1﹕1 000稀释);二抗对应的采用HRP标记的山羊抗鼠IgG(1﹕5 000稀释)和HRP标记的山羊抗兔(1﹕5 000稀释)于37℃孵育1 h,最后用Western BLoT Chemiluminescence HRP Substrate化学发光底物进行显色,并置于凝胶成像仪进行条带曝光。
2 结果
2.1 重组鸭瘟病毒BAC突变体克隆的鉴定
分别提取各重组鸭瘟病毒BAC突变体克隆及Kan中间体,用I酶切,电泳鉴定(图 1)。结果表明DNA电泳图谱和以GenBank(登录号KF487736.1)收录的鸭瘟病毒参考序列进行预测的基本一致。电泳及测序结果也表明,以DEV-tk-F和DEV-tk-R、JD-F和JD-R引物对扩出的PCR片段(电泳图见图2)与预期一致,说明外源基因已按照预期插入鸭瘟病毒疫苗株基因组中。
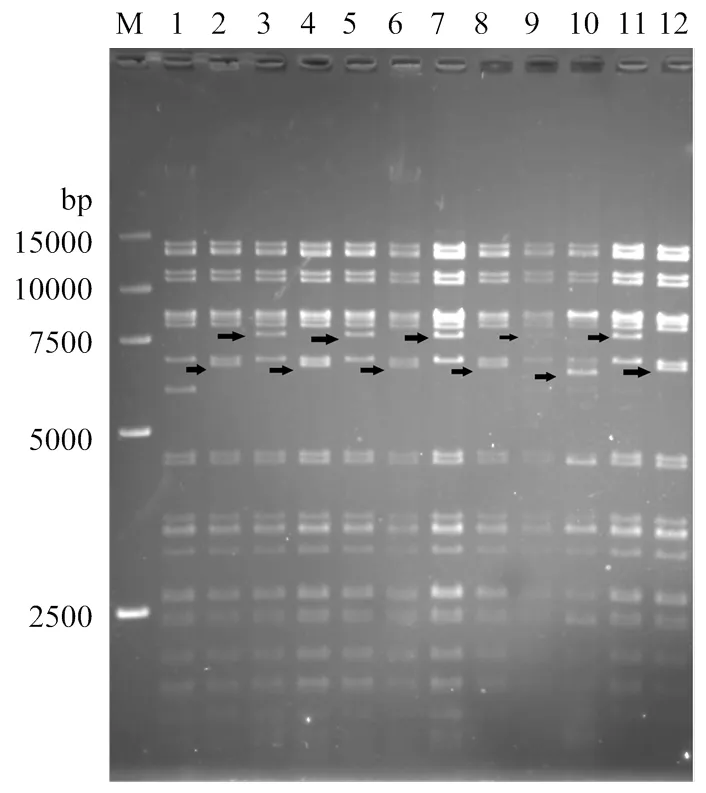
1: pDEV-EF1; 2: pDEV-Es; 3: pDEV-kan. pRSV. Es; 4: pDEV-pRSV. Es; 5: pDEV-kan.pSV40. Es; 6: pDEV-pSV40. Es; 7: pDEV-kan.pCAG. Es; 8: pDEV-pCAG. Es; 9: pDEV-kan.p1.8k(MDV). Es; 10: pDEV-p1.8k (MDV). Es; 11: pDEV-kan.pgB(MDV). Es; 12: pDEV-pgB(MDV). Es
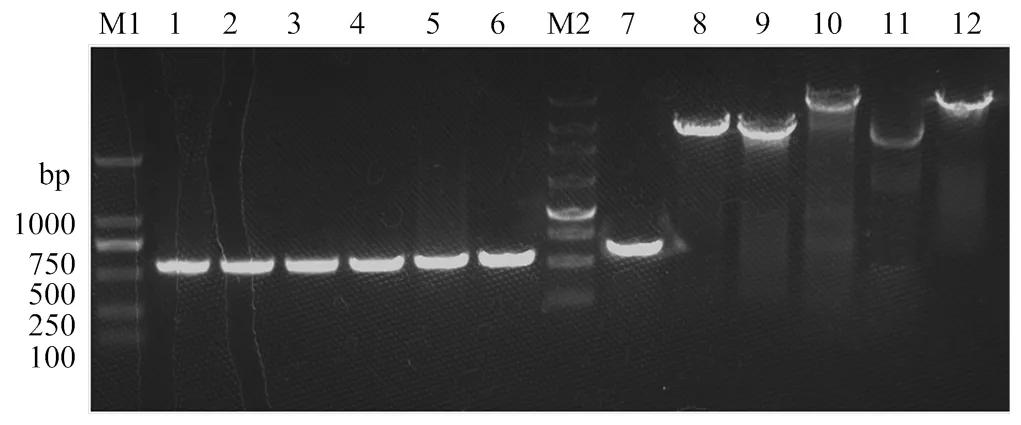
泳道1—6 是以DEV-tk-F和DEV-tk-R引物对扩增片段;7—12 是以JD-F和JD-R引物对扩增片段。M1:DL2000(2000,1000, 750, 500, 250, 100 bp); 1. pDEV-EF1 (553 bp); 2. pDEV-pSV40. Es (553 bp); 3. pDEV- pRSV. Es (553 bp); 4. pDEV-pCAG. Es(553 bp); 5. pDEV-p1.8k (MDV). Es (553 bp); 6. pDEV-pgB(MDV). Es (553 bp); M2: 250 bp marker(4500, 3000, 2250, 1500, 1000, 750, 500, 250 bp); 7. pDEV-EF1(641 bp); 8. pDEV-pSV40. Es(2747 bp); 9. pDEV-pRSV. Es(2745 bp); 10. pDEV- pCAG. Es(3989 bp); 11. pDEV-p1.8k(MDV). Es (2687 bp);12. pDEV-pgB (MDV). Es (3037 bp)
2.2 重组病毒的拯救
转染细胞48 h后于荧光显微镜下观察,发现转染孔内出现荧光蚀斑,继续培养至70%—80%细胞出现荧光蚀斑之后收集细胞和上清,即为拯救重组病毒(图3)。
2.3 病毒蚀斑面积测定
病毒蚀斑面积测定表明,与rDEV-EF1相比,rDEV- Es、rDEV-pCAG-Es、rDEV-pSV40-Es、rDEV-pRSV-Es蚀斑面积分别较rDEV-EF1减少了35.26%、15.61%、10.22%、11.41%,而rDEV-p1.8k(MDV)-Es 和rDEV- pgB(MDV)-Es蚀斑面积分别较rDEV-EF1增加了21%和35.66%(图4)。
图3 拯救重组病毒
图4 各重组病毒在细胞上的蚀斑面积测定和比较
2.4 外源蛋白Es表达分析
将各重组毒株感染CEFs,分别收集细胞和50倍浓缩的细胞培养液上清,将细胞样品进行SDS-PAGE电泳及转膜,做3份重复,分别以兔抗TUMV E蛋白DIII结构域多克隆抗体、小鼠抗GFP单克隆抗体和小鼠抗DEV UL44多克隆抗体、小鼠抗beta-actin单克隆抗体作为一抗,进行Western blotting检测,结果表明以小鼠抗GFP单克隆抗体和小鼠抗DEV UL44多克隆抗体作为一抗检测的膜在进rDEV-Es、rDEV- pRSV-Es、rDEV-pCAG-Es感染的细胞样品在约49—52kD处显出特异性目的蛋白条带(图5-A),在28 kD处显示出内参GFP条带,与预测基本一致,说明蛋白获得了表达。其他参考蛋白beta-actin、UL44皆在相应位置显出了条带。以beta-actin为内参,用Image J软件分析各样品表达条带灰度值比值(Es/beta-actin),结果表明含pCMV、pCAG、pRSV所表达的蛋白强度比值分别是1.367、0.698和3.679,说明pRSV启动子活性最强,rDEV-pRSV- Es感染细胞中Es蛋白表达量较rDEV-Es提高了169.12%(图5-A)。细胞培养上清样品中明显检测到GFP的表达,但未检测到目的蛋白和病毒蛋白UL44(图5-B)。
1: rDEV-Es; 2: rDEV-pSV40-Es; 3: rDEV-pCAG-Es; 4: rDEV-pRSV-Es; 5: rDEV-p1.8(MDV) -Es; 6: rDEV-pgB(MDV)-Es; M: EasySee Western Marker (90, 75, 60,40, 25 kD); 7: rDEV-EF1
3 讨论
感染性细菌染色体克隆(BACs)是疱疹病毒基因组操作的最主要的平台,基于该平台,国内外学者广泛开展了疱疹病毒基因缺失疫苗和重组活载体疫苗的研究,目前马立克氏病毒(MDV)和伪狂犬病毒(PRV)的基因缺失疫苗和重组活载体疫苗已经获得了成功,并广泛用于实际生产中。课题组曾将鸭瘟病毒疫苗株基因组插入到BAC质粒构建了鸭瘟病毒全基因组的感染性克隆,获得了DEV疫苗株的反向遗传系统[24],尝试将以鸡为宿主进行密码子优化的DTMUV E基因插入到DEV的反向遗传系统,但外源基因E的表达水平不高[25]。之后又摸索了E基因的表达形式,包括是否前缀信号肽、是否去掉跨膜区、是否进行基因优化和以哪个宿主密码子为参考进行基因优化效果最佳都进行了摸索,筛选到了一种E蛋白表达量较高的E基因的表达形式(即去掉跨膜区、以鸭为宿主进行密码子优化的E451基因)[30]。
本研究中选用了几种常用的启动子:巨细胞病毒CMV早期启动子(pCMV)、猿猴病毒SV40的早期启动子(pSV40)、Rous肉瘤病毒RSV启动子(pRSV)、复合启动子pCAG、鸡源病毒MDV 1.8k基因(p1.8k(MDV))和gB基因启动子(pgB(MDV)),其中,pCMV和pRSV调控E蛋白表达的效果最佳,究其原因,可能CMV与DEV同属疱疹病毒科;RSV天然宿主为鸡,因此更适合。本研究中几株病毒的蚀斑面积较亲本毒株或多或少都有些波动,说明启动子影响了病毒在细胞间的传播能力,但启动子的替换不影响病毒在细胞上的增殖及在细胞间的传播。
是否外源基因的表达水平与抗体生成水平有关,目前存在着一定的争议。LI等[27]、TSUKAMOTO等[35]的研究表明强启动子更有利于外源基因的表达,且外源基因的表达量与诱导机体产生的抗体水平成正相关性,高水平的抗体更利于机体对强毒株的免疫保护。但也有相反的研究结论,MA等的研究表明外源蛋白表达水平过高,会与母源抗体发生中和,从而使得外源蛋白抗体水平下降,反而导致免疫保护效果不佳[36]。综上,以DEV作为载体表达外源蛋白需要维持外源蛋白表达量到一个度,太低不足以诱导机体产生抗体,太高要么会有毒性要么会和抗体相中和。此外,本研究选用的是去除跨膜区的E基因的截短形式,最新的研究表明截短形式的E蛋白依然能保护青年鸭免受DTMUV强毒的攻击[37]。DEV和DTMUV共同的自然宿主是鸭和鹅,而本试验是在鸡源细胞上开展的,是否在其他宿主细胞或者宿主体内蛋白表达量会有差异,需要进一步研究。至于重组病毒rDEV- pRSV-Es以及其他几株病毒免疫效果如何最终需要通过后续的动物试验进行综合评价。
4 结论
本研究成功筛选获得了一种调控鸭坦布苏病毒Es在重组鸭瘟病毒载体中高效表达的启动子pRSV。同时也获得了一株高效表达鸭坦布苏病毒外源基因Es的重组鸭瘟病毒rDEV-pRSV-Es。该研究为鸭瘟病毒—坦布苏病毒二联苗的研制奠定了基础。
[1] KALODIMOU G, VEIT S, JANY S, KALINKE U, BRODER C C, SUTTER G, VOLZ A. A soluble version of nipah virus glycoprotein G delivered by vaccinia virus MVA activates specific CD8 and CD4 T cells in mice., 2020, 12(1): 26.
[2] BERTRAN K, CRIADO M F, LEE D H, KILLMASTER L, Sà E SILVA M, LUCIO E, WIDENER J, PRITCHARD N, ATKINS E, MEBATSION T, SWAYNE D E. Protection of White Leghorn chickens by recombinant fowlpox vector vaccine with an updated H5 insert against Mexican H5N2 avian influenza viruses., 2020, 38(6):1526-1534.
[3] KIM J W, MORSHED R A, KANE J R, AUFFINGER B, QIAO J, LESNIAK M S. Viral vector production: adenovirus., 2016,1382:115-130.
[4] LAROCCA R A, MENDES E A, ABBINK P, PETERSON R L, MARTINOT A J, IAMPIETRO M J, KANG Z H, AID M, KIRILOVA M, JACOB-DOLAN C, TOSTANOSKI L, BORDUCCHI E N, De La BARRERA R A, BAROUCH D H. Adenovirus vector- based vaccines confer maternal-fetal protection against Zika virus challenge in pregnant IFN-αβR-/- mice., 2019, 26(5): 591-600.
[5] CHANG P, AMEEN F, SEALY J E, SADEYEN J R, BHAT S, LI Y, IQBAL M. Application of HDR-CRISPR/Cas9 and erythrocyte binding for rapid generation of recombinant turkey herpesvirus-vectored avian influenza virus vaccines., 2019, 7(4): E192.
[6] ŚMIETANKA K, TYBOROWSKA J, OLSZEWSKA-TOMCZYK M, DOMAńSKA-BLICHARZ K, MINTA Z, RABALSKI L, CZARNOTA A, KUCHARCZYK K, SZEWCZYK B. A Recombinant turkey herpesvirus expressing F and HN genes of avian avulavirus-1 (AAvV-1) genotype VI confers cross-protection against challenge with virulent AAvV-1 genotypes IV and VII in chickens., 2019,11(9): E784.
[7] KAMEL M, El-SAYED A. Utilization of herpesviridae as recombinant viral vectors in vaccine development against animal pathogens., 2019, 270: 197648.
[8] LEMIALE F, ASEFA B, YE D, CHEN C, KOROKHOV N, HUMEAU L. An HIV-based lentiviral vector as HIV vaccine candidate: immunogenic characterization., 2010, 28(8): 1952-1961.
[9] LIN A, BALAZS A B. Adeno-associated virus gene delivery of broadly neutralizing antibodies as prevention and therapy against HIV-1., 2018,15(1):66.
[10] 展小过,乔传玲,杨焕良,陈艳,孔维,辛晓光,陈化兰. 表达H3N2亚型猪流感病毒HA基因重组腺病毒对小鼠免疫原性的研究. 中国农业科学, 2010,43(6):1235-1241.
ZHAN X G, QIAO C L, YANG H L, CHEN Y, KONG W, XIN X G, CHEN H L. Immunogenicity of a recombinant adenovirus expressing HA gene of H3N2 subtype swine influenza virus in mice., 2010, 43(6): 1235-1241. (in Chinese)
[11] 陈化兰, 马文军, 于康震. 表达禽流感病毒血凝素基因的重组禽痘病毒的构建, 中国农业科学, 2000, 33( 5): 1-7.
CHEN H L, MA W J, YU K Z. Construction of a recombinant fowlpox virus expressing hemagglutinin gene of avian influenza virus., 2000, 33( 5): 1-7. (in Chinese)
[12] CHEN P, DING L, JIANG Y, ZENG X, DENG G, SHI J, LI Y, LIU L, ZHAO Y, HU Y, LIU J, CHEN H. Protective efficacy in farmed ducks of a duck enteritis virus-vectored vaccine against H5N1, H5N6, and H5N8 avian influenza viruses., 2019, 37(40): 5925-5929.
[13] DING L, CHEN P, BAO X, LI A, JIANG Y, HU Y, GE J, ZHAO Y, WANG B, LIU J, CHEN H. Recombinant duck enteritis viruses expressing the Newcastle disease virus (NDV) F gene protects chickens from lethal NDV challenge., 2019, 232:146-150.
[14] CHANG P, YAO Y, TANG N, SADEYEN J R, SEALY J, CLEMENTS A, BHAT S, MUNIR M, BRYABT J E, IQBAL M. the application of nhej-crispr/cas9 and cre-lox system in the generation of bivalent duck enteritis virus vaccine against avian influenza virus., 2018, 10(2): E81.
[15] ZOU Z, HUANG K, WEI Y, CHEN H, LIU Z, JIN M. Construction of a highly efficient CRISPR/Cas9-mediated duck enteritis virus- based vaccine against H5N1 avian influenza virus and duck Tembusu virus infection., 2017,7(1):1478.
[16] ZOU Z, MA J, HUANG K, CHEN H, LIU Z, JIN M. Live attenuated vaccine based on duck enteritis virus against duck hepatitis a virus types 1 and 3., 2016, 7:1613.
[17] SUN Y, YANG C, LI J, LI L, CAO M, LI Q, LI H. Construction of a recombinant duck enteritis virus vaccine expressing hemagglutinin of H9N2 avian influenza virus and evaluation of its efficacy in ducks., 2017, 162(1):171-179.
[18] LI H, WANG Y, HAN Z, WANG Y, LIANG S, JIANG L, HU Y, KONG X, LIU S. Recombinant duck enteritis viruses expressing major structural proteins of the infectious bronchitis virus provide protection against infectious bronchitis in chickens., 2016, 130:19-26.
[19] WANG J, GE A, XU M, WANG Z, QIAO Y, GU Y, LIU C, LIU Y, HOU J. Construction of a recombinant duck enteritis virus (DEV) expressing hemagglutinin of H5N1 avian influenza virus based on an infectious clone of DEV vaccine strain and evaluation of its efficacy in ducks and chickens., 2015, 12:126.
[20] ZOU Z, HU Y, LIU Z, ZHONG W, CAO H, Chen H, JIN M. Efficient strategy for constructing duck enteritis virus-based live attenuated vaccine against homologous and heterologous H5N1 avian influenza virus and duck enteritis virus infection., 2015, 46: 42.
[21] WANG J, OSTERRIEDER N. Generation of an infectious clone of duck enteritis virus (DEV) and of a vectored DEV expressing hemagglutinin of H5N1 avian influenza virus., 2011, 159(1): 23-31.
[22] LIU J, CHEN P, JIANG Y, WU L, ZENG X, TIAN G, GE J, KAWAOKA Y, BU Z, CHEN H. A duck enteritis virus-vectored bivalent live vaccine provides fast and complete protection against H5N1 avian influenza virus infection in ducks., 2011, 85(21): 10989-10998.
[23] LIU X, WEI S, LIU Y, FU P, GAO M, MU X, LIU H, XING M, MA B, WANG J. Recombinant duck enteritis virus expressing the HA gene from goose H5 subtype avian influenza virus., 2013, 31(50): 5953-5959.
[24] CHEN P, LIU J, JIANG Y, ZHAO Y, LI Q, WU L, HE X, CHEN H. The vaccine efficacy of recombinant duck enteritis virus expressing secreted E with or without PrM proteins of duck Tembusu virus., 2014, 32(41): 5271-5277.
[25] ZOU Z, LIU Z, JIN M. Efficient strategy to generate a vectored duck enteritis virus delivering envelope of duck Tembusu virus., 2014, 6(6): 2428-2443.
[26] 陈柳,余斌,倪征,华炯钢,叶伟成,云涛,张存. 表达小鹅瘟病毒VP2蛋白重组鸭瘟病毒的构建及其生物学特性. 中国农业科学, 2016, 49(14): 2813-2821.
CHEN L, YUN B, NI Z, HUA J G, YE W C, YUN T, ZHANG C. Construction and characterization of a recombinant duck enteritis virus expressing VP2 gene of goose parvovirus.2016, 49(14): 2813-2821. (in Chinese)
[27] LI K, LIU Y, LIU C, GAO L, ZHANG Y, GAO Y, CUI H, QI X, ZHONG L, WANG X. Effects of different promoters on the protective efficacy of recombinant Marek's disease virus type 1 expressing the VP2 gene of infectious Bursal disease virus., 2016, 34(47): 5744-5750.
[28] CHEN L, YU B, HUA J, et al. Construction of a full-length infectious bacterial artificial chromosome clone of duck enteritis virus vaccine strain., 2013,10:328.
[29] 陈柳,余斌,倪征,华炯钢,叶伟成,云涛,张存. 表达鸭坦布苏病毒E 蛋白的重组鸭瘟病毒的构建及其生物学特性. 浙江农业学报,2015, 27(11): 1889-1895.
CHEN L, YU B, NI Z, HUA J G, YE W C, YUN T, ZHANG C. Construction and characterization of a recombinant duck enteritis virus expressing E protein of duck Tembusu virus. A, 2015, 27(11): 1889-1895.(in Chinese)
[30] CHEN L, YU B, HUA J, NI Z, YE W, YUN T, ZHANG C. Optimized expression of duck Tembusu virus e gene delivered by a vectored duck enteritis virus., 2019, 61(10): 783-790.
[31] 马兴树. 禽传染病试验诊断技术. 北京:化学工业出版社,2006.
MA X S.. Beijing:Chemical Industry Press, 2006.(in Chinese)
[32] 余斌,华炯钢,刘跃生,赵灵燕,倪征,叶伟成,云涛,陈柳,徐辉,张存. 鸭坦布苏病毒抗体间接ELISA 检测方法的建立和应用. 浙江畜牧兽医, 2014, 5 : 1-6.
YU B, HUA J G, LIU Y S, ZHAO L Y, NI Z, YE W C, YUN T, CHEN L, XU H, ZHANG C. Establishment and application of indirect ELISA for detection of duck Tembusu virus antibody., 2014, 5: 1-6. (in Chinese)
[33] TISCHER B K, von EINEM J, KAUFER B, OSTERRIEDER N. Two-step red-mediated recombination for versatile high-efficiency markerless DNA manipulation in., 2006, 40(2): 191-197.
[34] TISCHER B K, SMITH G A, OSTERRIEDER N. En passant mutagenesis: a two step markerless red recombination system. Jeff Braman(ed.),:, 2010, 634: 421-430.
[35] TSUKAMOTO K, SAITO S, SAEKI S, SATO T, TANIMURA N, ISOBE T, MASE M, IMADA T, YUASA N, YAMAGUCHI S. Complete, long-lasting protection against lethal infectious bursal disease virus challenge by a single vaccination with an avian herpesvirus vector expressing VP2 antigens., 2002, 76(11): 5637-5645.
[36] MA C, ZHANG Z, ZHAO P, DUAN L, ZHANG Y, ZHANG F, CHEN W, CUI Z. Comparative transcriptional activity of five promoters in BAC-cloned MDV for the expression of the hemagglutinin gene of H9N2 avian influenza virus., 2014, 206: 119-127.
[37] LI L, ZHANG Y, DONG J, ZHANG J, ZHANG C, SUN M, CAO Y. The truncated E protein of DTMUV provide protection in young ducks., 2020, 240: 108508.
Optimized Promoter Regulating of Duck Tembusu Virus E Protein Expression Delivered by a Vectored Duck Enteritis Virus
CHEN Liu, NI Zheng, YU Bin, HUA JiongGang, YE WeiCheng, YUN Tao, LIU KeShu, ZHU YinChu, ZHANG Cun
(Institute of Animal Husbandry and Veterinary Medicine, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021)
【】 Duck enteritis virus (DEV) and duck Tembusu virus (DTMUV) are considered to be two of the important viruses that infected ducks. DEV is classified into the familywhich has the characterization of live viral vector. 【】In our previous study, a recombinant DEV delivering optimized DTMUV E451 gene (E451-dk) referring to duck’s codon usage bias has been selected. In this study, the promoter regulating E451-dk (Es in short) in rDEV-EF1 was also evaluated for enhancing E451-dk expression level. 【】The transfer vector pEP-BGH-pro-Es were constructed by separately substituted pCMV (cytomegalovirus major immediate-early promoter) on the vector pEP-BGH-Es with pCAG (human cytomegalovirus enhancer and chicken-actin promoter), pSV40 (the simian virus 40 promotor), pRSV(Rous sarcoma virus (RSV) promoter), pgB(MDV)(marek's disease virus (MDV) gB gene promoter) and p1.8k(MDV)(MDV 1.8k gene promoter). The recombinant DEV BAC clone pDEV-pro-Es carrying pro-Es genes were generated by two-step Red E/T recombination in. pDEV-pro-Es were constructed by inserting pro-Es expression cassette between DEV US7 and US8 genes on the infectious clone of DEV (pDEV-EF1). The recombinant virus rDEV-pro-Es (rDEV-pCAG-Es, rDEV-pSV40-Es, rDEV-pRSV-Es, rDEV-pgB(MDV)-Es and rDEV-p1.8k(MDV)-Es) were rescued from chicken embryo fibroblasts (CEFs) by calcium phosphate precipitation. The plaque size and expression of DTMUV Es in recombinant virus-infected CEFs were analyzed. 【】 All viruses were successfully rescued from CEFs. Western blot analysis showed that the expression level of Es in rDEV-pRSV-Es -infected cells was increased 169.12% compared to that of rDEV-Es -infected cells. 【】pRSV was the highest effective promoter chosen in this study which regulating Es expression on recombinant DEV genome backbone. These studies laid a foundation for developing bivalent vaccine controlling DEV and DTMUV infection.
duck enteritis virus; duck Tembusu virus; E protein; bacterial artificial chromosome; viral vector; promoter

10.3864/j.issn.0578-1752.2020.24.015
2020-01-17;
2020-07-29
国家自然科学基金面上项目(31670150)、国家重点研发计划(2016YFD0500107)、浙江省公益技术应用研究项目(2016C32070)
陈柳,Tel:0571-86404257;E-mail:haoliuzi@126.com。通信作者张存,Tel:0571-86404182;E-mail:zhangcun@aliyun.com
(责任编辑 林鉴非)

