不同微藻饵料对卤虫生长及水环境变化的影响
马婷,柴英辉,贾旭颖,高金伟,窦勇,邵蓬,周文礼
不同微藻饵料对卤虫生长及水环境变化的影响
马婷,柴英辉,贾旭颖,高金伟,窦勇,邵蓬,周文礼通信作者
(天津农学院水产学院天津市水产生态与养殖重点实验室,天津300392)
为了探讨不同微藻饵料对卤虫生长及养殖水环境的影响,采用单独和混合培养的方式,以3种海水微藻(球等鞭金藻、塔胞藻和杜氏盐藻)为饵料饲养卤虫,测定卤虫体长、体重等生长指标及养殖水体pH、温度、盐度、溶解氧的变化。试验结果表明:不同微藻饵料搭配养殖卤虫的效果差异明显,水环境变化也存在较大差异。其中球等鞭金藻和塔胞藻混合饲养的卤虫效果最为理想,卤虫的存活率高,相对增长率大,水环境维持稳定,为卤虫生长提供了良好的水环境。因此在水产渔业生产上,球等鞭金藻和塔胞藻配合形成的饵料可作为增加卤虫存活率和相对增长率的适口饵料进行推广应用。
卤虫;球等鞭金藻;塔胞藻;杜氏盐藻;存活率;相对增长率
卤虫()也称盐水丰年虫,是小型低等甲壳动物,分布极广,分类上属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、鳃足亚纲(Branchiopoda)、无甲目(Anostraca)、卤虫科(Artemiidae)、卤虫属()[1]。卤虫是一种重要的水产饵料,其蛋白质含量高达60%,且富含必需氨基酸、类胡萝卜素、鱼虾味觉诱引剂等[2]。卤虫作为基础研究材料已被广泛应用于水生生物学、发育生物学、遗传学、生理学、毒理学、放射生物学和分子生物学研究。且卤虫含有丰富蛋白质和不饱和脂肪酸,是鱼、虾、蟹等幼体优良的开口活饵料,可充分满足对虾、牙鲆等幼体的营养需求[3]。赵素芬等[4]研究发现,卤虫的生长、繁殖不仅与外界理化因素有关,也与水环境因素尤其是饵料的质与量有密切关系。
目前人工养殖卤虫用到的饵料主要是海水单胞藻类、藻粉、面粉和酵母等[5]。海洋单胞藻类是海洋生态系统中的主要生产者[6],藻类利用自身光合作用转变无机物为有机物供生物利用,是海洋生物的重要饵料。单胞藻营养全面,特别是DHA和ARA含量丰富,同时单胞藻还进行光合作用,降低水体的氨氮和硝酸盐含量,净化水质,具有开发的潜质。茹文红[7]通过投喂酵母粉或螺旋藻粉分析不同饵料对卤虫生长、存活及消化酶活性的影响。陈家鑫[8]研究表明,裂壶藻无论细胞大小还是可消化性对于轮虫和卤虫无节幼体都很合适。苏琳[9]初步探究了酵母培养物对卤虫无节幼体生长、体成分的影响,从中筛选出酵母培养物的最适添加量。张群跃等[10]采用湛江叉鞭金藻、亚心形扁藻、小球藻强化营养卤虫幼体,结果表明微藻营养强化有利于提高卤虫幼体生长和EPA含量,其中以扁藻的强化效果最为显著。常见的球等鞭金藻、塔胞藻、杜氏盐藻作为单一或者混合饵料对卤虫相对增长率和存活率的影响还未见 报道。
生物与生态环境之间不断进行着能量交换与物质交换[11],水生生物的生长与优质的水环境密不可分,两者相互依存、影响、制约。卤虫等甲壳类动物的生长也受养殖水体中温度[12]、盐 度[13-15]、pH[16]、溶解氧[17]、光照[18]、水体污染物[19]的影响。同时,卤虫营养强化最重要的生物因素——微藻饵料具有快速吸收氮、磷和较高生长速率、产氧能力的优点[20],微藻还受水体养分浓度、水体中悬浮颗粒物、微生物的影响,因此养殖水环境变化影响着卤虫的生长。本试验通过给卤虫投喂球等鞭金藻、塔胞藻、杜氏盐藻及等密度等体积混合藻液,测定卤虫的体长、体重、成活率等生长指标,同时监测养殖卤虫水环境中pH、溶解氧、水体温度、盐度的变化,旨在寻找提高卤虫存活率的最适饵料,提高卤虫体营养含量进而满足日益发展的水产养殖业生物生长营养需求。
1 材料和方法
1.1 试验材料
试验用卤虫卵由天津海友佳音生物科技有限公司提供,置于4 ℃冰箱密封保存待用。球等鞭金藻、塔胞藻、杜氏盐藻均由天津农学院水生生物生态实验室提供。
1.2 藻液培养与浓缩
藻液采用f/2培养基培养,将配制好的培养液与藻液按1∶1比例混合,置于光照培养箱中培养。在温度为26 ℃、光照为72 μmol/(m2·s)、光照周期为12∶12(L∶D)条件下进行扩大培养。通过浓缩培养方式,待每种藻液密度达5×107cell/mL时离心,应用低温保存法[21]保存备用。
1.3 卤虫孵化
按卤虫卵∶NaHCO3∶海水=1 g∶1 g∶1 L的比例孵化卤虫,将15 g卤虫卵在预处理的海水(已曝气24 h、温度为28 ℃、盐度为30‰)中孵化24 h。孵化过程中搅拌均匀并充气,孵化时光照强度为72 μmol/(m2·s)。
1.4 卤虫的饲养方法
孵化结束取出气石,静置5 min将卤虫无节幼体与孵化后剩余的卤虫卵壳、未孵化或已死亡的卤虫卵进行分离,将分离后的卤虫收集并分为5个试验组,每个试验组设置3个重复,养殖水体的温度维持在(28±2)℃,溶氧量维持在5 mg/L以上。
饲养卤虫过程中的饵料投喂情况见表1,前3组分别投喂球等鞭金藻、塔胞藻、杜氏盐藻,每次投喂量5 mL,第四、五组则将备好的两种藻液,分别取2.5 mL,搅拌搅匀,使两种藻液充分混合,制成混合液(与前3组等体积),再投喂卤虫。每日8:00、13:00、19:00定时投喂饵料,试验养殖周期为15 d。每天测定卤虫体长、体重等生长指标,同时监测水环境的温度、盐度、溶解氧和pH值,每两天测定一次水体中氨态氮、亚硝态氮、硝态氮含量,15 d后计算卤虫存活率。

表1 不同分组饵料情况
1.5 指标检测方法
每组随机选出10只卤虫幼体,在光学显微镜(目镜4×、物镜0.1×)下测量体长并求其平均值。用小捞网捞取卤虫后,用镊子夹取至滤纸上,用电子天平测量卤虫湿重,每次取3次样,计算平均值。卤虫数量的计算方法:随机取1 mL卤虫计数,每次取3次样,计算平均值。
成活率=/×100%(—卤虫的有效个体数,—卤虫的全部个体数)
养殖水环境指标检测:溶解氧用水质分析仪检测;水体中盐度使用盐度计检测;温度和pH值用pH仪检测。
1.6 水质控制
本试验全程不换水,培养期间进行吸污,在吸污的同时补充等量人工海水[22]。试验过程中将养殖水体氨氮值维持在0.6 mg/L以下、亚硝态氮维持在0.25 mg/L以下、硝酸盐维持在50 mg/L 以下。
1.7 统计分析
采用Excel 2010和Origin 8.0软件绘制图形,利用SPSS软件进行检验和单因子方差分析鉴定数据差异性,<0.05为显著性差异水平。
2 结果
2.1 不同饵料投喂卤虫的生长指标测定结果
不同饵料投喂情况下,卤虫的体长生长存在较大差异(图1)。在15 d的试验观察期内,投喂塔胞藻组的卤虫,前期生长较为缓慢,从第六天开始体长生长稳定,到第十二天卤虫体长生长开始缓慢;投喂球等鞭金藻和塔胞藻组的卤虫在第五天开始迅速生长,表现出显著的生长优势,其体长显著高于其他处理组;投喂杜氏盐藻组的卤虫在整个试验周期生长最为缓慢,投喂球等鞭金藻组、球等鞭金藻和杜氏盐藻组的卤虫体长一直维持稳定增长。试验结束时,不同饵料饲养的卤虫体长依次为:球等鞭金藻和塔胞藻组>塔胞藻组>球等鞭金藻组>球等鞭金藻和杜氏盐藻组>杜氏盐藻组。
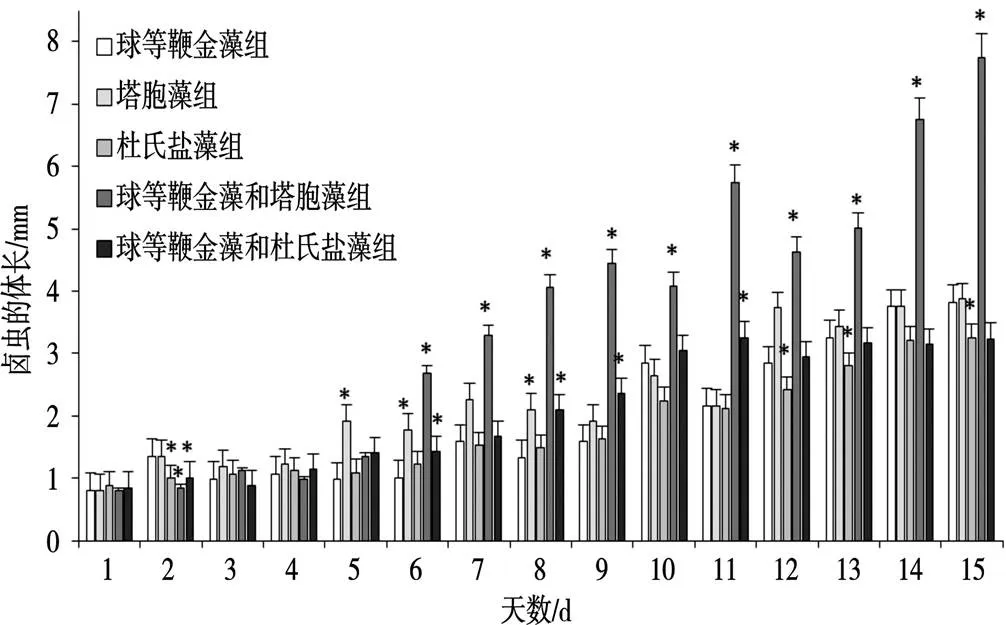
图1 不同饵料投喂对卤虫体长的影响
注:“*”表示差异显著(<0.05),“**”表示差异极显著(<0.01)
塔胞藻组、杜氏盐藻组饲养的卤虫体长相对增长率均呈现缓慢增长趋势,在第二天到第十天增长率有小幅上升,从第十天开始增长率处于相对平稳期;采用球等鞭金藻饲养的卤虫在第四天体长的相对增长率达到最大值(37%),从第五天开始,卤虫的体长相对增长率逐渐呈降低趋势,到后期(第十一天以后),卤虫体长相对增长率趋近于零,卤虫生长极缓慢;投喂球等鞭金藻和塔胞藻组、球等鞭金藻和杜氏盐藻组的卤虫体长相对增长率极其相似。两组均在第六天出现最大增长率,分别达到55%和51%,第六天到第十天体长增长率波动较大,从第十天开始增长率维持稳定。在试验结束时,不同饵料饲养的卤虫体长相对增长率依次为:塔胞藻组>杜氏盐藻>球等鞭金藻和塔胞藻组>球等鞭金藻和杜氏盐藻组>球等鞭金藻组(图2)。
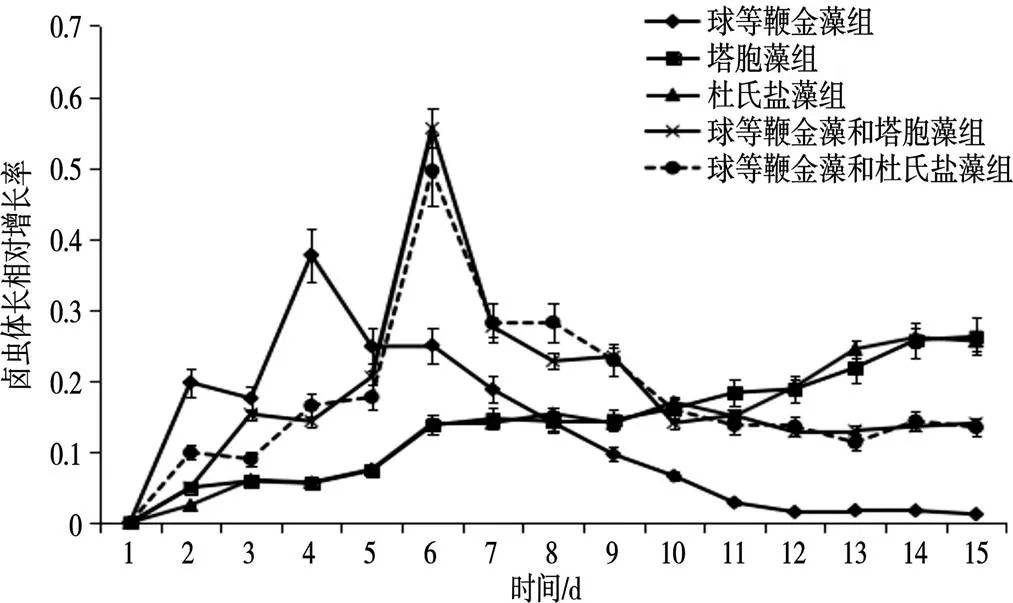
图2 不同饵料投喂对卤虫体长相对增长率的影响
不同饵料投喂对卤虫体重、体长、成活率有较大影响(表1)。15 d的试验观察期结束时,球等鞭金藻组卤虫成活率较高,为83.72%,呈现显著差异(<0.05);塔胞藻组卤虫成活率为45.39%;球等鞭金藻和塔胞藻组卤虫成活率最高,为86.02%,有极显著差异(<0.01);杜氏盐藻组成活率最低,仅为10%。用球等鞭金藻饲养的卤虫个体大小中等,平均体长为1.96 mm,体重为10.55 mg,体重较大;用塔胞藻饲养的卤虫体长最小的为1.01 mm,最大的可达4.88 mm,个体间差异较大;用球等鞭金藻和塔胞藻饲养的卤虫平均体长为3.61 mm,平均体重为13.78 mg,有极显著差异(<0.01),为各试验组中生长最好的一组;采用杜氏盐藻饲养的卤虫生长最差。

表1 不同饵料投喂对卤虫存活率、体长、体重的影响
注:“*”表示差异显著(<0.05),“**”表示差异极显著(0.01)
2.2 卤虫养殖水体水质指标的测定结果
球等鞭金藻和塔胞藻混合饲养的养殖水体pH值在前5 d呈小幅升高,从第六天开始缓慢降低,到第十五天降至最低值,pH为8.6,低于初始养殖水体pH,该组养殖水体的pH值存在显著差异(<0.05);塔胞藻组养殖水体pH值在前5 d也呈现小幅升高,从第六天开始缓慢降低,第七天出现最大降幅,第十五天降至8.8,与初始pH值相近;球等鞭金藻组、杜氏盐藻组、球等鞭金藻和杜氏盐藻组的养殖水体pH值维持稳定,无显著差异(>0.05)(图3)。
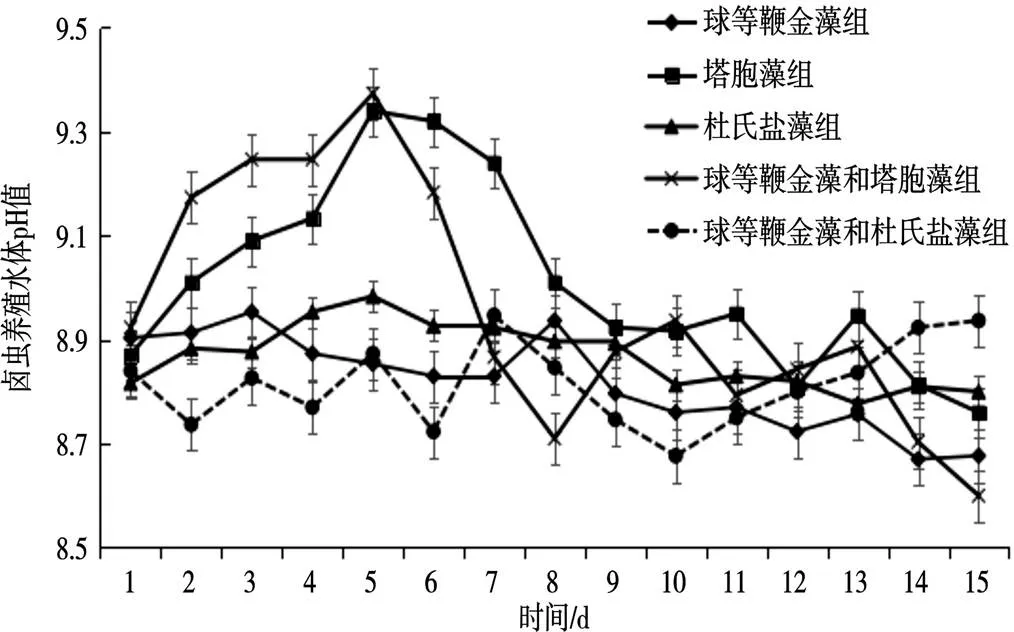
图3 卤虫养殖水体pH值测定结果
球等鞭金藻组、杜氏盐藻组、球等鞭金藻和杜氏盐藻组养殖水体溶解氧在整个卤虫培养阶段明显降低;塔胞藻组、球等鞭金藻和塔胞藻组在卤虫培养的前期明显降低,在卤虫培养的中期和后期没有显著变化,各个试验组对水体溶解氧含量的影响无显著差异(>0.05)(图4)。
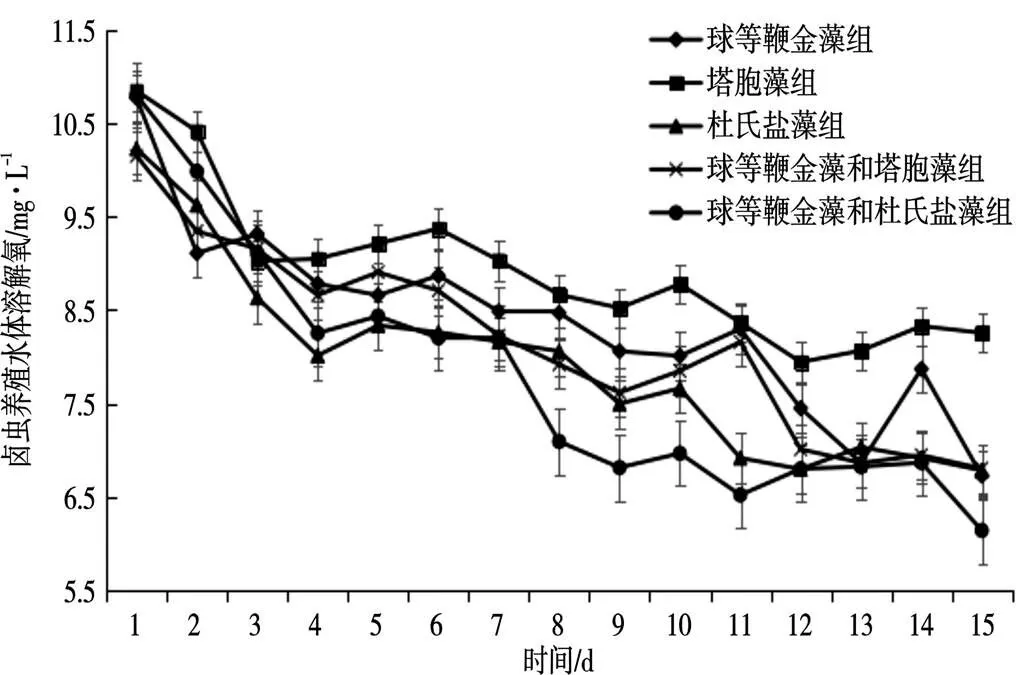
图4 卤虫养殖水体溶解氧测定结果
球等鞭金藻组、塔胞藻组、球等鞭金藻和塔胞藻组养殖水体温度不太稳定(图5),在前期均有大幅度降低,第四天后有极小幅升温趋势,后期整体趋势稳定,水体温度均回归初始温度值附近,3组养殖水温存在显著差异(<0.05);杜氏盐藻组水体温度在卤虫培养早期缓慢下降后升高,在中期又再次缓慢下降后上升到起始温度,在培养后期维持相对稳定,养殖水体温度无显著差异 (>0.05);球等鞭金藻和杜氏盐藻组养殖水体温度整体维持稳定,该组水温无显著差异(>0.05)。
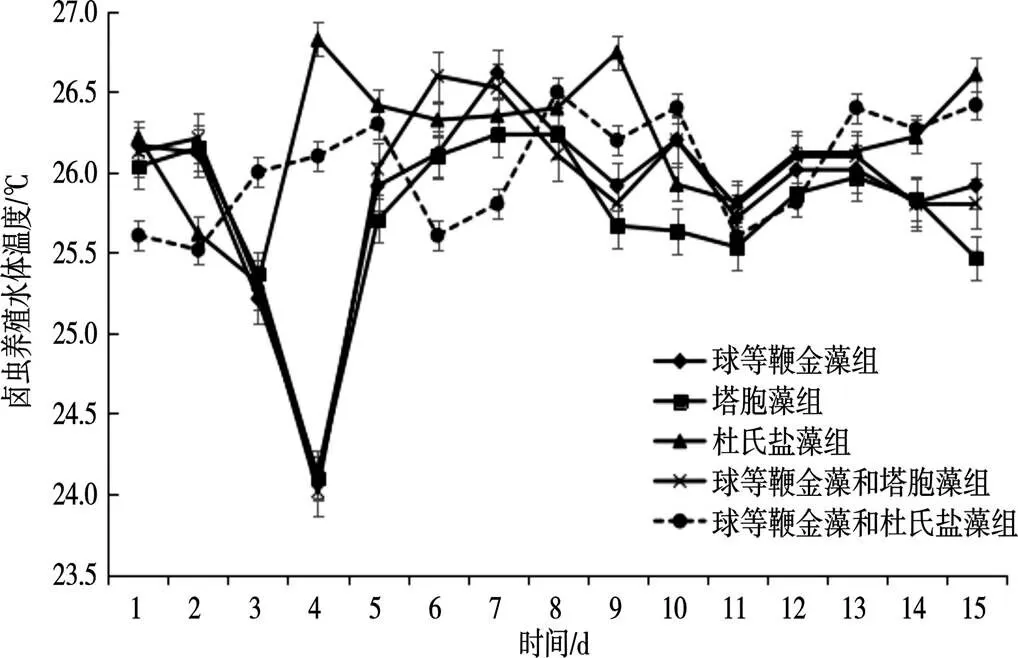
图5 卤虫养殖水体温度测定结果
球等鞭金藻组水体盐度整体呈现缓慢上升的趋势,该组养殖水体盐度无显著差异(>0.05);球等鞭金藻和杜氏盐藻组、球等鞭金藻和塔胞藻组水体盐度在卤虫培养的中后期缓慢上升,这2种饵料投喂卤虫,养殖水体盐度无显著差异(>0.05);塔胞藻组水体盐度在培养后期缓慢上升,该组养殖水体盐度无显著差异(>0.05);杜氏盐藻组养殖水体盐度波动不大,整体有极小幅度升高,该组养殖水体盐度无显著差异(>0.05)。杜氏盐藻组、球等鞭金藻和杜氏盐藻组养殖水中的盐度明显高于其他3组(<0.05)(图6)。
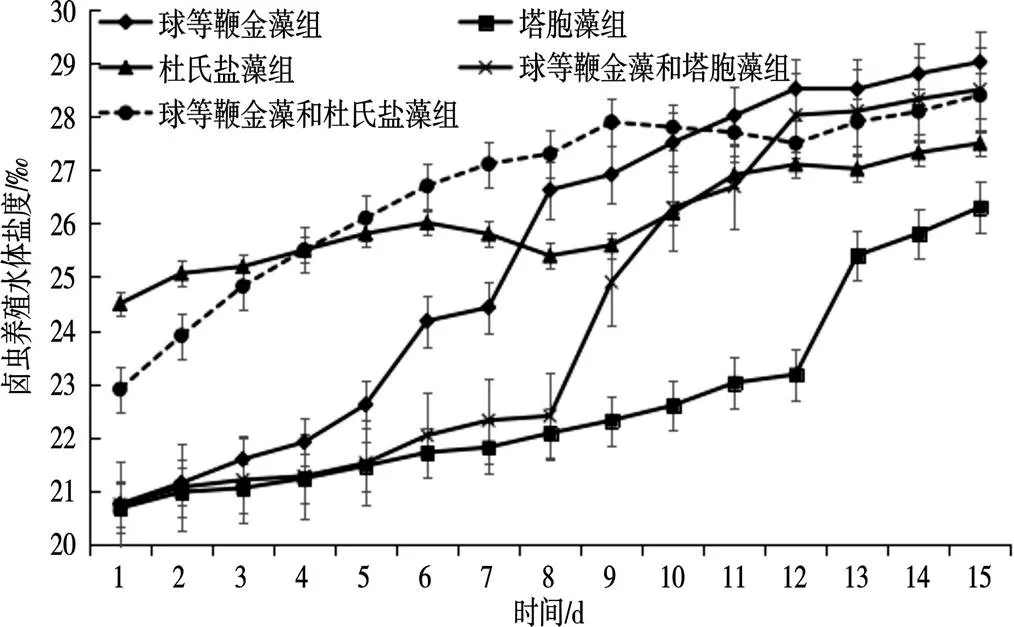
图6 卤虫养殖水体盐度测定结果
3 讨论
3.1 微藻饵料对卤虫生长的影响
饵料为浮游动物、水产经济动物等提供大量机体代谢能量,对水产生物的生长、发育、繁殖都有着重大影响[23],甚至影响着水产生物的遗传、进化。微藻是水生生态系统食物链重要的组成部分,在水产养殖业上常使用的微藻有海水小球 藻[24]、螺旋藻、球等鞭金藻、裂壶藻、盐藻等。不同微藻饵料的组成成分、营养成分有较大差异,对卤虫的作用时间也有差异,因而应针对卤虫的生长状况选择合适的饵料。张登沥等[25]研究了盐藻、麸皮、酵母对卤虫生长和生殖的影响,表明卤虫的生长与其饵料有着密切的关系。试验中,球等鞭金藻饲养的卤虫个体均匀且成活率较高,可达到83%,但个体较小,平均体长仅为5.68 mm,卤虫生长后期可能与卤虫自身需求的氨基酸等营养成分有关[26];球等鞭金藻和塔胞藻组体长处于中高水平,存活率和体重显著高于其他各试验组,这种混合饵料更利于卤虫的存活与生长;而塔胞藻组体长显著高于其他各试验组,体重、存活率较低,这一差异与投喂饵料的营养价值、消化、吸收及饵料的转化有关[27];用杜氏盐藻饲养的卤虫个体生长缓慢,成活率较低,这可能是由于杜氏盐藻在离心备用过程中营养物质流失,使饵料营养含量降低、卤虫营养摄取不足,导致个体生长缓慢、个体小、存活率低。
3.2 水环境变化对卤虫生长的影响
卤虫的生长和繁殖不仅与微藻饵料的种类、质量有关,还应考虑养殖水环境的影响。良好的水环境可以使水生生物更好地生长。NACEUR等[28]发现pH与卤虫的外部形态高度相关,是引起外部形态变异的因素之一。本试验中,随着卤虫的生长,球等鞭金藻和塔胞藻组、塔胞藻组养殖水体pH值均出现波动,影响卤虫的成活率,与刘爱英等[29]研究结果(pH影响卤虫的生长发育)相符;塔胞藻组饲养的卤虫由于饵料不适宜,导致水体中剩余藻较多,长时间积累致使水体老化、卤虫的无节幼体死亡,随着卤虫的排泄物、食物残渣、死亡幼体的腐化,水质较差,卤虫在该种环境胁迫的水域生长[30]。
温度是卤虫孵化和无节幼体时期重要的环境因素,FRANK等[31]研究表明,26 ℃条件下,卤虫幼体生长最好。在整个试验周期,水温始终维持在24~27 ℃范围内,存在小幅波动,总体温度益于卤虫生长。丁红霞等[32]研究表明,养殖温度过高会降低活动代谢,并破坏卤虫的基础代谢,进一步证实温度对卤虫生长的影响更显著。
盐度变化时,生物需消耗能量来维持体内渗透压平衡。JIA等[33]研究表明,盐度较低时耗能少,生长速度较快,反之耗能大,生长速度较慢。随着试验中养殖水盐度的变化,水环境的pH值和溶解氧也存在小幅度的波动。这一试验结果与李荣超等[34]针对天津塘沽盐场卤虫种群生态调查的结果相一致,且养殖水体的溶解氧对卤虫的生长、成活均呈现不显著差异。
3.3 微藻与水环境对卤虫的影响
卤虫是一种典型的非选择性滤食生物,50 μm以下的颗粒状物质均可被摄食[35],对食物没有选择性[36]。球等鞭金藻、塔胞藻、杜氏盐藻的直径均在卤虫的摄食范围内。研究微藻饵料对卤虫影响的同时,探究卤虫生活的环境条件和适应性,有利于对资源进行开发利用和保护。试验中,球等鞭金藻和塔胞藻组是最适合卤虫生长的饵料组,水环境因子相对维持稳态,pH、盐度、温度、溶解氧4种水环境因子对卤虫的生长有着不同的影响,同时各种环境因子间存在相互作用,4种因子交互影响,养殖环境中各因子交互作用与欧阳娟等[37]研究结论相符。就卤虫生长和水环境变化来看,球等鞭金藻和塔胞藻混合饲养的卤虫效果最为理想。
4 结论
球等鞭金藻和塔胞藻组混合饲养的卤虫体长生长较好,体重增长显著高于其他各试验组,存活率高达86.02%,其养殖水环境变化较为稳定,满足水产养殖业高质量、高产量的需求。因此,球等鞭金藻和塔胞藻混合投喂强化卤虫效果最好。
[1] 陈瑞楠. 渤海湾卤虫生物学特性及其对环境因子和营养因子的响应[D]. 天津:天津农学院,2015.
[2] LAVENS P,SORGELOOS P. The history,present status and prospects of the availability ofcysts for aquaculture[J]. Aquaculture,2000,181:397-403.
[3] 侯林,邹向阳,姚锋. 卤虫的生物学研究[J]. 生物学通报,2005(7):7-9,66.
[4] 赵素芬,阮俊锋,向志勇. 3种海藻单一或混合投喂对卤虫的饵料效果研究[J]. 海洋湖沼通报,2007(2):121-126.
[5] 孙存顿,李青,刘修业,等. 几种藻对卤虫养殖效果的比较研究[J]. 南开大学学报(自然科学),1995,28(1):102-104.
[6] 宋雨晴. 海洋单胞藻培养条件优化及对卤虫生长发育的影响[D]. 扬州:扬州大学,2018.
[7] 茹文红. 饵料对卤虫生长及消化性能的影响[D]. 上海:上海海洋大学,2018.
[8] 陈家鑫. 裂壶藻及其制品在水产苗种培育中的应用[J]. 科学养鱼,2002(6):53.
[9] 苏琳. 酵母培养物和蛋氨酸强化卤虫无节幼体及对其生长和体成分的影响[D]. 长春:吉林农业大学,2013.
[10] 张跃群,陈爱华,张雨,等. 微藻营养强化对卤虫生长和营养成分的影响[J]. 中国农业大学学报,2018,23(8):77-84.
[11] 叶映如. 生物监测在环境监测中的有效运用[J]. 企业技术开发,2015,34(29):57-59.
[12] EDISON B,ALINE M Z M,MARCELO B H. Oxygen consumption and ammonia excretion of juvenile pink shrimp(Farfantepenaeus paulensis)in culture:Temperature effects[J]. Marine and Freshwater Behaviour and Physiology,2016,49(1):19-25.
[13] AARSET A V,AUNAAS T. Effects of osmotic stress on oxygen consumption and ammonia excretion of the Arctic sympagic amphipod[J]. Marine Ecology Progress Series,1990,58:217-224.
[14] CHEN J C,LAI S H. Effects of temperature and salinity on oxygen consumption and ammonia-N excretion of juvenileBate[J]. Journal of Experiment,1993,165(2):161-170.
[15] FREIRE C A,RIOS L P,GIARETA E P,et al. Oxygen consumption remains stable while ammonia excretion is reduced upon short time exposure to high salinity in(Caridae:Palaemonidae),a recent freshwater colonizer[J]. Zoologia(Curitiba),2017,34:1-9.
[16] SUI L,DENG Y,WANG J,et al. Impact of brine acidification on hatchability,survival and reproduction ofandin salt ponds,Bohai Bay,China[J]. Chinese Journal of Oceanology and Limnology,2014,32(1):81-87.
[17] TAYLOR E W. Control and co-ordination of ventilation and circulation in crustaceans:Responses to hypoxia and exercise[J]. Journal of Experimental Biology,1982,100(1):289-319.
[18] 刘伟,王芳,钟大森,等. 光色对中国明对虾()稚虾耗氧率昼夜变化节律的影响[J]. 海洋湖沼通报,2011(3):27-31.
[19] GONÇALVES A L,SIMÕES M,PIRES J C M. The effect of light supply on microalgal growth,CO2uptake and nutrient removal from wastewater[J]. Energy Conversion and Management,2014,85:530-536.
[20] RAUL M,BENOIT G. Algal-bacterial processes for the treatment of hazardous contaminants:A review[J]. Water Research,2006,40(15):2799-2815.
[21] 张文慧,高金伟,姜智飞,等. 海洋微藻保存方法的研究进展[J]. 天津农学院学报,2016,23(4):55-57.
[22] 李亚男,辛乃宏. 卤虫养殖技术现状及影响因素[J]. 海湖盐与化工,2003(5):25-28.
[23] 蒋湘曹,家辉,文赵明,等. 不同饵料对日本囊对虾的生长与存活的影响[J]. 水产养殖,2018,39(1):8-12.
[24] 薄香兰,刘兴,窦勇,等. 小球藻生长因子CGF的研究与应用进展[J]. 天津农学院学报,2018,25(1):86-89.
[25] 张登沥,刘其根. 饵料对卤虫生长和生殖的影响[J]. 上海海洋大学学报,2000,9(2):93-96.
[26] 潘鲁青,王克行. 中华绒螯蟹幼体消化酶活力与氨基酸组成的研究[J]. 中国水产科学,1997,2(4):13-19.
[27] CLEGG J S,CONTE F P. A review of the cellular and developmental biology of[J]. The Brine Shrimp,1980,2:11-54.
[28] NACEUR H B,JENHANI A B R,ROMDHANE M S. Impacts of salinity,temperature,and pH on the morphology of(branchiopoda:Anostraca)from Tunisia[J]. Zoological Studies,2012,51(4):453-462.
[29] 刘爱英,马建新. 盐度,pH及孵化时间对卤虫孵化率的影响[J]. 海洋渔业,2000,22(1):37.
[30] 刘亚娟,周胜杰,胡静,等. 水产动物环境胁迫研究进展[J]. 天津农学院学报,2018,25(4):70-76.
[31] FRANK H H,TERRY W S. Plankton culture manual[M]. Dade:Florida Aqua Farms,2004.
[32] 丁红霞,景素琴,范佩丽,等. 光照、温度及盐度对卤虫()耗氧率与排氨率的影响[J]. 盐科学与化工,2019,48(1):19-24.
[33] WANG J Q,HOU L,YI N,et al. Molecular analysis and its expression of a pou homeobox protein gene during development and in response to salinity stress from brine shrimp,[J]. Comparative Biochemistry & Physiology Part A:Molecular & Integrative Physiology,2012,161(1):36-43.
[34] 李荣超,隋丽英,张波,等. 天津塘沽盐场卤虫种群生态调查[J]. 天津科技大学学报,2018,33(5):57-62.
[35] 魏文志,陈立. 光合细菌在卤虫饵料中的应用[J]. 水产科学,2004(7):15-17.
[36] 廖永岩,夏营顺,何碧华. 不同投饵密度对卤虫高密度养殖的影响[J]. 安徽农业科学,2011,39(26):16149-16153,16179.
[37] 欧阳娟,薛松磊,徐妍,等. 环境因素对丰年虾孵化的影响及孵化条件优化[J]. 中国饲料,2018(18):83-86.
Effects of three kinds of feed on relative growth rate and survival rate of
Ma Ting, Chai Yinghui, Jia Xuying , Gao Jinwei, Dou Yong, Shao Peng, Zhou WenliCorresponding Author
(Tianjin Key Laboratory of Aqua-ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300392, China)
In order to investigate the effects of different microalgae bait on the growth ofand the environment of aquaculture, this experiment used single and mixed culture methods to feedwith three kinds of seawater microalgae,,and. Determination of growth indicators such as body length and body weight of, and changes in pH and dissolved oxygen of cultured water were studied. The experimental results showed that the effects of different microalgae bait on the culture ofwere obvious, and the water environment changes were also different. The effect ofwas the best inthe mixed culture ofand. The survival rate ofwas high, the relative growth rate was large, and the water environment was stable, which provides a good water environment for the growth of Artemia in Bohai Bay. Therefore, the bait formed by the combination ofandcan be promoted and applied in the production of aquatic fishery as suitable bait for increasing the survival rate and relative growth rate of.
;;;; survival rate; relative growth rate
1008-5394(2020)04-0062-06
10.19640/j.cnki.jtau.2020.04.012
S963.21
A
2019-09-10
天津市自然科学基金青年项目(18JCQNJC14800);天津市131人才工程第二层次人选资助项目(J01009030726)
马婷(1995—),女,硕士在读,主要从事渔业资源与环境修复研究。E-mail:M18522362599@163.com。
周文礼(1969—),男,研究员,博士,主要从事水域生态学和微藻资源化利用研究。E-mail:wenlizhou@tjau.edu.cn。
责任编辑:张爱婷

