腺病毒介导的p53消减基因对慢性低氧性肺动脉高压大鼠的影响
张凤玉,俞霁云,陈明星,王 军,丁昌平,蔡逸婷*
(1.上海市第一人民医院检验科,上海 200080;2.上海艺星整形美容医院整形外科,上海 200030;3.扬州大学附属医院中心实验室,江苏 扬州 225001)
肺动脉高压(pulmonary artery hypertension,PAH)是由多种病因引起的慢性致死性疾病,常见的病因主要有:肺部疾病或缺氧诱发的PAH;由左心衰引起的PAH;慢性血栓栓塞性PAH;具有不明确或多种病因的PAH;肺静脉闭塞性疾病或肺毛细血管血管瘤诱导的PAH[1]。低氧性PAH是临床上最常见的病理生理过程,也是慢性阻塞性肺疾病、慢性肺心病和高原PAH等心肺疾病发生发展的关键环节[2]。当下对PAH的治疗热点多集中在分子和基因水平上[3],笔者通过持续通入N2使氧含量维持在10%左右,慢性低氧培养诱导大鼠低氧性PAH模型,用重组腺病毒载体介导的p53消减基因转染低氧性PAH模型的大鼠,旨在探索低氧性PAH大鼠模型的建立方法,观察p53对低氧性PAH大鼠肺动脉压力和细胞凋亡的影响,为低氧性PAH的研究提供实验动物模型及新的理论依据。
1 材料与方法
1.1实验动物 SD大鼠60只,雄性,体重180~200 g,7周龄,SPF级,购自上海斯莱克公司,SCXK(沪)2017-0005,合格证号20170005004525。饲养条件:温度范围20~25 ℃,相对湿度范围40%~70%,自由饮食。实验前在动物房环境中适应一周,实验过程中对动物的处置符合扬州大学动物伦理学标准。
1.2实验材料 重组腺病毒质粒Adeno-null,Adeno-p53由广州赛业生物科技有限公司构建, TurboFect Transfection reagent(R0531)购自Thermo Scientific公司,293A细胞购自长沙赢润生物技术有限公司,TUNEL细胞凋亡检测试剂盒(11684817910)购自Roche公司,蛋白酶K(RT403-01)购自天根生物有限公司,苏木素(H9627)购自Sigma公司,氯化钠注射液购自河北天成药业股份有限公司。低氧舱:ZKY-4F氧浓度监测仪,小动物呼吸机(HX-101E)、生物机能实验系统(BL-420S)购自成都泰盟软件有限公司。
1.3低氧性PAH模型的建立 将SD大鼠随机分为常氧对照组、常氧实验Adeno-null组、常氧实验Adeno-p53组、低氧对照组、低氧实验Adeno-null组和低氧实验Adeno-p53组各10只,常氧组为正常氧浓度培养,低氧组则置于常压低氧箱内,氧浓度维持在(10±0.5)%,8 h/d,连续4周。每天观察并记录大鼠外观体征、行为活动等。
1.4重组腺病毒的Adeno-p53的制备 3条构建好的pAV-p53载体质粒和空白对照组腺病毒载体质粒分别与转染试剂室温混合后,转染293A细胞,反复扩增,空斑实验法测定转染液病毒滴度。Quantitative-PCR法测得重组腺病毒Adeno-p53和空白对照组的滴度分别为3.2×1010pfu/mL和1.0×1010pfu/mL。使用前,用无菌的生理盐水将腺病毒Adeno-null与Adeno-p53稀释至3×108pfu/mL。
1.5重组腺病毒的转染 4组大鼠喂养2周后,采用气管滴入法转染重组腺病毒,大鼠用戊巴比妥钠45 mg/kg麻醉,剃毛消毒,经口-气管插管行机械通气,同时钝性分离颈部肌肉暴露气管,在会厌软骨下方气管里滴入30 μL腺病毒,浸润一段时间后。将大鼠头朝上直立,使病毒均匀分布于各肺叶。所有滴入腺病毒后的大鼠置于恒温垫上,统一右侧卧位,等待自然苏醒。滴入腺病毒12 h后分别放入低氧舱和正常培养环境中,继续饲养2周。
1.6平均颈总动脉压及平均肺动脉压测定 动物饲养4周后,巴比妥钠45 mg/kg麻醉后连接呼吸机,分离颈总动脉,结扎远心端,动脉夹固定近心端。插管后利用生物机能实验系统监测大鼠颈总动脉压,待稳定后连续监测5~10 min。分离颈总动脉后,游离右侧颈外静脉,将导管自右颈外静脉内慢慢插入,待压力波形稳定后,实时记录肺动脉压。
1.7右心室肥厚指数(right ventricular hypertrophy index,RVHI) 右心导管测压后处死大鼠,快速取出心脏,分离右心室和左心室加室间隔,分别称量右心室(right ventricular,RV)和左心室+室间隔[(left ventricle,LV)+(interventricular septum,S)]的重量,以RV/(LV+S)作为RVHI。依据RVHI评估右心室质量变化,判定有无右心室肥厚。
1.8细胞凋亡TUNEL染色 取左肺用4%甲醛固定,乙醇梯度脱水,二甲苯透明,石蜡包埋后切片。石蜡切片常规脱蜡至蒸馏水水化,PBS冲洗。Proteinase K工作液37 ℃消化20 min,PBS冲洗。每片加5 μL TDT+45 μL 荧光素标记的dUTP混合液,37 ℃反应1 h,PBS冲洗。每片加50 μL converter-POD,37 ℃作用30 min,PBS冲洗。加适量DAB底物,显微镜下控制显色,苏木素复染数秒,水洗后脱水,透明,封片后镜下拍照,随机采集5个不重复视野,计数凋亡细胞。凋亡指数(apoptosis index,AI)=动脉平滑肌细胞凋亡数目/平滑肌细胞数目。
1.9统计学方法 应用GraphPad prism 6.0统计软件分析数据。计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1实验动物一般情况观察 造模过程中正常氧培养组状态良好,行为活泼,毛发光润,饮食排便正常,无死亡出现。低氧培养组从活跃状态转入睡眠、安静、少动状态,食物饮水减少,体重降低,精神状态低迷,病死率20%。病毒滴入实验不会干扰常氧组大鼠的行为特征和活动。
2.2低氧性PAH模型的鉴定 常压下持续通入10.0% O2培养4周的大鼠与正常情况下培养的大鼠相比,平均肺动脉压力显著升高,右心室明显肥厚,差异有统计学意义(P<0.01或P<0.05),平均颈总动脉压差异无统计学意义(P>0.05)。提示低氧培养可以成功建立大鼠的低氧性PAH模型。见表1。
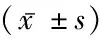
表1 低氧对照组与常氧对照组大鼠平均颈总动脉压、平均肺动脉压及RVHI的比较
2.3Adeno-p53转染对大鼠颈总动脉压及肺动脉压的影响 低氧培养条件下,与低氧实验Adeno-null组相比,低氧实验Adeno-p53组肺动脉压和RVHI降低,差异有统计学意义(P<0.05),颈总动脉压力差异无统计学意义(P>0.05)。提示p53消减可明显减低低氧性PAH的肺动脉压力。见表2。
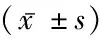
表2 低氧条件下Adeno-P53转染对大鼠颈总动脉压及肺动脉压及RVHI的影响
2.4Adeno-p53转染后检测各组大鼠肺动脉平滑肌细胞的凋亡情况 低氧实验Adeno-p53组的肺动脉平滑肌细胞的凋亡指数显著高于低氧实验Adeno-null组及低氧对照组,低氧实验Adeno-null组和低氧实验Adeno-p53组细胞凋亡指数高于常氧对照组,常氧实验Adeno-null组和常氧实验Adeno-p53组大鼠肺动脉平滑肌细胞的凋亡指数高于常氧对照组大鼠,差异有统计学意义(P<0.05)。提示p53消减会促进大鼠肺动脉平滑肌细胞的凋亡,同时亦增加低氧性PAH模型中肺动脉平滑肌细胞的凋亡。见表3,4,图1。

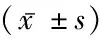
表3 常氧Adeno-null组与常氧实验Adeno-p53组凋亡细胞数比较
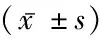
表4 低氧Adeno-null组与低氧实验Adeno-p53组凋亡细胞数比较
3 讨 论
低氧性PAH影响因素众多,且大部分相互交错形成复杂的网络关系。临床上PAH患者肺动脉平滑肌细胞增殖增多,凋亡降低,大多由平滑肌细胞的固有特征和外源性调控平滑肌细胞生长的各种基因的异常表达所致[4-5]。目前国内外的研究多集中在低氧动物模型,侧重分析各种因子的变化、血管再生和重塑、动脉狭窄、低氧诱导、细胞增殖等。本研究利用持续通入N2控制O2浓度为10%左右,模拟低氧环境,随之将大鼠置于其中28 d,复制大鼠的低氧性PAH模型,检测发现低氧条件下大鼠平均肺动脉压比常氧条件明显增加,同时低氧组大鼠右心室肥厚指数明显增高,表明低氧性PAH模型建立成功。慢性低氧是PAH形成的重要因素之一,根据最新的PAH分类指南[6],高原PAH是PAH分类的第3类,而低氧性PAH模型是高原PAH研究的首选模型,该模型制作简便,重复性高,模型中大鼠存活率高,同时接近临床PAH发病的自然病理过程,并且可以模拟临床上一般PAH患者的病理特征[7]。该模型的成功建立及其与临床PAH病理生理过程的相似性,为临床上研究低氧性PAH发病机制和新型靶向药物提供理论依据和实验基础。
p53是近年研究最为广泛和深入的肿瘤抑制基因之一,可以促进肿瘤细胞凋亡。p53是一种位于细胞核的多效性转录因子,可参与细胞内众多的生理和病理过程[8-9],包括细胞增殖、凋亡、分化、血管生成、生长因子信号传导等调节[10-11]。也有研究表明p53是低氧诱导凋亡的关键因子[12-14]。研究显示p53基因会随着低氧时间增加而在低氧性PAH大鼠肺组织中的表达逐渐增加(尤其是平滑肌细胞),且大鼠肺组织肺动脉平滑肌细胞异常增殖增加,管壁增厚,管腔狭窄,p53基因增加会促进肺动脉平滑肌细胞异常增殖,因而可以推测p53消减后,肺动脉平滑肌细胞细胞增殖减少,凋亡增加[15]。另有研究显示在PAH中表达增加的p53基因会失去下调抗凋亡基因Bcl-2的作用,使Bcl-2表达增加[16]。笔者利用p53消减腺病毒转染低氧性PAH后的大鼠,其平均肺动脉压力较低氧性PAH组大鼠明显降低,p53消减干扰后的低氧组大鼠的右心室肥厚指数与低氧对照组对比也显著降低,同时肺动脉平滑肌细胞的凋亡指数明显高于PAH模型对照组。由此推断,消减p53基因的表达可促进肺血管平滑肌细胞的凋亡,而低氧环境下促凋亡基因和促增殖基因的表达失衡是目前公认的导致肺动脉平滑肌细胞增殖的原因之一。PAH的发生发展及其严重程度与肺动脉平滑肌细胞凋亡密切相关,诱导凋亡可以减轻PAH的发病程度[14]。p53基因在特定条件下具有决定细胞命运的重要作用,研究证实低氧时肺动脉平滑肌细胞中p53等促凋亡基因减少,此过程参与低氧时肺血管壁的重建和慢性PAH的形成[17-19]。慢性低氧性PAH模型中,血管平滑肌增殖活性升高的同时,细胞凋亡也有所增强,其生理意义在于试图从整体上维持平滑肌细胞数目的动态平衡。而血管平滑肌细胞凋亡增加是为了对抗其增殖增强,是防止血管壁过度增厚的保护性反应。凋亡降低可能与p53的表达增高有关,p53可以缓解肺动脉平滑肌细胞增殖和凋亡的失衡状态,在一定程度上延缓PAH的进展。

