内镜黏膜下剥离术和内镜黏膜切除术治疗早期胃癌和癌前病变的疗效以及对血清胃蛋白酶原的影响
宋 超 张永欢 黄 莉
(兵器工业五二一医院消化内科,陕西省西安市 710065,电子邮箱:aytecxm@163.com)
早期胃癌是病变仅存在于黏膜层、黏膜下层且未出现淋巴结转移的胃部癌变。因临床多无症状或症状轻微,多数早期胃癌患者常易错过治疗良机[1]。随着医疗技术的快速发展,早期胃癌及癌前病变(下称早期胃癌-癌前病变)的检出率逐渐增高,越来越多的早期胃癌患者得到及时治疗[2]。对于早期胃癌-癌前病变,既往多采用根治性切除术治疗,该手术虽可切除病变,提高患者生存率,但存在创伤大、破坏胃解剖结构、术后并发症多等缺点[3]。目前,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)、内镜黏膜切除术(endoscopic mucosal resection,EMR)已成为临床治疗早期胃癌-癌前病变的主要选择,两者不但可彻底切除病变,且具有创伤小、胃解剖结构损伤小、术后并发症少等优势[4]。本研究探讨ESD、EMR治疗早期胃癌-癌前病变的疗效及对血清胃蛋白酶原(pepsinogen,PG)水平的影响。
1 资料与方法
1.1 临床资料 选取2014年1月至2015年12月于我院就诊的124例早期胃癌-癌前病变患者作为研究对象。纳入标准:经内镜下组织活检确诊为早期胃癌-癌前病变患者;有ESD、EMR适应证者;知情同意者。排除标准:有手术、麻醉禁忌证患者;凝血功能异常患者;病变侵犯固有肌层患者;重要脏器功能异常患者;合并其他恶性肿瘤患者;免疫抑制或免疫性疾病患者;合并其他重症慢性疾病患者;依从性差者。按随机数字表法将患者分为ESD组和EMR组,每组62例。另选取同期于我院行健康体检的62例健康者为对照组。3组一般资料差异无统计学意义(P>0.05),见表1。本研究经本院伦理学委员会批准。
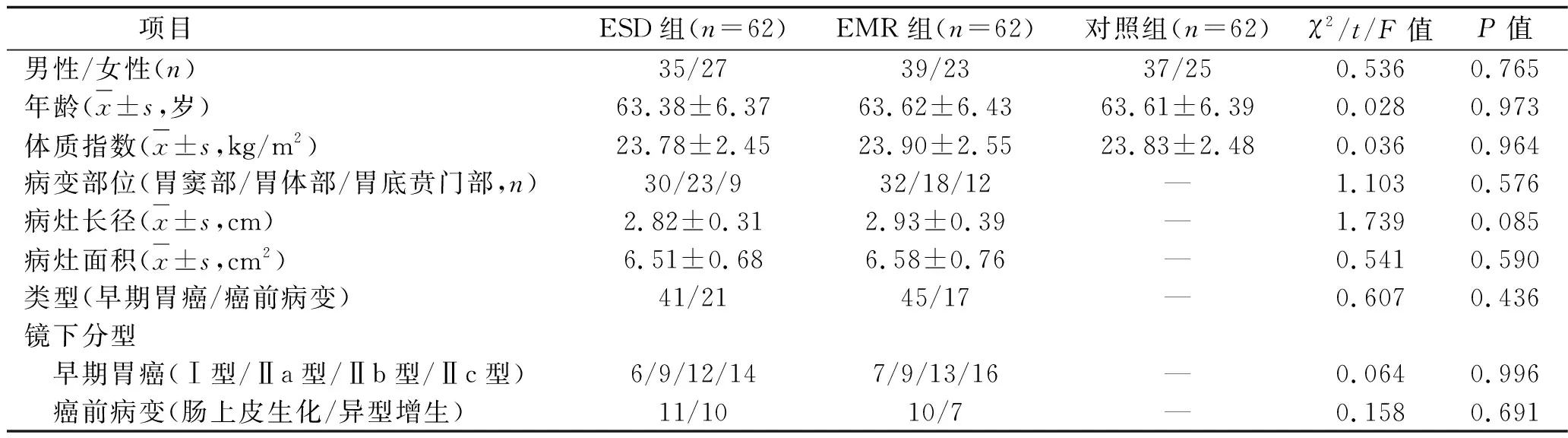
表1 3组患者一般资料比较
1.2 治疗方法
1.2.1 ESD组:患者取侧卧位,缓慢推注舒芬太尼0.15 μg/kg,静脉持续输注丙泊酚2 mg/(kg·h)。麻醉成功后,病变表面喷洒0.4%靛胭脂进行染色以界定病变范围,于病灶周围0.5 cm处,采用氩离子凝固术行电凝标记,标记间隔0.2 cm。以肾上腺素、甘油果糖及生理盐水混合液于电凝标记点外侧多点注射,2 mL/次,以确保病变完全隆起。使用Hook刀或IT刀沿电凝标记点外侧切开,直至黏膜下层,沿切开边缘行黏膜下剥离,期间间断将混合液注射至黏膜下,确保病变黏膜充分抬起,以完整切除病灶。剥离时电凝止血,确保视野清晰,病灶完整剥离后,认真检查创面,电凝处理较大血管,避免活动性出血,并将糖铝胶喷洒于创面,避免迟发性出血。切除组织后送检。术后给予抗感染、饮食干预等常规处理。
1.2.2 EMR组:患者取侧卧位,缓慢推注舒芬太尼0.15 μg/kg,静脉持续输注丙泊酚2 mg/(kg·h)。麻醉成功后,于病灶周围0.5 cm行电凝标记,标记间隔0.2 cm。于电凝标记点外侧以生理盐水多点注射,以确保病变完全隆起。小病灶行圈套器切除,大病灶行透明帽法切除,将透明帽套于内镜前端,并将高频圈套器安装于透明帽内,通过负压持续吸引将病灶黏膜吸引至透明帽内,待电凝标记点内组织完全吸入透明帽后将圈套器收紧,停止负压吸引,将圈套器收紧,电凝切除。创面处理及其他操作同ESD组。
1.3 观察指标 (1)患者病变切除情况[5]。整块切除:内镜下病灶被整块切除且获得单块标本;治愈性切除:达到完全切除(病灶整块切除)且无淋巴结转移风险;基底病灶残余:术后6个月内原切除部位及周围1 cm内病理发现肿瘤病灶。(2)术中出血量、手术时间、术中穿孔及住院时间。失血量(g)=吸净全部失血后的纱布重量(g)-干纱布重量(g),1 g=1 mL。(3)血清PGⅠ、PGⅡ水平以及PGⅠ/PGⅡ比值:采集对照组体检时、两组患者术前及术后7 d空腹静脉血5 mL于抗凝管内,3 500 r/min离心5 min取上层血清置于冰箱内待检,采用酶联免疫吸附测定法检测PGⅠ、PGⅡ水平(试剂盒厂家:北京九强生物技术股份有限公司;批号:201311051405,201312091409),均严格遵循试剂盒操作步骤进行。(4)两组患者均随访3年,如患者死亡随访自然终止,观察患者术后并发症、复发率及术后1年、3年生存情况。术后3、6、12个月行胃镜及肿瘤标志物复查,若发现新病灶和肿瘤标志物异常则认定为复发。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用成组t检验,组内治疗前后比较采用配对t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组病变切除情况比较 ESD组治愈性切除率、整块切除率均高于EMR组,基底病灶残余率低于EMR组(均P<0.05)。见表2。两组均未见切缘阳性病例。
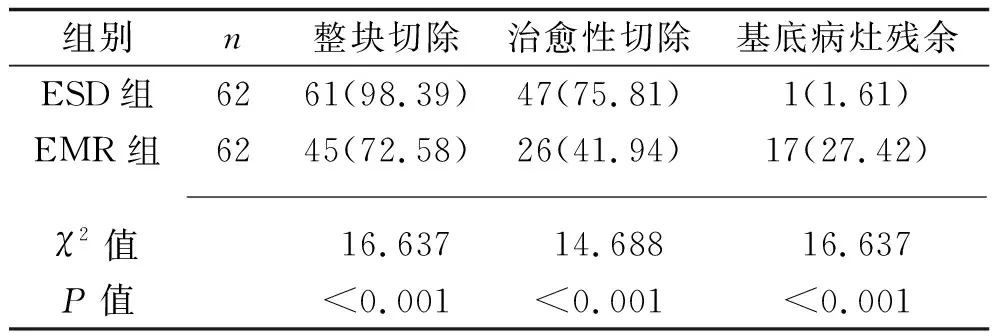
表2 两组患者病变切除情况比较[n(%)]
2.2 两组手术相关指标比较 ESD组手术时间、住院时间均长于EMR组,术中出血量多于EMR组(均P<0.05)。见表3。
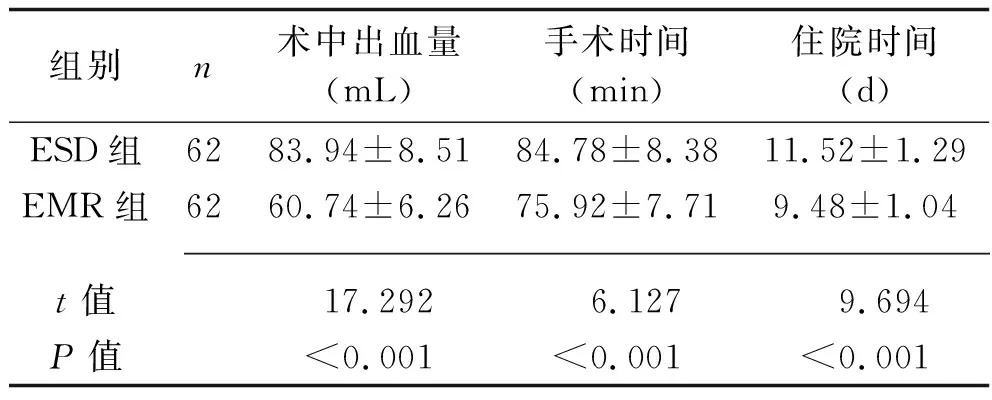
表3 两组手术相关指标比较(x±s)
2.3 3组血清PGⅠ、PGⅡ水平以及PGⅠ/PGⅡ比值比较 ESD组、EMR组术前PGⅠ水平和PGⅠ/PGⅡ比值均低于对照组,而PGⅡ水平高于对照组(均P<0.05),但ESD、EMR组PGⅠ、PGⅡ水平和PGⅠ/PGⅡ比值差异无统计学意义(均P>0.05);术后7 d,ESD、EMR组PGⅠ、PGⅠ/PGⅡ比值均较术前升高,PGⅡ较术前降低(均P<0.05);与ESD组术后水平和对照组比较,EMR组术后PGⅠ水平、PGⅠ/PGⅡ比值降低,而PGⅡ水平升高(均P<0.05),但ESD组术后上述指标与对照组比较差异均无统计学意义(均P>0.05)。见表4。
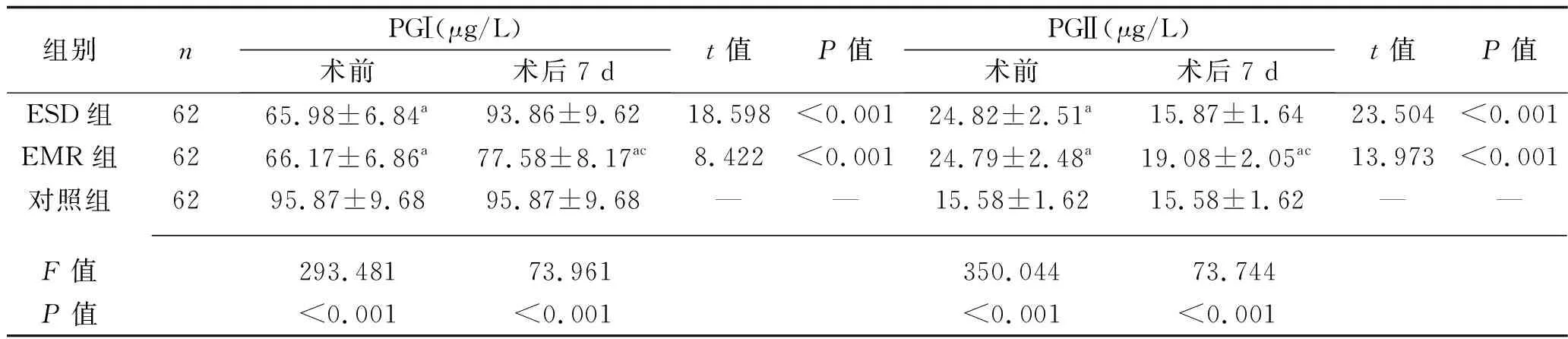
表4 3组PGⅠ、PGⅡ水平和PGⅠ/PGⅡ比值比较(x±s)

组别nPGⅠ/PGⅡ比值术前术后7 dt值P值ESD组622.66±0.28a5.91±0.6038.650<0.001EMR组622.67±0.27a4.07±0.41ac22.455<0.001对照组626.15±0.626.15±0.62—— F值1 405.654263.954P值 <0.001<0.001
2.4 两组并发症发生率、复发率及术后生存情况比较 两组患者均完成随访。ESD组并发症总发生率、复发率均低于EMR组,术后3年生存者比例高于EMR组(P<0.05),但两组术后1年生存者比例差异无统计学意义(P>0.05)。见表5。
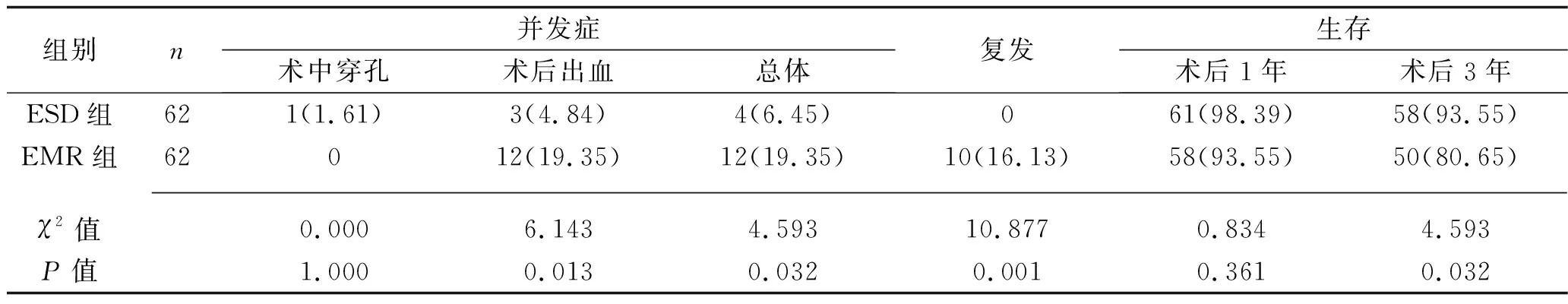
表5 两组并发症发生率、复发率和术后生存情况比较[n(%)]
3 讨 论
早期发现并完整切除病灶是成功治疗胃癌、降低复发率的关键[6]。ESD、EMR常用于治疗无淋巴结转移的早期胃癌-癌前病变患者,两者微创且可以切除或剥离病灶[7]。研究显示,EMR不仅可切除局部病变黏膜,抑制病变发展或转移,且可获得较好的组织进行病理检查,以明确病变性质、范围[8]。但因透明帽或圈套器限制,对于病变直径≥2 cm的患者则难以一次性切除,需行分片黏膜切除,而分片黏膜切除可导致切除不彻底或病灶残留[9]。此外,应用EMR行黏膜、肌层分离时,肿瘤细胞常易被注射针头带送到更深部位,导致手术不彻底,致使术后复发[10]。ESD是建立在EMR基础上的新型内镜技术,可经IT刀、Hook刀及Dual刀等工具完整切除病灶,一次性剥离病变黏膜,通常不会残留病灶[11]。ESD可切至黏膜下层,并逐步进行剥离切除,可一次性切除较大病变[12]。相关专家共识认为,ESD的治疗范围较EMR更为广泛,可治疗EMR术后复发或再次行EMR治疗困难的黏膜病变患者。此外,ESD的视野较EMR更为开阔,术中操作也较为便捷,更利于彻底切除病灶[13]。但因ESD切除范围较深,尤其是对于直径>2 cm的病灶,操作更为复杂,故易常导致术中穿孔及出血[14]。研究表明,病变位置、深度及大小是导致ESD术中穿孔的重要因素[15]。对于术中较小穿孔,通常使用止血铗进行处理,结束手术时将胃内空气吸净,给予胃肠减压,防止胃液侵蚀,术后给予抑酸、禁食等可促使穿孔痊愈[16]。为预防穿孔,术前需行超声内镜检查,准确判断病灶侵犯深度,并于切除前给予黏膜下充分注射,以确保病灶隆起,若经反复注射黏膜隆起仍不充分者,则证明病灶侵袭范围已至固有肌层,需停止操作[17]。为避免出血,术中操作需轻柔,对于可见小血管需立即处理,结束切除前需尽量减少使用止血钳,避免干扰视野导致进一步出血[18]。本研究结果显示,ESD组治愈性切除率、整块切除率、手术时间、住院时间均高于或长于EMR组,术中出血量多于EMR组。这提示ESD可有效地提高早期胃癌-癌前病变切除率,但因手术操作难度、病灶切除范围均较大,导致手术时间、住院时间较长、出血量大。
PG为胃蛋白酶前体,包括PGⅠ、PGⅡ等亚群,血清PG水平可准确反映胃黏膜功能状态[19]。其中,PGⅠ由胃底主细胞分泌,可准确反映胃壁细胞数量和胃酸分泌的关系,胃黏膜萎缩及胃酸分泌减少可导致PGⅠ水平降低[20]。胃癌发生后,在致癌因子干预下,胃底主细胞丧失分泌PGⅠ的能力[21]。PGⅡ由胃窦部腺体分泌,其水平较为稳定。 PGⅠ、PGⅡ水平及PGⅠ/PGⅡ比值可评估胃壁细胞数量及胃黏膜腺体功能状态,同时还可直观评价胃黏膜萎缩程度[22]。在本研究中,术后7 d,ESD、EMR组PGⅠ水平、PGⅠ/PGⅡ比值均较术前升高,PGⅡ较术前降低(P<0.05);且ESD组PGⅠ水平、PGⅠ/PGⅡ比值高于EMR组,PGⅡ低于EMR组(P<0.05)。这提示ESD有效切除病灶的同时,可促进胃部细胞及腺体功能恢复,纠正PG异常分泌。此外,在本研究中,ESD组并发症发生率、复发率均低于EMR组,术后3年生存者比例高于EMR组,这均提示ESD治疗早期胃癌-癌前病变效果优于EMR。
综上所述 ,ESD可有效切除早期胃癌-癌前病变,促进胃部细胞及腺体功能恢复,纠正PG异常分泌,且可降低并发症发生率、复发率。但ESD较EMR病灶切除范围均大,操作复杂,术中需谨慎操作,以降低穿孔率、出血率。

