宫颈癌患者原发灶及盆腔淋巴结中人乳头瘤病毒感染状况及其与宫颈癌复发的关系
王 彤 刘先明 王 澜 杨 梅
(四川省江油市人民医院1 妇科,2 病理科,江油市 621700,电子邮箱:g2pqya9@163.com)
宫颈癌是最常见的妇科肿瘤,在世界范围内是女性的第二大癌症。由于医疗及卫生设施欠发达,宫颈癌是发展中国家妇女的高发癌症[1]。手术是宫颈癌的标准治疗方法,淋巴清扫术常用于治疗侵袭性宫颈肿瘤和盆腔肿瘤。然而即使是早期子宫颈癌患者,子宫切除术后宫颈癌复发率仍然高达15%[2]。人类乳头瘤病毒(human papillomavirus,HPV)感染是宫颈癌发生的重要因素,且多项研究表明HPV感染与宫颈病变的严重程度高度相关,宫颈癌原发灶中的HPV及其分型与淋巴结转移有一定的相关性[3-4]。虽然HPV在宫颈癌发生和诊断中的临床意义已被证实,但宫颈癌原发灶和淋巴结中的HPV感染状况与宫颈癌进展的关系尚不明确。因此,本研究探讨HPV在宫颈癌原发灶和淋巴结中的表达及其与宫颈癌复发的关系。
1 资料与方法
1.1 临床资料 纳入2015年1月至2017年12月我院妇科收治的Ⅰ~Ⅲ期宫颈癌患者为研究对象,对其临床资料进行回顾性分析。纳入标准:均接受侵袭性宫颈癌手术和盆腔淋巴结清扫术;术前无化疗、新辅助治疗或盆腔放疗史,术后按照病理分期进行后续治疗;在标本档案库保存有相应的宫颈癌组织及淋巴组织标本。排除妊娠妇女。最终纳入98例患者,年龄(52.17±9.59)岁。
1.2 一般资料的收集 收集患者的病历资料,包括年龄、病理类型、癌细胞分化程度、国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)分期、周围组织(如深层基质、子宫旁组织、阴道边缘)的浸润情况、淋巴结旁血管情况、淋巴结总数、淋巴结组织病理学阳性情况、患者的预后情况,其中根据影像学及实验室检查确定是否复发。
1.3 HPV的检测
1.3.1 样本处理:共获得326份石蜡包埋组织(98份宫颈组织标本和228份盆腔淋巴结标本),每例患者均有相应的1份宫颈组织样本和2~4份盆腔淋巴结标本。石蜡切片经二甲苯洗涤2次、乙醇洗涤3次后,用细胞裂解缓冲液(Sigma公司)和蛋白酶K(Sigma公司)消化,再用DNA裂解试剂盒(Thermo Fisher公司,生产批号:20180210)从消化后的组织中提取DNA,按照试剂盒说明书的步骤进行操作。
1.3.2 HPV基因分型测定:使用AB15700型全自动荧光定量PCR分析仪(美国PE公司)以及人乳头瘤病毒核酸分型检测试剂盒(中大达安基因有限公司,生产批号:20180420)进行HPV基因亚型检测,按照说明书的步骤进行操作。
1.4 统计学分析 使用SPSS19.0统计软件进行统计分析。计量资料以(x±s)表示;计数资料以例数(百分数)表示,组间比较采用χ2检验;采用Logistic回归模型进行多因素分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 98例宫颈癌患者的临床病理特征 98例宫颈癌患者术后病理诊断为鳞状细胞癌88例(89.80%),腺癌10例(10.20%);共检出淋巴结228个,其中组织病理学阳性淋巴结47个(20.61%)、阴性淋巴结181个(79.39%)。术后患者随访2~5年[(27.32±7.48)个月],其中失访4例(4.08%),随访期间复发19例(19.39%),发生远处转移死亡3例(3.06%)。其他临床特征见表1。
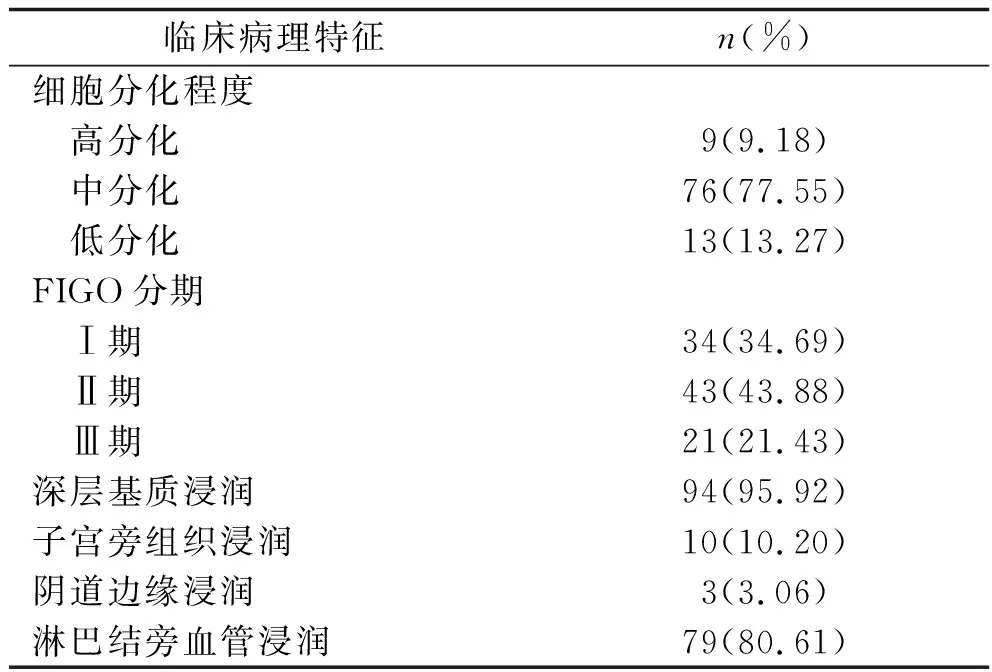
表1 98例宫颈癌患者的临床病理特征
2.2 98例宫颈癌患者原发灶和盆腔淋巴结中HPV阳性情况 98例患者中,89例(90.82%)患者的宫颈癌原发灶和盆腔淋巴结组织中HPV-DNA均为阳性;7例(7.14%)患者仅宫颈癌原发灶中HPV-DNA阳性,而盆腔淋巴结组织中HPV-DNA阴性;2例(2.04%)患者的宫颈癌原发灶和盆腔淋巴结组织中HPV-DNA均为阴性。
2.3 98例宫颈癌患者原发灶和盆腔淋巴结中HPV分型情况 在宫颈癌原发灶和盆腔淋巴结中共检测到13种HPV基因型,其中以HPV16、HPV18型为主,其次为HPV58、HPV59、HPV33、HPV68、HPV13、HPV52、HPV31、HPV43、HPV45、HPV73、HPV82型,其中HPV16、HPV18、HPV58、HPV59、HPV33、HPV68、HPV52、HPV31、HPV45、HPV82为高危型。宫颈癌原发灶中,HPV-DNA阳性共96例,阳性率为97.96%,其中HPV16检出率最高,其次为HPV18;47个转移性淋巴结中HPV-DNA阳性共39个(81.25%),181个非转移性淋巴结中HPV-DNA阳性共127个(70.17%),均以HPV16和HPV18为主。见表2。

表2 宫颈癌患者原发灶和盆腔淋巴结中HPV分型情况
2.4 宫颈癌复发的影响因素 单因素分析结果显示,宫颈癌复发与未复发患者之间FIGO分期、淋巴结旁血管浸润发生率和宫颈癌原发灶HPV16阳性率差异有统计学意义(P<0.05),见表3。将FIGO分期(赋值:Ⅰ期=0,Ⅱ期=1,Ⅲ期=2)、淋巴结旁血管浸润(赋值:否=0,是=1)和宫颈癌原发灶HPV16阳性情况(赋值:阴性=0,阳性=1)作为自变量,复发情况(未复发=0,复发=1)作为因变量,进行Logistic回归分析。结果显示,FIGO分期高、淋巴结旁血管浸润、宫颈癌原发灶HPV16阳性均是宫颈癌复发的危险因素(P<0.05),见表4。

表3 复发与未复发患者的临床病理特征以及宫颈癌原发灶和盆腔淋巴结中HPV检出情况的比较[n(%)]
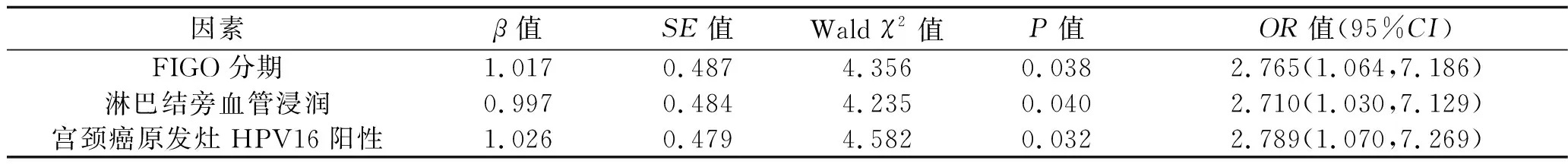
表4 多因素Logistic回归分析结果
3 讨 论
生殖器HPV感染类型已被细分为高风险类型和低风险类型,前者包括15种高危类型HPV(HPV16、18、31、33、35、39、45、51、52、56、58、59、68、73和82),通常与宫颈癌相关,其中HPV16是最常见的宫颈癌HPV感染类型;后者包括11种低危类型HPV(HPV6、11、40、42、43、44、54、61、70、72和81),主要导致生殖器疣[5]。本研究结果也显示,在98例宫颈癌患者中,宫颈癌组织HPV-DNA阳性率高达97.96%(96/98),最常见的类型为高危型HPV16、HPV18,且有部分病例同时感染HPV16和HPV18。
有研究表明高危型HPV感染与宫颈癌转移相关[6]。然而在本研究中,转移性、非转移性淋巴结中HPV-DNA阳性率均较高(分别为81.25%、70.17%),且均以高危型HPV16和HPV18为主。既往也有学者发现,在发生转移的宫颈癌患者中,超过50%的淋巴结中存在HPV-DNA,而未发生转移的患者中,淋巴结的HPV-DNA阳性率则为35.7%到90.1%[7-10]。这表明高危HPV-DNA阳性并不是影响淋巴结转移的唯一因素,其他因素也在淋巴转移过程中起着作用。例如,免疫系统可能在将病毒DNA从宫颈病变转移到淋巴结的过程中发挥了重要作用,但要实现完全转移则需要一定的侵袭性细胞类型。研究显示,CD4+/CD8+T淋巴细胞(能够识别HPV抗原)和吞噬细胞都可以将HPV-DNA从子宫颈细胞转移到淋巴结细胞[9]。HPV-DNA主要存在于非转移性淋巴结的细胞核和/或白细胞、内皮细胞、巨噬细胞和基质细胞的胞浆中,而在有转移的淋巴结中,HPV存在于所有这些相同的细胞类型以及鳞状浸润细胞中[10]。
虽然HPV与宫颈癌发病的关系已被广泛接受,但HPV类型与疾病复发的关系尚不明确。Kang等[11]研究发现,HPV18是一种可靠的早期宫颈癌预后因子,而Pilch等[12]发现,HPV16阳性与预后不良相关,但HPV18阳性与预后不良无关。本研究结果显示,在校正了年龄、肿瘤类型、分化程度等混杂因素后,除FIGO分期、淋巴结旁血管浸润外,宫颈癌原发灶HPV16阳性亦是宫颈癌复发的危险因素(P<0.05),而宫颈癌原发灶中HPV18阳性与宫颈癌复发并无相关性,分析原因可能与本研究中HPV18阳性例数较少有关。
近年来,各种分子生物学研究证实,高危HPV-DNA在宿主细胞基因组中以一种整合的模式存在。HPV-DNA由宫颈恶性细胞通过淋巴循环运送至淋巴结[13]。然而,HPV感染在宫颈癌盆腔淋巴结中的作用一直是争论的焦点。有研究显示,HPV-DNA是一种可用于监测宫颈癌患者病情复发的敏感标志物。此外,Füle等[14]研究发现,有肿瘤浸润的淋巴结较无转移的淋巴结更易携带高危HPV,然而盆腔淋巴结内的HPV状态本身并不能预测生存率。Peedicayil等[15]的研究结果中也证实这一观点,其认为盆腔淋巴结中的HPV状态并不能作为宫颈癌的预后指标。在本研究中,盆腔淋巴结中HPV16、HPV18阳性亦与宫颈癌复发无关,具体原因仍需要进一步的研究。
综上所述,宫颈癌患者原发灶和相应淋巴结中HPV阳性率均较高,均以高危型HPV最为常见;原发灶HPV16 阳性可以用来预测疾病的复发,而盆腔淋巴结中的常见高危型HPV或与疾病复发无关。

